
von Pascal Volk – Eigenes Werk, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=103143062
Schriftenreihe
Health Technology Assessment (HTA) In der Bundesrepublik Deutschland
Medizinische Wirksamkeit und Sicherheit, Kosten und Kosteneffektivität, Patienten- und soziale Aspekte, ethische Bewertung
(→ PDF-Version ←)
Petra Schnell-Inderst1, Caroline Steigenberger1, Marcel Mertz2 3, Ilvie Otto2, Magdalena Flatscher-Thöni1, Uwe Siebert1, 3, 4
Dieser HTA-Bericht ist publiziert in der DAHTA-Datenbank des BfArM (www.dimdi.de – HTA).
Die HTA-Berichte des BfArM durchlaufen ein unabhängiges Gutachterverfahren. Potenzielle Interessenkonflikte bezüglich der HTA-Berichte werden dem BfArM von den Autoren und den Gutachtern offengelegt. Die Literaturauswahl erfolgt nach den Kriterien der evidenzbasierten Medizin. Die Verantwortung für den Inhalt des Berichts obliegt den jeweiligen Autoren.
Die Erstellung des vorliegenden HTA-Berichts erfolgte gemäß gesetzlichem Auftrag nach Artikel 19 des GKV-Gesundheitsreformgesetzes 2000. Das Thema stammt aus dem öffentlichen Vorschlagsverfahren beim DIMDI, durch das Kuratorium HTA priorisiert und vom DIMDI beauftragt Der Bericht wurde mit Mitteln des Bunds finanziert.
Das DIMDI wurde gemäß Artikel 16a des Medizinprodukte-EU-Anpassungsgesetzes am 26. Mai 2020 in das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eingegliedert.
Herausgegeben vom
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Kontakt
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Kurt-Georg-Kiesinger-Allee 3
53175 Bonn
Tel: +49 228 99 307–0
Fax: +49 228 99 307‑5207
E‑Mail: [email protected]
www.dimdi.de
Schriftenreihe Health Technology Assessment, Bd. 141
ISSN: 1864–9645
1.Auflage 2021
DOI: 10.3205/hta000141L
URN: urn:nbn:de:0183-hta000141l4
© BfArM, Köln 2021.
Diese Veröffentlichung ist unter folgender Creative-Commons-Lizenz publiziert:
http://creativecommons.Org/licenses/by/4.0
Zusammenfassung
Hintergrund
Bei Frauen steht Brustkrebs sowohl bei den Krebssterbefällen mit 18.736 Todesfällen (Jahr 2016) als auch bei den Krebsneuerkrankungen an erster Stelle. Bei der Behandlung von Brustkrebs kommt in Abhängigkeit vom Tumorstatus neben der Operation unter anderem auch die Chemotherapie zum Einsatz. Sie ist in der Regel mit Nebenwirkungen wie z. B. Durchfall, Müdigkeit, Haarausfall, Fieber oder Störungen der Blutbildung verbunden. Dies beeinträchtigt die Lebensqualität der Patientinnen während der Behandlung maßgeblich.
Mistelpräparate werden zur begleitenden Behandlung von Krebserkrankungen in Deutschland eingesetzt. Ein wesentliches Behandlungsziel ist es, die gesundheitsbezogene Lebensqualität während der Therapie zu verbessern, die aufgrund der Toxizität der Chemotherapie eingeschränkt ist. Die begleitende Misteltherapie wird der komplementären beziehungsweise der integrativen Medizin zugeordnet. Die biochemischen Wirkmechanismen der Mistelpräparate werden auf Mistellektine und Viscotoxine zurückgeführt, die eine unspezifisch immunstimulierende und eine zytostatische Wirkung aufweisen. Auf dem deutschen Markt werden anthroposophische Mistelextrakte ohne standardisierten Lektingehalt und als pflanzliche Heilmittel registrierte Mistelpräparate mit standardisiertem Lektingehalt vertrieben. Alle Mistelpräparate sind rezeptfrei. Die Kosten der Misteltherapie im Rahmen einer Palliativbehandlung bei Patientinnen mit metastasiertem Brustkrebs werden von der Gesetzlichen Krankenversicherung (GKV) übernommen. Eine adjuvante Behandlung bei nicht-metastasiertem Brustkrebs wird aufgrund der bisherigen unsicheren Evidenzlage nicht übernommen. Ein früherer Health Technology Assessment (HTA)-Bericht, der die „Misteltherapie als begleitende Behandlung zur Reduktion der Toxizität der Chemotherapie maligner Erkrankungen” untersuchte, kam zu dem Schluss, dass sich nur bei Brustkrebs Hinweise dafür ergäben, dass eine begleitende Misteltherapie die gesundheitsbezogene Lebensqualität verbessern könnte. Im vorliegenden HTA-Bericht wird analysiert, ob es inzwischen neue Evidenz zur medizinischen Wirksamkeit und Sicherheit gibt, die diese Fragen klären kann. Zudem werden auch Kosten und Kosteneffektivität, Patientenaspekte und soziale Implikationen sowie ethische Fragen, die mit einer begleitenden Misteltherapie bei Brustkrebs verbunden sind, systematisch untersucht.
Forschungsfragen
Verringert die zusätzliche Gabe von Mistelpräparaten patientenrelevante Nebenwirkungen der konventionellen Chemotherapie und verbessert sie die gesundheitsbezogene Lebensqualität bei Patientinnen mit Brustkrebs im Vergleich zur Chemotherapie ohne eine Begleittherapie mit Mistelpräparaten? Wie ist der Effekt auf das progressionsfreie Überleben oder auf die Gesamtüberlebenszeit bei Patientinnen mit Brustkrebs?
Wie hoch sind die Unterschiede in den Kosten einer begleitenden Misteltherapie und wie ist die Kosteneffektivität der begleitenden Misteltherapie im Vergleich zur Behandlung ohne Mistelpräparate? Welche Einstellungen, Erfahrungen, Wahrnehmung und welches Wissen haben Patientinnen und Fachpersonal hinsichtlich der begleitenden Misteltherapie? Gibt es Hindernisse für den Zugang zur Misteltherapie für interessierte Patientinnen? Wie sieht die Arzt-Patienten-Kommunikation zur begleitenden Misteltherapie aus und gibt es Punkte, die für eine adäquate Inanspruchnahme besonders kommuniziert werden sollten?
Welche ethischen Aspekte auf individueller, gesellschaftlicher und berufsethischer Ebene sind bei der Misteltherapie als Begleittherapie bei Patientinnen mit Brustkrebs im Vergleich zur konventionellen Therapie allein relevant? Zu welchem Ergebnis kommen eine Bewertung und Abwägung der identifizierten ethischen Aspekte und Herausforderungen, das heißt, insbesondere unter welchen Bedingungen ist der Einsatz der begleitenden Misteltherapie bei adjuvanter und palliativer Behandlung von Brustkrebs ethisch vertretbar?
Methodik
Es wurden systematische Übersichtsarbeiten zur medizinischen Wirksamkeit und Sicherheit, von Kosten und Kosteneffektivität, von Patienten- und sozialen Aspekten sowie zur ethischen Bewertung durchgeführt. Für Patienten- und soziale Aspekte sowie die ethische Bewertung wurden auch Methoden der qualitativen Inhaltsanalyse angewendet.
Ergebnisse
Zur Bewertung der medizinischen Wirksamkeit und Sicherheit wurden insgesamt sieben Studien, zur Bewertung von Kosten und Kosteneffektivität eine Studie, zur Bewertung von Patienten- und sozialen Aspekten 13 Studien, zur ethischen Bewertung 17 Fachartikel eingeschlossen.
Es konnten keine randomisierten kontrollierten Studien zur medizinischen Wirksamkeit der begleitenden Misteltherapie hinsichtlich des Gesamtüberlebens bei Patientinnen mit Brustkrebs identifiziert werden. Eine Studie mit geringen Patientenzahlen zeigte nach fünf Jahren keinen Unterschied im krankheitsfreien Überleben zwischen Patientinnen mit und ohne begleitender Misteltherapie.
Es gibt Evidenz aus drei randomisierten Studien dafür, dass Nebenwirkungen der Chemotherapie abgemildert und die gesundheitsbezogene Lebensqualität 15 bis 18 Wochen nach Therapiebeginn erhöht wird. Die Effekte sind eher gering bis moderat. Es ist unsicher, ob diese Effekte durch systematische Verzerrung der nur subjektiv messbaren Zielgrößen aufgrund unzureichender Verblindung in den Studien bedingt sein könnten.
Bekannte Nebenwirkungen der Misteltherapie, wie leichtgradige und moderate Lokalreaktionen, die in diesen und weiteren vier nicht-randomisierten Studien erhoben wurden, sind häufig, aber geringen Ausmaßes. Mögliche Wechselwirkungen zwischen Krebsmedikamenten und Mistelextrakten, die auf der Immunstimulation beruhen könnten, wurden in den eingeschlossenen Studien in diesem HTA-Bericht nicht untersucht.
Zu Kosten und Kosteneffektivität einer begleitenden Misteltherapie gibt es keine ausreichend validen Studien.
Aus zehn Studien, in denen Patientinnen mit Brustkrebs befragt wurden, geht hervor, dass im Median 24,9 % (Spannweite: 7,3 bis 46,3 %) der Patientinnen mit Brustkrebs eine Misteltherapie anwenden. Drei Studien, in denen Fachpersonal (meistens Ärztinnen und Ärzte) befragt wurden, berichten, dass im Median 29,3 % (Spannweite: 29,3 bis 79,2 %) die begleitende Misteltherapie einsetzen.
Zu Wissen, Einstellung, Akzeptanz, Zufriedenheit, Erfahrungen, Erwartungen, Zugang, Art und Umfang der Arzt-Patienten-Kommunikation und Information zur Misteltherapie aus Patientinnensicht liegen nur wenige Studien mit geringer Stichprobengröße vor. Motive für die Anwendung komplementär- sowie integrativmedizinischer Verfahren und der begleitenden Misteltherapie sind der Wunsch, nichts unversucht zu lassen, eine aktive Rolle in der Behandlung einzunehmen, die Standardtherapie entweder zu ergänzen oder sie sanfter ohne Nebenwirkungen zu gestalten. Konkret ist die Anwendung der Misteltherapie mit der Erwartung verbunden, die Nebenwirkungen bei der konventionellen Krebstherapie zu reduzieren und das Immunsystem zu stimulieren. Gründe für die Anwendung der begleitenden Misteltherapie beim Fachpersonal waren der Wunsch und die Motivation der Patientinnen, die Erweiterung des eigenen Angebotsspektrums, die eigene Überzeugung oder der Glaube an die Unwirksamkeit der konventionellen Therapie. Als Grund gegen die Anwendung wurde genannt, dass Zeit verloren gehe, unkonventionelle Methoden zu teuer seien und die Anwendung konventioneller Methoden verhindert werde. Zudem fehle spezifisches Fachwissen und Personal.
Die Studien weisen auch darauf hin, dass sich die Patientinnen häufig nicht ausreichend durch Fachpersonal beraten fühlen und dass die Patientinnen – z. B. bei ablehnender Haltung gegenüber der Misteltherapie bei den Behandelnden- die Behandelnden dann nicht über eine stattfindende Misteltherapie informieren.
Im Rahmen der ethischen Bewertung wurden 26 ethische Aspekte identifiziert und den verwendeten ethischen Prinzipien Nutzen, Schaden, Selbstbestimmung, Gerechtigkeit, Effizienz und Legitimität zugeordnet.
Ein Dreh- und Angelpunkt der ethischen Bewertung der palliativen (und auch adjuvanten) Misteltherapie bei Brustkrebs stellt die problematische Evidenzlage hinsichtlich Wirksamkeit und Sicherheit dar. Zum einen beziehen sich manche ethischen Aspekte beziehungsweise Kriterien/Konflikte unmittelbar auf diese, so etwa all jene, die mit der Abschätzung und Abwägung von Nutzen- und Schadenspotenzialen zu tun haben. Zum anderen sind aber auch weitere ethische Aspekte beziehungsweise Kriterien/Konflikte von der Evidenzlage abhängig, so die Bedingungen einer erfolgreichen informierten Einwilligung in eine Therapie (Aufklärung über Nutzen- und Schadenspotenziale, Informierung über die Evidenzlage beziehungsweise Stand der Wissenschaft) oder die Kommunikation zwischen Ärztinnen/Ärzten und Komplementär-/Integrativmedizinisch-Behandelnden aufgrund möglicher Diskrepanzen bei der Einschätzung der Wirksamkeit.
Bei diesen Entscheidungen wird – zumindest, solange Schadenspotenziale als minimal eingeschätzt werden und die Finanzierung unproblematisch ist – im konkreten Einzelfall im besonderen Maße die Selbstbestimmung der Patientinnen ethisch maßgeblich sein. Besonders zu betonen bleibt bei der (palliativen, aber auch adjuvanten) Misteltherapie bei Brustkrebs aber die Gefahr, aufgrund von Vorurteilen basierend auf ihrer Zugehörigkeit zur Komplementär- oder Integrativmedizin sowohl eine unfaire Einschätzung der Nutzen- und Schadenspotenziale und/oder eine nicht ausreichend neutrale Aufklärung über die Therapie durchzuführen. Dabei sind sowohl mögliche negative als auch positive Vorurteile (unter anderem aufgrund weltanschaulicher Überzeugungen) gleichermaßen zu beachten.
Schlussfolgerungen
Aufgrund dieser insgesamt unsicheren Datenlage kann nicht empfohlen werden, die Finanzierung der Misteltherapie durch die GKV auf die adjuvante Therapie auszudehnen. Über den Einzelfall hinaus müssen auch Entscheidungen auf der politischen Ebene dahingehend getroffen werden, ob die Kostenerstattung der palliativen Misteltherapie bei Brustkrebs angesichts der Unsicherheiten bei der Wirksamkeit weiterhin erfolgen soll.
Obwohl die Misteltherapie rezeptfrei zugelassen und verfügbar ist, sollten weitere randomisierte Studien durchgeführt werden, um die Unsicherheit hinsichtlich der Wirksamkeit zur Verbesserung der gesundheitsbezogenen Lebensqualität, des Gesamtüberlebens und des progressionsfreien Überlebens zu reduzieren.
Die Unsicherheit der bestehenden Datenlage macht es umso wichtiger, die Patientinnen neutral und kompetent zu beraten, unabhängig davon, welche Einstellung die Behandelnden oder Beratenden selbst zur Misteltherapie haben. Ein wichtiger Bestandteil der Patientinnenberatung sollte die verständliche und transparente Übermittlung der Tatsache sein, dass es derzeit keinen wissenschaftlichen Nachweis gibt, ob die Misteltherapie die Überlebenszeit oder das progressionsfreie Überleben bei Patientinnen mit Brustkrebs relevant erhöht, und dass eine Verbesserung der gesundheitsbezogenen Lebensqualität als eher moderat einzuschätzen ist und ebenfalls nicht als gesichert gelten kann. Außerdem sollte explizit darauf hingewiesen werden, dass aufgrund der Immunstimulation eventuell Wechselwirkungen zwischen Krebsmedikamenten und Misteltherapie auftreten könnten, hierzu aber ebenfalls unzureichende Daten vorliegen. Für Patientinnen, die medizinische Informationen aus dem Internet nutzen möchten, sollten Hinweise auf vertrauenswürdige Internetseiten, die Informationen zur begleitenden Misteltherapie enthalten, gegeben werden.
Abstract
Background
In women, breast cancer is the leading cause of new cancer cases as well as cancer-specific mortality, with 18,736 attributable deaths in 2016. In addition to surgery and depending on tumour status, chemotherapy can be used to treat breast cancer. Chemotherapy is usually associated with side effects such as diarrhoea, fatigue, hair loss, fever, and blood formation disorders. This significantly impairs the patients’ quality of life during treatment.
Mistletoe preparations are used for the concomitant treatment of cancer in Germany. A major goal of treatment is to improve the health-related quality of life during therapy, which is limited due to the toxicity of chemotherapy. The accompanying mistletoe therapy is classified as complementary or integrative medicine. The biochemical mechanisms of action of mistletoe preparations are attributed to mistletoe lectins and viscotoxins, which have a non-specific immunostimulant and cytostatic effect. Anthroposophical mistletoe extracts without standardised lectin content and mistletoe preparations registered as herbal remedies with standardised lectin content are sold on the German market. All mistletoe preparations are available without prescription. The costs of mistletoe therapy as part of palliative treatment for patients with metastatic breast cancer are covered by the statutory health insurance. Mistletoe therapy as part of adjuvant treatment for non-metastatic breast cancer is not covered due to the uncertain evidence currently available. An earlier health technology assessment report which examined mistletoe therapy as an “adjuvant treatment to reduce the toxicity of chemotherapy of malignant diseases” concluded that only in the case of breast cancer were there indications that an adjuvant mistletoe therapy could improve quality of life. The present health technology assessment report analyses whether there is new evidence on clinical efficacy and safety that can address these questions. In addition, costs and cost-effectiveness, patients and social aspects, as well as ethical issues associated with adjuvant mistletoe therapy for breast cancer are systematically examined.
Research question
-
1. Does the additional administration of mistletoe preparations reduce patient-relevant side effects of conventional chemotherapy, and does it improve health-related quality of life in patients with breast cancer compared to chemotherapy without concomitant therapy with mistletoe preparations? What is the effect of additional mistletoe preparations on progression-free survival or overall survival in patients with breast cancer?
-
2. What are the differences in the costs of concomitant mistletoe therapy, and how is the cost-effectiveness of concomitant mistletoe therapy compared to treatment without mistletoe preparations?
-
3. What are the attitudes, experiences, perceptions, and knowledge of patients and professionals regarding concomitant mistletoe therapy? Are there barriers to accessing mistletoe therapy for interested patients? What is the doctor-patient communication about concomitant mistletoe therapy, and are there particular points that should be addressed to ensure adequate use?
-
4. What ethical aspects on an individual, social, and professional level are relevant for mistletoe therapy as a complementary therapy for patients with breast cancer compared to conventional therapy alone? What is the outcome of an evaluation and weighing of the identified ethical aspects and challenges, i. e., under what conditions is the use of concomitant mistletoe therapy in adjuvant and palliative treatment of breast cancer ethically justifiable?
Methods
Systematic reviews were conducted on clinical efficacy and safety, costs and cost-effectiveness, patients’ and social aspects, and ethical evaluation. Methods of qualitative content analysis were applied for patients and social aspects as well as the ethical evaluation.
Results
A total of seven studies were included for the evaluation of clinical efficacy and safety, one study for the evaluation of costs and cost-effectiveness, 13 studies for the evaluation of patients’ and social aspects, and 17 articles for the ethical evaluation.
No randomised controlled trials on the clinical efficacy of concomitant mistletoe therapy regarding overall survival in patients with breast cancer could be identified. One study with a small sample size showed no difference in disease-free survival after five years between patients with and without concomitant mistletoe therapy.
There is evidence from three randomised trials that the side effects of chemotherapy are reduced and the health-related quality of life is increased by concomitant mistletoe therapy. The effects are rather small to moderate. It is uncertain whether these effects could be due to systematic bias of the only subjectively measurable outcome measures due to insufficient blinding in the trials.
Known side effects of mistletoe therapy such as mild and moderate local reactions, which were reported in these three randomised trials and four other non-randomised studies, are common but of low severity. Possible interactions between anticancer drugs and mistletoe extracts, which could be due to immune stimulation, were not investigated in the included studies.
There are no sufficiently valid studies on costs and cost-effectiveness of concomitant mistletoe therapy. Ten studies in which patients with breast cancer were interviewed show that a median of 24.9 % (range: 7.3 to 46.3 %) of patients with breast cancer use mistletoe therapy. Three studies in which specialists (mostly physicians) were interviewed report that a median of 29.3 % (range: 29.3 to 79.2 %) use concomitant mistletoe therapy.
Only a few studies with small sample sizes are available on knowledge, attitudes, acceptance, satisfaction, experiences, expectations, access, type and extent of doctor-patient communication, and information on mistletoe therapy from the patient’s perspective. Motives for using complementary and integrative medicine procedures and concomitant mistletoe therapy are the desire to leave nothing untried, to take an active role in treatment, to complement conventional therapy, and to have a gentle treatment free of side effects. Specifically, the use of mistletoe therapy is associated with the expectation of having fewer side effects from conventional cancer therapy and stimulating the immune system. Reasons for the application of concomitant mistletoe therapy among healthcare professionals were the patients’ desire and motivation, the expansion of their own range of services, and their own conviction or belief in the ineffectiveness of conventional therapy. The reasons provided for not using mistletoe therapy were that time is lost, unconventional methods are too expensive, and the use of conventional methods is prevented. In addition, there is a lack of specific expertise and specialist staff for administering mistletoe therapy.
The studies also point out that patients often do not feel sufficiently advised by professionals and that the patients – e. g., in the case of a negative attitude towards mistletoe therapy on the part of the practitioners – do not inform the practitioners about mistletoe therapy taking place.
Within the framework of the ethical evaluation, 26 ethical aspects were identified and assigned to the ethical principles of benefit, harm, autonomy, justice, efficiency, and legitimacy.
A pivotal point in the ethical evaluation of palliative and adjuvant mistletoe therapy for breast cancer is the problematic evidence situation regarding efficacy and safety. Some ethical aspects or criteria/conflicts relate directly to this, such as those concerning the assessment and weighing of potential benefits and harms. Other ethical aspects or criteria/conflicts are also dependent on the evidence situation indirectly, such as the conditions for successful informed consent to a therapy (e. g., information about potential benefits and harms, information about the evidence situation or the state of science) or the communication between doctors and complementary/or integrative medicine practitioners due to possible discrepancies in the judgement of efficacy.
In these treatment decisions – at least as long as the potential for harm is considered minimal and the financing is unproblematic – the autonomy of the patients will be ethically decisive in the concrete individual case. In the case of palliative as well as adjuvant mistletoe therapy for breast cancer, however, special emphasis must be placed on the danger of conducting an unfair assessment of the potential benefits and harms and/or providing insufficiently neutral information about the therapy due to prejudices based on its affiliation with complementary or integrative medicine. In this context, both possible negative and positive prejudices (e. g., due to ideological convictions) must be considered in equal measure.
Conclusions
Given this overall uncertain evidence, the extension of the funding of mistletoe therapy to adjuvant therapy by statutory health insurance cannot be recommended. Beyond individual cases, decisions must also be made at the political level as to whether reimbursement of palliative mistletoe therapy for breast cancer should continue in view of the uncertainties surrounding its efficacy.
Although mistletoe therapy is approved and available without prescription, further randomised trials should be conducted to reduce the uncertainty regarding its efficacy in improving quality of life, overall survival, and progression-free survival.
The uncertainty of the existing data leads to a greater importance of providing patients with neutral and competent counselling, regardless ofthe physicians’ or counsellors’ attitude towards mistletoe therapy. An important component of patient counselling should be the comprehensible and transparent communication of the fact that there is currently no scientific proof of whether mistletoe therapy relevantly increases survival time or progression-free survival in patients with breast cancer, and an improvement in health-related quality of life is to be assessed as rather moderate and cannot be regarded as assured. In addition, it should be explicitly pointed out to patients that interactions between cancer drugs and mistletoe therapy could possibly occur due to the immune stimulation, but no sufficient data are available on this aspect. For patients who would like to use medical information from the Internet, references should be made to trustworthy websites that contain information on concomitant mistletoe therapy.
Kurzfassung
Hintergrund
Krebserkrankungen sind nach Herz-Kreislauferkrankungen die zweithäufigste Todesursache in Deutschland. Bei Frauen steht Brustkrebs sowohl bei den Krebssterbefällen mit 18.736 Todesfällen (Jahr 2016) als auch bei den Krebsneuerkrankungen an erster Stelle. 2016 lag der Anteil von Brustkrebs an allen Krebsneuerkrankungen bei Frauen bei 30,8 %. Die altersstandardisierte Erkrankungshäufigkeit betrug 2016 112,2 Frauen pro 100.000, die altersstandardisierte Sterbehäufigkeit 23,4 Frauen mit Brustkrebs je 100.000 Personen. Das mittlere (mediane) Erkrankungsalter liegt bei 64 Jahren, die relative Überlebensrate nach zehn Jahren bei 82 %, das heißt, die Heilungs- und Überlebenschancen sind relativ gut. Bei der Behandlung von Brustkrebs kommt in Abhängigkeit vom Tumorstatus neben der Operation unter anderem auch die Chemotherapie zum Einsatz. Sie ist in der Regel mit Nebenwirkungen wie z. B. Durchfall, Müdigkeit, Haarausfall, Fieber oder Störungen der Blutbildung verbunden. Dies beeinträchtigt die Lebensqualität der Patientinnen während der Behandlung maßgeblich.
Mistelpräparate werden zur begleitenden Behandlung von Krebserkrankungen in Deutschland eingesetzt. Ein wesentliches Behandlungsziel ist es, die gesundheitsbezogene Lebensqualität (HRQOL) zu verbessern, die aufgrund der Toxizität der Chemotherapie eingeschränkt ist. Die Misteltherapie wird der Komplementärmedizin, mittlerweile auch als integrative Medizin bezeichnet, zugeordnet. Die biochemischen Wirkmechanismen der Mistelpräparate werden auf Mistellektine und Viscotoxine zurückgeführt, die eine unspezifisch immunstimulierende und eine zytostatische Wirkung aufweisen. Auf dem deutschen Markt werden anthroposophische Mistelextrakte ohne standardisierten Lektingehalt und als pflanzliche Heilmittel registrierte Mistelpräparate mit standardisiertem Lektingehalt vertrieben. Alle Mistelpräparate sind rezeptfrei. Die Kosten der Misteltherapie im Rahmen einer Palliativbehandlung bei Patientinnen mit metastasiertem Brustkrebs werden von der Gesetzlichen Krankenversicherung (GKV) übernommen. Eine adjuvante Behandlung bei nicht-metastasiertem Brustkrebs wird aufgrund der bisherigen unsicheren Evidenzlage nicht übernommen. Der Health Technology Assessment (HTA)-Bericht von Lange-Lindberg et al. (2006) „Misteltherapie als begleitende Behandlung zur Reduktion der Toxizität der Chemotherapie maligner Erkrankungen” kam zu dem Schluss, dass sich nur bei Brustkrebs Hinweise dafür ergäben, dass eine begleitende Misteltherapie die HRQOL verbessern könnte. In der aktuellen deutschen medizinischen Leitlinie zur Früherkennung, Diagnostik und Therapie des Brustkrebses wird die Aussage getroffen, dass eine Misteltherapie das Überleben von Patientinnen mit Mammakarzinom nicht verbessert und eine Verbesserung der Lebensqualität aufgrund unzureichender Datenlage fraglich sei. So stellt sich die Frage, ob es inzwischen neue Evidenz zur medizinischen Wirksamkeit und Sicherheit gibt, die diese Fragen klären kann. Zudem sollen im vorliegenden Bericht auch Kosten und Kosteneffektivität, Patientenaspekte und soziale Implikationen sowie ethische Fragen, die mit einer begleitenden Misteltherapie verbunden sind, systematisch untersucht werden.
Fragestellungen
-
1. Zur Bewertung der medizinischen Wirksamkeit und Sicherheit wurden folgende Forschungsfragen untersucht: Verringert die zusätzliche Gabe von Mistelpräparaten patientenrelevante Nebenwirkungen der konventionellen Chemotherapie und verbessert sie die HRQOL bei Patientinnen mit Brustkrebs im Vergleich zur Chemotherapie ohne eine Begleittherapie mit Mistelpräparaten? Hat die zusätzliche Gabe von Mistelpräparaten bei der konventionellen Chemotherapie einen Effekt auf das progressionsfreie Überleben oder auf die Gesamtüberlebenszeit bei Patientinnen mit Brustkrebs?
-
2. Zur Bewertung ökonomischer Aspekte wurden folgende Forschungsfragen untersucht: Wie hoch sind die Unterschiede in den Kosten einer begleitenden Misteltherapie und wie ist die Kosteneffektivität der begleitenden Misteltherapie im Vergleich zur Behandlung ohne Mistelpräparate?
-
3. Die Bewertung von Patienten- und sozialen Aspekten untersuchte folgende Forschungsfragen: Welche Einstellungen, Erfahrungen, Wahrnehmungen und welches Wissen haben Patienten und Fachleute zur begleitenden Misteltherapie? Gibt es Hindernisse für den Zugang zur Misteltherapie für interessierte Patientinnen? Wie sieht die Kommunikation zur begleitenden Misteltherapie aus und gibt es Punkte, die für eine adäquate Inanspruchnahme besonders kommuniziert werden sollten?
-
4. Die ethische Bewertung folgte diesen Forschungsfragen: Welche ethischen Aspekte auf individueller, gesellschaftlicher und berufsethischer Ebene sind bei der Misteltherapie als Begleittherapie bei Patientinnen mit nicht-metastasiertem und metastasiertem Brustkrebs im Vergleich zur konventionellen Therapie allein relevant? Zu welchem Ergebnis kommen eine Bewertung und Abwägung der identifizierten ethischen Aspekte und Herausforderungen hinsichtlich des Einsatzes der Misteltherapie als Begleittherapie bei Patientinnen mit Brustkrebs, das heißt, insbesondere unter welchen Bedingungen ist der Einsatz der begleitenden Misteltherapie bei adjuvanter und palliativer Behandlung von Brustkrebs ethisch vertretbar?
Bewertung der medizinischen Wirksamkeit und Sicherheit
Methodik
Wichtigste Ein- und Ausschlusskriterien für Primärstudien, systematische Übersichtsarbeiten, HTA-Berichte und evidenzbasierte Leitlinien
Es wurden publizierte randomisierte kontrollierte Studien (RCT) zur Wirksamkeit und Sicherheit der begleitenden adjuvanten oder palliativen Misteltherapie bei Patientinnen mit Brustkrebs eingeschlossen, die Ergebnisse zu mindestens einer der folgenden Zielgrößen untersuchen: Unerwünschte Nebenwirkungen der Standardtherapie, HRQOL, Gesamtüberleben, progressionsfreies Überleben, unerwünschte Nebenwirkungen der Misteltherapie. Für die Bewertung der letzten Zielgröße wurden zusätzlich Beobachtungsstudien eingeschlossen. Zudem wurden systematische Übersichtsarbeiten und HTA-Berichte mit Literaturrecherche ab 2004, die oben genannten Einschlusskriterien entsprechen sowie evidenzbasierte klinische Praxisleitlinien zur Behandlung von Brustkrebs ab 2008 mit Aussagen zur Komplementärmedizin eigeschlossen.
Literaturrecherche, ‑selektion, Bewertung der Studienqualität, Datenextraktion und Evidenzsynthese
Es wurde eine systematische Literaturrecherche in den Datenbanken MEDLINE, EMBASE, Cochrane Library und in der HTA Database des Centre of Reviews and Dissemination durchgeführt. Der Recherchezeitraum reicht vom 1. Januar 2004 bis März/April 2017. Zwischen April 2017 und Oktober 2020 wurden weitere Publikationen durch eine fortlaufende Aktualisierungsfunktion in PubMed identifiziert. Es wurden Suchbegriffe für die Erkrankung (Brustkrebs) und für die Therapie (Mistelpräparate) in Form von Freitext und datenbankspezifischen Thesaurusbegriffen kombiniert. Eine Internetrecherche erfolgte mittels der Grey Matters-Checkliste der Canadian Agency for Drugs and Technologies in Health. Nach Leitlinien wurde zusätzlich in drei Leitliniendatenbanken gesucht. Alle Referenzen wurden durch zwei Autorinnen unabhängig voneinander anhand der vorab definierten Ein-und Ausschlusskriterien selektiert. Differenzen wurden durch Diskussion gelöst. Zusätzlich erfolgte eine Handsuche in den Literaturverzeichnissen der identifizierten eingeschlossenen systematischen Übersichtsarbeiten, HTA-Berichten, eingeschlossenen Primärstudien und Leitlinien.
Zur Bewertung des Verzerrungspotenzials der RCT wurde das Risk of Bias-Tool von Cochrane, zur Bewertung der methodischen Qualität der Leitlinien das Appraisal of Guidelines for Research & Evaluation-Instrument verwendet.
Identifizierte HTA-Berichte und systematischen Reviews wurden zur Suche weiterer Primärstudien herangezogen. Aus den eingeschlossenen Studien und Leitlinien wurden die relevanten Charakteristika und Ergebnisse von einer Person extrahiert und von einer zweiten auf Richtigkeit überprüft. Die Ergebnisse für die Primärstudien zur Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Brustkrebs wurden in Evidenztabellen sowie Abbildungen präsentiert und in zusammenfassenden Texten beschrieben. Aufgrund der Heterogenität der Studien wurden keine Metaanalysen durchgeführt. Die Empfehlungen der klinischen Leitlinien zur begleitenden Misteltherapie werden in Textform beschrieben.
Ergebnisse
In der Literaturrecherche wurden nach Entfernen der Duplikate 242 Referenzen identifiziert. Nach Sichtung von Titel und Zusammenfassung (Abstract) wurden 80 Artikel im Volltext bestellt und insgesamt sieben Studien in die Informationssynthese zur Bewertung der medizinischen Wirksamkeit und Sicherheit eingeschlossen. Für die Darstellung der Empfehlungen aus Leitlinien wurden nach Durchsicht von 199 Referenzen beziehungsweise 163 Volltexten zwei Leitlinien eingeschlossen.
Wirksamkeit
Es wurde keine Studie zum Effekt einer begleitenden Misteltherapie auf das Gesamtüberleben identifiziert. Ein dreiarmiges RCT mit kleiner Fallzahl, das zwei verschiedene Mistelpräparate mit einer Placebokontrolle verglich, zeigte keinen Effekt der begleitenden Misteltherapie auf das progressionsfreie Überleben nach fünf Jahren: 72,4 und 67,9 % bei begleitender Therapie mit den Mistelpräparaten, 78,6 % in der Kontrollgruppe (p‑Wert im Vergleich zur Kontrollgruppe 0,551 beziehungsweise 0,746). Drei RCT (719 Patientinnen) untersuchten die Veränderung der HRQOL und von unerwünschten Symptomen der Standardtherapie nach 15 beziehungsweise 18 Wochen. Hierzu wurden vier verschiedene validierte Lebensqualitäts-messinstrumente (FACT‑G [FACT‑G = Functional Assessment of Cancer Therapy – General], GLQ‑8 [GLQ = Global Life Quality], Spitzer-Analogskala, EORTC-QLQ-C30 [EORTC = European Organisation for Research and Treatment of Cancer]) verwendet. In einer Studie (n = 352) wurde der FACT‑G Fragebogen eingesetzt. Der Gruppenunterschied des Gesamt-Scores (Spannweite: 0 bis 80 Punkte, Kontrollgruppenwert in Placebogruppe zu Studienbeginn 50 Punkte), betrug nach 15 Wochen 4 Punkte (p‑Wert: < 0,0001) zugunsten der Mistelgruppe. Ein Wert für einen minimalen klinisch relevanten Unterschied wird nicht angegeben. Zwei Studien (n = 598) verwenden die GLQ-8-Symptomskala, eine visuelle Analogskala, die in mm gemessen wird. In der einen Studie (n = 272) betrug die Veränderung der GLQ‑8 Symptomskala (Spannweite: 0–800 mm) nach 15 Wochen 30 mm (p‑Wert: 0,0121) zugunsten der Mistelgruppe. Die Werte zu Studienbeginn lagen in vier Studienarmen zwischen 128,9 und 171,5 mm. In der zweiten Studie (n = 352) betrug der Unterschied zugunsten der Mistelgruppe 40 mm (p‑Wert: < 0,01). Zu Studienbeginn belief er sich auf 150 mm. Die Angabe eines minimal klinisch relevanten Unterschieds fehlte. Der Unterschied wurde aber von den Studienautoren als klinisch relevant betrachtet. Der Spitzer-Analogskala-Fragebogen zur Lebensqualität (theoretisch mögliche Spannweite 0–100) wies in denselben beiden Studien. nach 15 Wochen eine Veränderung zugunsten der Mistelgruppe auf. Der Unterschied betrug 5,8 beziehungsweise circa 5,0 mm. Die Werte zu Studienbeginn variierten in den Studienarmen zwischen 29 und 46,4 mm. Auch hier gibt es keine Aussage zu einem klinisch relevanten Mindestunterschied. Eine Studie (n = 95) untersucht parallel zwei Mistelpräparate gegenüber einer Kontrollgruppe und verwendet den EORTC-QLQ-C30-Fragebogen. Er besteht aus fünf Funktions‑, einer Subskala zur gesamten Gesundheit und neun Symptomskalen, die einzeln berichtet werden (Spannweite je 0 bis 100 Punkte). Ein Unterschied von mindestens fünf Punkten wird als klinisch relevant betrachtet. Nach 18 Wochen wiesen beide Gruppen mit Mistelpräparaten in drei Funktionsskalen (Rolle, sozial, emotional) und fünf Symptomskalen (Übelkeit und Erbrechen, Schlaflosigkeit, Appetitlosigkeit, Durchfall und finanzielle Sorgen) statistisch signifikante Werte (p‑Wert < 0,05) über fünf Punkten Unterschied zur Kontrollgruppe auf. Die Unterschiede gegenüber der Kontrollgruppe lagen zwischen 6,01 und 14,09 Punkten.
Verzerrungspotenzial in den eingeschlossenen Studien
Alle Studien sind adäquat randomisiert und weisen geringen Datenverlust bei der Analyse auf. Bei zwei Studien ist unklar, ob die Gruppenzuteilung verdeckt erfolgte. Eine Studie war unverblindet, zwei Studien waren mit einem Placebo doppelt-verblindet. Aufgrund der häufig auftretenden Lokalreaktionen ist jedoch eine Entblindung wahrscheinlich. Für den patienten-berichteten Endpunkt HRQOL besteht deshalb ein hohes Risiko für eine Verzerrung durch „Performance and Detectiorr Bias. Das Risiko für Verzerrungen aufgrund unvollständiger Datenauswertung war gering oder unklar, das Verzerrungsrisiko aufgrund anderer Ursachen war gering.
Sicherheit
Zur Frage unerwünschter Nebenwirkungen durch die begleitende Misteltherapie wurden insgesamt sieben Studien mit 1.951 Patientinnen eingeschlossen, drei davon sind die bereits für die Fragestellung zur Wirksamkeit identifizierten RCT. Aus diesen sieben Studien wurden nur die Daten aus dem Studienarm mit begleitender Misteltherapie entnommen. Bekannte Nebenwirkungen der Mistelinjektionen sind lokale Hautreaktionen und systemische Reaktionen wie Fieber und grippeähnliche Symptome. In sechs Studien mit acht Interventionsgruppen weisen im Mittel (Median) 25,2 % (Spannweite: 4,6 bis 94 %) der Patientinnen Lokalreaktionen geringen oder mittleren Grades auf.
In sieben Studien wurden Zahlen zu leichten und mittleren systemischen Reaktionen in den Studienpopulationen berichtet, die im Median bei 1,95 % (Spannweite: 0 bis 8,2 %) liegen.
Diskussion
Zusammenfassend ist festzustellen, dass es zum Effekt einer begleitenden Misteltherapie auf das Gesamtüberleben keine Evidenz gibt und nur geringe Evidenz, dass die begleitende Misteltherapie keinen Effekt auf das progressionsfreie Überleben nach fünf Jahren hat. Die Verbesserungen in der HRQOL gegenüber der Kontrollgruppe sind gering bis moderat. Da aufgrund der fehlenden oder nicht aufrechtzuerhaltenden Verblindung ein hohes Verzerrungsrisiko in allen Studien bestand, ist es möglich, dass der Unterschied nicht durch die begleitende Misteltherapie verursacht ist. Ob die Studienergebnisse auf die gegenwärtigen Verhältnisse im deutschsprachigen Raum vollständig übertragbar sind, erscheint unklar. Die eingeschlossenen Studien wurden vor 2004 beziehungsweise zwischen 2005 und 2007 durchgeführt. Alle Studien fanden im ost- beziehungsweise südosteuropäischen Raum statt. Sowohl die mittlerweile fortentwickelte Brustkrebstherapie als auch Unterschiede in der Gesundheitsversorgung sowie kulturelle Unterschiede des deutschsprachigen Raums im Vergleich zu diesen Ländern könnten einen Einfluss auf die Übertragbarkeit der Studienergebnisse haben.
Insgesamt besteht große Unsicherheit, ob die vorgestellten kleinen bis moderaten Verbesserungen der HRQOL beziehungsweise die Verminderung der durch die Chemotherapie und Krankheit verursachten Symptome tatsächlich ursächlich der Misteltherapie zugeschrieben werden können, und ob die Ergebnisse der Studien auf die gegenwärtigen Verhältnisse im deutschsprachigen Raum übertragbar sind. Neue Studien könnten also wahrscheinlich zu einer Veränderung der Gesamteinschätzung der Evidenz führen.
Bei neuen randomisierten Studien zu HRQOL sollte versucht werden das zentrale methodische Problem, eine doppelte Verblindung aufrechtzuerhalten, zu lösen.
Die vorliegende Übersichtsarbeit zur medizinischen Wirksamkeit und Sicherheit unterliegt verschiedenen Limitationen. Die umfassende systematische Literaturrecherche liegt mit 2017 schon längere Zeit zurück. Automatisch aktualisierte Benachrichtigungen aus einer der bibliografischen Datenbanken und die Durchsicht aktueller Übersichtsarbeiten erlaubten jedoch zu bestätigen, dass auch gegenwärtig (Dezember 2020) keine neueren Studien verfügbar sind. Von zwei in früheren Übersichtsarbeiten identifizierten RCT waren keine Volltexte verfügbar, sodass wir die Ergebnisse nicht berichtet haben. Diese Studien hatten kleine Fallzahlen zwischen 17 und 46 Patientinnen, schlechte Berichtsqualität und ein hohes Verzerrungsrisiko. Dementsprechend würde sich durch Ein- oder Ausschluss dieser Studien das Ergebnis der Bewertung nicht ändern. Aufgrund der Heterogenität der Studien erschien es uns nicht sinnvoll, eine Metaanalyse für Zielgrößen zur Wirksamkeit oder Sicherheit durchzuführen. Allerdings war die statistische Unsicherheit, die durch eine Metaanalyse verringert werden kann, nicht die wesentliche Limitation, sondern das hohe Potenzial für systematische Verzerrung der Effektgrößen.
Bewertung von Kosten und Kosteneffektivität
Methodik
Wichtigste Ein- und Ausschlusskriterien für Studien
Für die Bewertung von Kosten und Kosteneffektivität der begleitenden Misteltherapie gelten die Ein-und Ausschlusskriterien der Bewertung der Wirksamkeit und Sicherheit für Studienpopulation, Intervention und Vergleichsintervention. Zielgrößen sind die zusätzlichen Kosten der begleitenden Misteltherapie, sowie zusätzliche Kosten pro gewonnenem oder qualitätsadjustiertem Lebensjahr. Es werden alle gesundheitsökonomischen Studientypen eingeschlossen. Die Evaluationen müssen sich auf den deutschsprachigen Raum beziehen.
Literaturrecherche, ‑selektion, Bewertung der Studienqualität, Datenextraktion und Evidenzsynthese
Literaturrecherche und ‑Selektion wurden analog zur Bewertung der medizinischen Wirksamkeit und Sicherheit durchgeführt. Zur Datenextraktion werden standardisierte Extraktionsformulare verwendet, zur Qualitätsbewertung der Kriterienkatalog zur methodischen Qualität gesundheitsökonomischer Studien der German Scientific Working Group Technology Assessment in Health Care. Studiencharakteristika und Ergebnisse werden in Evidenztabellen zusammengefasst.
Ergebnisse
In der Literaturrecherche wurden nach Entfernen der Duplikate 243 Referenzen identifiziert. Nach Sichtung von Titel und Zusammenfassung (Abstract) wurden fünf Artikel im Volltext bestellt und eine Studie in die Informationssynthese eingeschlossen.
Es wurde eine vergleichende Kostenanalyse zur begleitenden Misteltherapie identifiziert, die auf Daten von vor 15 bis 20 Jahren gestützt ist. Die zugrundeliegende multizentrische, retrospektive Kohortenstudie untersuchte die Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Patientinnen mit Brustkrebs während der routinemäßigen Nachsorge in 53 zufällig ausgewählten Krankenhäusern und Arztpraxen in Deutschland. Direkte medizinische Kosten im stationären und ambulanten Bereich sowie indirekte Kosten für einen Produktivitätsausfall von bis zu maximal 90 Tagen wurden nach der Operation und dem Abschluss der adjuvanten Chemo- oder Radiotherapie erhoben. Insgesamt wurden die Daten von 741 Patientinnen analysiert: 167 mit begleitender Misteltherapie, 514 mit Standardtherapie ohne begleitende Misteltherapie, 60 Patientinnen, die zwischen Standardtherapie allein und begleitender Misteltherapie gewechselt hatten.
Die durchschnittlichen Gesamtkosten innerhalb von fünf Jahren für eine Patientin mit begleitender Misteltherapie lagen bei 4.504 Euro, verglichen mit 9.996 Euro für eine Patientin mit Standardtherapie. Der Unterschied war hauptsächlich auf die stationären Kosten und die Kosten für den Produktivitätsverlust zurückzuführen. Angaben zur statistischen Unsicherheit wurden nicht berichtet. Die Studie weist viele Limitationen bei der Datenqualität auf, Hauptschwäche ist jedoch das Studiendesign der zugrundeliegenden Beobachtungsstudie, in der keine Kontrolle für systematische Verzerrungen erfolgte.
Diskussion
Studien zur Kosteneffektivität der begleitenden Misteltherapie wurden nicht gefunden.
Der große Kostenunterschied zugunsten der begleitenden Misteltherapie in der vergleichenden Kostenanalyse kann aufgrund des hohen Verzerrungspotenzials nicht auf einen kausalen Effekt der Misteltherapie zurückgeführt werden, da die Daten auf einer Beobachtungsstudie ohne jegliche Kontrolle für systematische Effektverzerrung durch Störgrößen (Confounder) basieren. Daten zum Bildungsstand sowie auch anderer prognostischer Faktoren, die bekannte Störgrößen sind, wurden in der Studie aber nicht erhoben. Es bleibt also unklar, ob eine begleitende Misteltherapie die Krankheitskosten in der Nachsorge von Brustkrebs verringern kann.
Solange die Frage der medizinischen Wirksamkeit einer begleitenden Misteltherapie unsicher ist, lässt sich auch die Frage der Kosteneffektivität nicht beantworten.
Bewertung von Patienten- und sozialen Aspekten
Methodik
Wichtigste Ein- und Ausschlusskriterien für Studien
Es wurden alle veröffentlichten Studien zur Misteltherapie bei Patientinnen mit Brustkrebs eingeschlossen, die sich auf den deutschsprachigen Raum beziehen und Ergebnisse zu relevanten Zielgrößen zu Patienten- und sozialen Aspekten berichtet haben. Relevante Zielgrößen sind: Inanspruchnahme der Misteltherapie, Wissen, Einstellung, Akzeptanz, Zufriedenheit, Erfahrungen, Erwartungen der Anwenderinnen der Misteltherapie, sowie der Zugang zur Misteltherapie; Art und Umfang der Kommunikation und Information zur Misteltherapie sowie deren Bewertung durch Patientinnen. Die Zielgrößen konnten aus Perspektive der Patientinnen, aus Sicht von deren Betreuenden oder Familienangehörigen, oder des behandelnden Fachpersonals berichtet werden. Quantitative und qualitative Studientypen ohne weitere Einschränkung konnten eingeschlossen werden.
Literaturrecherche, ‑selektion, Bewertung der Studienqualität, Datenextraktion und Evidenzsynthese
Für die Literaturrecherche wurde neben der oben bereits beschriebenen domänenübergreifenden Suche und der umfassenden Suche nach grauer Literatur zusätzlich eine systematische Datenbanksuche in zwölf Datenbanken aus den Bereichen Medizin, Ökonomie, Soziologie und Psychologie durchgeführt. Die Referenzen wurden durch zwei Autorinnen unabhängig voneinander auf Erfüllung der Einschlusskriterien überprüft und selektiert. Unstimmigkeiten in der Bewertung wurden durch Diskussion gelöst. Zusätzlich erfolgte eine Handsuche in den Literaturverzeichnissen der eingeschlossenen Primärstudien. Zur Bewertung des Verzerrungspotenzials wurden die Checklisten des Critical Appraisal Skills Program in originaler oder angepasster Form verwendet. Aus den eingeschlossenen Studien wurden die relevanten Charakteristika und Ergebnisse von einer Person extrahiert und von einer zweiten auf Richtigkeit überprüft. Die Ergebnisse für quantitative Primärstudien wurden zusammengefasst und in Evidenztabellen präsentiert. Die qualitativen Studien wurden über eine qualitative Inhaltsanalyse untersucht.
Ergebnisse
In der Literaturrecherche wurden nach Entfernen der Duplikate 318 Referenzen identifiziert. Nach der Durchsicht der Titel und Zusammenfassungen (Abstract) wurden 96 Artikel im Volltext überprüft. Insgesamt wurden zwölf Querschnittstudien – neun zur Patientinnen- und drei zur Behandelndenperspektive – sowie drei qualitative Studien in die Informationssynthese zur Bewertung der Patienten- und sozialen Aspekte eingeschlossen.
In zehn Studien mit 3.421 Patientinnen mit Brustkrebs werden Ergebnisse zur Häufigkeit der Inanspruchnahme von komplementärer und integrativer Medizin (KIM) und der Misteltherapie berichtet: Im Median wenden 24,9 % (Spannweite: 7,3 bis 46,3 %) der Patientinnen mit Brustkrebs eine Misteltherapie an. Sieben der zehn Studien mit 2.482 Patientinnen berichten soziodemografische, krankheits- oder therapiebezogene Merkmale, die bei Patientinnen mit Brustkrebs häufiger bei Anwendung komplementärer Verfahren vorkommen als bei Nicht-Anwendung. KAM-Nutzende (KAM = Komplementäre und alternative Medizin) sind jünger, haben ein höheres Bildungsniveau und einen schwereren Krankheitsverlauf.
Drei Studien mit 654 Fachpersonen (meistens Ärzten und Ärztinnen) berichten Ergebnisse zur Häufigkeit des Einsatzes von KIM und der begleitenden Misteltherapie und zu Merkmalen des Fachpersonals, das sie anwendet: Im Median setzen 29,3 % (Spannweite: 29,3 bis 79,2 %) die begleitende Misteltherapie ein. Anwendende des behandelnden Fachpersonals sind typischerweise eher älter und arbeiten im niedergelassenen Bereich oder haben einen höheren hierarchischen Status im Krankenhaus.
Acht Studien beschreiben die Einstellung der Befragten zur begleitenden Misteltherapie und welchen Gewinn sie sich von der Anwendung erwarten: zwei Querschnittstudien mit 197 Patientinnen mit Brustkrebs, drei Querschnittstudien mit 654 behandelnden Personen und drei qualitative Studien mit 43 Patientinnen mit Brustkrebs. In einer Studie war für 90 % der KIM-Anwenderinnen das Vertrauen zur beratenden Person und die wahrgenommene Kompetenz bezüglich KIM wichtig, weil sie dadurch das Gefühl hatten, dass das KIM-Verfahren gut für sie sei. In einer anderen Studie wollen Patientinnen nichts unversucht lassen (47 %), sie wünschen sich eine aktivere Rolle in der Behandlung (47 %) oder wollen die Standardtherapie entweder ergänzen (31 %) oder sanfter ohne Nebenwirkungen gestalten (18 %). Bei 3,6 % ist die konventionelle Therapie wirkungslos und die Misteltherapie stellt die letzte Option dar. Konkret ist die Anwendung der Misteltherapie mit der Erwartung verbunden, weniger Nebenwirkungen bei der konventionellen Krebstherapie zu haben und das Immunsystem zu stimulieren. Gründe für die Anwendung der Misteltherapie beim Fachpersonal waren der Wunsch der Patientinnen (82 %), Motivation der Patientinnen (62 %), die Erweiterung des eigenen Angebotsspektrums (59 %), die eigene Überzeugung (55 beziehungsweise 66 %) oder der Glaube an die Unwirksamkeit der konventionellen Therapie (46 %). Zu den Gründen gegen die Anwendung gehören, dass Zeit verloren geht (32,9 %), unkonventionelle Methoden zu teuer sind (30,4 %) und die Anwendung konventioneller Methoden verhindert wird (27,3 %). Zudem fehllten spezifisches Fachwissen und Personal.
Eine Online-Querschnittstudie mit 80 Patientinnen und zwei qualitative Studien mit 34 Patientinnen berichten Ergebnisse zur Bewertung der Patientinneninformation und zur Arzt-PatientenKommunikation. 70 % der Patientinnen meinten, dass die Beratungszeit zu KAM nicht ausreichend war und nur 53 % dachten, dass die Ärztin beziehungsweise der Arzt gut über KAM informiert sei. Aus den qualitativen Studien ging hervor, dass sich Patientinnen eine persönliche Beratung zu KIM beziehungsweise der Misteltherapie von ihrem behandelnden Arzt/ihrer behandelnden Ärztin wünschen, dass nicht nur ein Abraten, sondern auch ein Nicht-Ansprechen als Abraten interpretiert werden kann.
Keine Studie berichtet von Zugangsbeschränkungen. Als besondere Herausforderung bei der Anwendung der Misteltherapie berichten nur Ärztinnen beziehungsweise Ärzte im Krankenhaus-Setting in einer Studie, dass KIM nicht Teil der Routineversorgung sei, wodurch die Anwendung kaum möglich und abrechenbar wäre.
Verzerrungspotenzial und methodische Qualität der eingeschlossenen Studien
Die Ergebnisse der Querschnittstudien werden als valide eingestuft. Fraglich ist, ob die Rekrutierung der Stichproben in den einzelnen Studienzentren geeignet war, um repräsentative Ergebnisse für alle Patientinnen mit Brustkrebs in Deutschland zu erhalten. Das jeweilige Studien-Setting und die Selbstselektion der Teilnehmenden könnten die Ergebnisse beeinflusst haben. Die Übertragbarkeit der Ergebnisse aus den Studien auf die Zielpopulation des HTA-Berichts ist somit unklar und wird durch Mängel in der Datenqualität verstärkt, wie beispielsweise einer intransparenten Beschreibung der Patientencharakteristika in einer anonymen Online-Befragung. Die qualitativen Studien weisen unterschiedliche methodische Mängel auf. So wurde z. B. das Verhältnis zwischen Befragten und Interviewendem in keiner der Studien angemessen bedacht beziehungsweise beschrieben und auch die Datenanalyse war an vielen Stellen wenig nachvollziehbar.
Insgesamt ist die Datenbasis zu allen Zielgrößen außer der Häufigkeit der Inanspruchnahme aus der Perspektive der Patientinnen mit 197 in Querschnittstudien und 43 in qualitativen Studien gering. Die Datenlage zur Sicht des behandelnden Fachpersonals ist mit drei Studien und 654 Teilnehmenden etwas besser. Allerdings sind zwei der drei Studien bereits 20 Jahre alt.
Diskussion
Circa ein Viertel der Patientinnen mit Brustkrebs nimmt eine begleitende Misteltherapie in Anspruch. Und zumindest im Setting der identifizierten Querschnittstudien aus der Behandelndenperspektive bieten sie circa 29 % ihren Patientinnen an.
Defizite wurden beim Wissen zur Misteltherapie und bei der Kommunikation sowie der Patientinneninformation deutlich. Patientinnen fühlen sich zu wenig über die Misteltherapie informiert und wünschen sich mehr und längere persönliche Beratung durch eine kompetente Fachperson, bevorzugt aus dem Bereich Onkologie oder Allgemeinmedizin. Die Möglichkeit zur selbstständigen Information im Internet ersetzt diesen Beratungsbedarf nicht. Dieses Wissensdefizit geben auch die behandelnden Fachpersonen an und äußerten sich zur eigenen Unsicherheit bezüglich der Misteltherapie aufgrund der unklaren Evidenzlage zur Wirksamkeit und fehlendem Wissen zu komplementären Verfahren im Allgemeinen.
Die Misteltherapie oder KIM im Allgemeinen sollte im Arzt-Patienten-Gespräch proaktiv thematisiert werden. Ziel für die Arzt-Patienten-Kommunikation sollte sein, auf den jeweiligen Beratungsbedarf einzugehen und herauszufinden, welches Bedürfnis durch die Misteltherapie erfüllt werden soll oder erfüllt wird, um darauf in der Therapieplanung einzugehen.
Die derzeit (Dezember 2020) in der Konsultationsfassung vorliegende S‑3-Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften „Komplementärmedizin in der Behandlung von onkologischen Patientinnen“ kann eine Grundlage für evidenzbasierte Entscheidungen in der Arzt-Patienten-Kommunikation liefern. Bei der Entwicklung, Verwendung und Empfehlung von Informationen für Patientinnen, sollte auch das Internet als Informationsquelle nicht außer Acht gelassen werden.
Es fehlen qualitativ hochwertige Befragungen von Patientinnen zu allen Aspekten außer der Inanspruchnahme von komplementärmedizinischen Verfahren und der Misteltherapie, ebenso wie neuere Befragungen des behandelnden Fachpersonals. Diese könnten eine Grundlage für verbesserte Patientinneninformationen und Kommunikationsprozesse darstellen.
Limitationen der vorliegenden Analyse bestehen darin, dass möglicherweise nicht alle relevanten Studien über die Literaturrecherche identifiziert werden konnten. Zu Wissen, Einstellung, Akzeptanz, Zufriedenheit, Erfahrungen, Erwartungen, Zugang, Art und Umfang der Kommunikation und Information zur Misteltherapie und deren Bewertung durch Patientinnen liegt eine zu geringe Datenbasis vor und die Repräsentativität der eingeschlossenen Studien für Patientinnen mit Brustkrebs in Deutschland und auch für das behandelnde Fachpersonal ist fraglich.
Ethische Bewertung
Methodik
Die ethische Bewertung bestand aus drei Teilen. Im ersten Teil wurde recherchiert, ob bereits bestehende Empfehlungen oder Leitlinien zum Umgang mit den genuin ethischen Aspekten der Misteltherapie bei Brustkrebs vorliegen. Im zweiten Teil wurde eine systematische Übersichtsarbeit durchgeführt, die das Ziel verfolgte, ethische Aspekte bei der Misteltherapie bei Brustkrebs zu identifizieren. Hierfür wurde die eingeschlossene Literatur mittels Methoden der qualitativen Inhaltsanalyse ausgewertet. In einem dritten Teil wurden die Ergebnisse der Literaturrecherche anhand eines ethischen Rahmengerüstes den für Medizin und Public Health relevanten ethischen Prinzipien (kurz: Nutzen, Schaden, Effizienz (Kosten), Gerechtigkeit, Selbstbestimmung und Legitimität) zugeordnet. Zudem wurden auf Basis theoretischer Reflexion weitere Aspekte hinzugefügt.
Für die Literatursuche wurden die Datenbanken PubMed, PhilPapers, Sowiport und Ethicsweb verwendet. Identifiziert wurden ethische Aspekte mittels der Prinzipien des erwähnten Rahmengerüsts (das heißt, etwas ist dann ein ethischer Aspekt, wenn der Aspekt einen Bezug zu Nutzen, Schaden, Gerechtigkeit usw. hat).
Die aus der eingeschlossenen Literatur extrahierten ethischen Aspekte wurden anhand des Rahmengerüsts, mit dem sie identifiziert wurden, auch kategorisiert und mittels induktiver Kategorienbildung (das heißt, der Bildung von übergeordneten Kategorien anhand des Vergleichs des gefundenen Materials) in weitergehende, spezifischere Unterkategorien eingeordnet.
Ergebnisse
Es wurden 17 Fachartikel eingeschlossen. In der Auswertung dieser Fachartikel konnten 22 ethische Aspekte herausgearbeitet werden. Durch die ergänzende theoretische Reflexion wurden vier weitere ethische Aspekte identifiziert, die nicht in der eingeschlossenen Literatur abgebildet waren. Ebenso hat die Literaturrecherche keine spezifischen Beiträge zu berufsethischen Aspekten geliefert. Aus den anderen Domänen sind keine weiteren Aspekte ergänzt worden. Dadurch konnten insgesamt 26 ethische Aspekte identifiziert werden, die für die begleitende Misteltherapie bei Brustkrebs potenziell relevant sein können.
Die 26 ethischen Aspekte wurden in sechs Hauptkategorien eingeteilt. Diese entsprechen den verwendeten ethischen Prinzipien (Nutzen, Schaden, Selbstbestimmung, Gerechtigkeit, Effizienz (Kosten), Legitimität). Den Prinzipien „Gerechtigkeit“ und „Legitimität“ ließen sich keine ethischen Aspekte zuordnen. Zur konkreteren thematischen Einteilung der Aspekte wurden ferner acht Unterkategorien gebildet. Von den 26 Aspekten wurden 21 als ethische Risiken (Gefahr, ein ethisches Prinzip unzureichend zu berücksichtigen) und fünf als ethische Herausforderungen (Abwägung zwischen ethischen Prinzipien erforderlich) klassifiziert. Diese ethischen Aspekte wurden zu acht Kriterien (was ist ethisch erforderlich?) und vier Konflikten (was muss abgewogen werden?) konkretisiert und zusammengeführt.
Zusammenfassend lassen sich anhand der Aspekte und Kriterien/Konflikte sechs übergreifende Themen festhalten:
Als allgemeine(re) Themen, die grundsätzlich auch bei anderen Therapien im Bereich der Komplementär- und Integrativmedizin oder auch bei konventionellen Therapien zutreffend sein können, sind zu nennen:
-
1. Schwierigkeiten bei der informierten Einwilligung in die Therapie (z. B. welche Inhalte erforderlich sind, um eine ausreichende Informierung zu gewährleisten, oder wie die Freiheit der Einwilligung vor zu starker Beeinflussung vor allem von außen sichergestellt werden kann);
-
2. damit verbunden ist eine mögliche Gefahr eines „therapeutischen Missverständnisses“, das heißt, einer fehlerhaften Überzeugung einer Patientin, dass eine nur palliativ eingesetzte Therapie Teil einer kausalen Therapie sei (zur Behandlung des Brustkrebses diene);
-
3. Schwierigkeiten bei der Abwägung von Schadens- und Nutzenpotenzialen der Therapie (inklusive Wechsel- und Nebenwirkungen) oder deren Unterlassung.
Hinzu kommen spezifischere Themen, die bei der begleitenden Misteltherapie besonders auftreten:
-
4. Probleme der quantitativ und/oder qualitativ nicht ausreichenden Evidenz, um Nutzen- und Schadenspotenziale abschätzen zu können, sowie zugrundeliegende Probleme der Evidenzgenerierung für die Misteltherapie;
-
5. die mögliche mangelnde Kommunikation oder Informierung zwischen Ärztinnen/Ärzten, Komplementär-/Integrativmedizin-Behandelnden und/oder Patientinnen, ob eine Misteltherapie begonnen wird oder wurde und mit welchen Modalitäten;
-
6. Schwierigkeiten mit dem Umgang von allfälligen Placebo‑, aber auch Nocebo-Effekten bei der Misteltherapie.
Diskussion
Ein Dreh- und Angelpunkt der ethischen Bewertung der palliativen (und auch adjuvanten) Misteltherapie bei Brustkrebs dürfte die problematische Evidenzlage hinsichtlich Wirksamkeit und Sicherheit darstellen. Zum einen beziehen sich manche ethischen Aspekte beziehungsweise Kriterien/Konflikte unmittelbar auf diese, so beispielsweise all jene, die mit der Abschätzung und Abwägung von Nutzen-sowie Schadenspotenzialen zu tun haben. Zum anderen sind aber auch weitere ethische Aspekte beziehungsweise Kriterien/Konflikte von der Evidenzlage abhängig, so z. B. die Bedingungen einer erfolgreichen informierten Einwilligung in eine Therapie (Aufklärung über Nutzen- und Schadenspotenziale, Informierung über die Evidenzlage beziehungsweise Stand der Wissenschaft) oder die Kommunikation zwischen Ärztinnen/Ärzten und Komplementär-/Integrativmedizinisch-Behandelnden aufgrund möglicher Diskrepanzen bei der Einschätzung der Wirksamkeit.
Bei diesen Entscheidungen wird – zumindest, solange Schadenspotenziale als minimal eingeschätzt werden und die Finanzierung unproblematisch ist – im konkreten Einzelfall im besonderen Maße die Selbstbestimmung der Patientinnen ethisch maßgeblich sein. Darüber hinaus könnten sich bei einer allfälligen adjuvanten (nicht-palliativen) Misteltherapie, die ausschließlich von den Patientinnen privat zu bezahlen ist, zusätzliche Fragen hinsichtlich der Gerechtigkeit der rechtlichen Regelung stellen, da Krankenkassen Misteltherapie nur als palliative, nicht aber als adjuvante Therapie erstatten.
Über den Einzelfall hinaus müssen auch Entscheidungen auf der politischen Ebene dahingehend getroffen werden, ob die Kostenerstattung der palliativen Misteltherapie bei Brustkrebs angesichts der Unsicherheiten bei der Wirksamkeit weiterhin erfolgen soll. Auf institutioneller Ebene ist unklar, ob diese Unsicherheit mittel- sowie langfristig durch mehrere neue und/oder bessere Studien aufgehoben werden kann.
Besonders zu betonen bleibt bei der (palliativen, aber auch adjuvanten) Misteltherapie bei Brustkrebs aber die Gefahr, aufgrund von Vorurteilen basierend auf ihrer Zugehörigkeit zur Komplementär- oder Integrativmedizin eine unfaire Einschätzung der Nutzen- sowie Schadenspotenziale und/oder eine nicht ausreichend neutrale Aufklärung über die Therapie durchzuführen. Dabei sind sowohl mögliche negative als auch positive Vorurteile (unter anderem aufgrund weltanschaulicher Überzeugungen) gleichermaßen zu beachten, da eine unkritische und über-optimistische Einschätzung der Nutzenpotenziale mit einer dann hinsichtlich des Nutzens systematisch verzerrten Aufklärung einer Patientin ebenfalls als ethisch problematisch zu beurteilen wäre.
Zusammenfassende Diskussion, Schlussfolgerungen und Empfehlungen
Der vorliegende HTA-Bericht beinhaltet eine systematische Literaturübersicht zu Wirksamkeit und Sicherheit, Kosten und Kosteneffektivität, Patienten- und sozialen Aspekten sowie zur ethischen Bewertung.
Im Rahmen dieses HTA-Berichts konnten keine RCT zur medizinischen Wirksamkeit der begleitenden Misteltherapie hinsichtlich des Gesamtüberlebens bei Patientinnen mit Brustkrebs identifiziert werden. Eine Studie mit geringen Patientenzahlen zeigte nach fünf Jahren keinen Unterschied im krankheitsfreien Überleben zwischen Patientinnen mit und ohne begleitender Misteltherapie.
Es gibt Evidenz aus drei randomisierten Studien, dass Nebenwirkungen der Chemotherapie gemessen anhand von Symptomskalen abgemildert und die HRQOL gemessen anhand von Funktionsskalen erhöht wird. Allerdings sind die Effekte eher gering bis moderat. Es ist unsicher, ob diese Effekte durch systematische Verzerrung der nur subjektiv messbaren Zielgrößen aufgrund unzureichender Verblindung in den Studien bedingt sein könnten.
Bekannte Nebenwirkungen der Misteltherapie, wie leichtgradige und moderate Lokalreaktionen, die in diesen und weiteren vier nicht-randomisierten Studien erhoben wurden, sind häufig, aber geringen Ausmaßes. Mögliche Wechselwirkungen zwischen Krebsmedikamenten und Mistelextrakten, die auf der Immunstimulation beruhen könnten, wurden in den eingeschlossenen Studien in diesem HTA-Bericht nicht untersucht.
Zu Kosten und Kosteneffektivität einer begleitenden Misteltherapie gibt es keine ausreichend validen Studien.
Aufgrund dieser insgesamt unsicheren Datenlage kann nicht empfohlen werden, die Finanzierung der Misteltherapie durch die GKV auf die adjuvante Therapie auszudehnen. Über den Einzelfall hinaus müssen auch Entscheidungen auf der politischen Ebene dahingehend getroffen werden, ob die Kostenerstattung der palliativen Misteltherapie bei Brustkrebs angesichts der Unsicherheiten bei der Wirksamkeit weiterhin erfolgen soll.
Obwohl die Misteltherapie rezeptfrei zugelassen und verfügbar ist, ist zu hoffen, dass weitere randomisierte Studien durchgeführt werden, um die Unsicherheit hinsichtlich der Wirksamkeit zur Verbesserung der HRQOL zu reduzieren und auch mögliche Wechselwirkungen zwischen Krebsmedikamenten und Mistelextrakten als mögliche Nebenwirkungen zu erfassen. Auch die Wirksamkeit hinsichtlich des gesamten und des progressionsfreien Überlebens sollten untersucht werden. Eine Übersichtsarbeit speziell zu den methodischen Herausforderungen von randomisierten Studien zur Misteltherapie und entsprechenden Lösungsansätzen, könnte dann verwendet werden, um ein adäquates Studiendesign zu entwickeln.
Auch zu Wissen, Einstellung, Akzeptanz, Zufriedenheit, Erfahrungen, Erwartungen, Zugang, Art und Umfang der Arzt-Patienten-Kommunikation und Information zur Misteltherapie sollten möglichst repräsentative Befragungen durchgeführt werden.
Die Unsicherheit der bestehenden Datenlage macht es umso wichtiger, die Patientinnen neutral und kompetent zu beraten, unabhängig davon, welche Einstellung die Behandelnden oder Beratenden selbst zur Misteltherapie haben. Die wenigen Studien aus Patientinnensicht mit kleinen Teilnehmendenzahlen weisen darauf hin, dass sich die Patientinnen häufig nicht ausreichend durch Fachpersonal beraten fühlen und z. B. bei ablehnender Haltung der Behandelnden diese dann nicht über eine stattfindende Misteltherapie informieren. Ein wichtiger Bestandteil der Patientinnenberatung sollte die verständliche und transparente Übermittlung der Tatsache sein, dass es derzeit keinen wissenschaftlichen Nachweis gibt, ob die Misteltherapie die Überlebenszeit oder das progressionsfreie Überleben bei Patientinnen mit Brustkrebs relevant verbessert, dass eine Verbesserung der HRQOL als eher moderat einzuschätzen ist und ebenfalls nicht als gesichert gelten kann. Außerdem sollte darauf hingewiesen werden, dass aufgrund der Immunstimulation eventuell Wechselwirkungen zwischen Krebsmedikamenten und Misteltherapie auftreten könnten, dazu aber ebenfalls unzureichende Daten vorliegen. Für Patientinnen, die medizinische Informationen aus dem Internet nutzen möchten, sollten Hinweise auf vertrauenswürdige Internetseiten, die Informationen zur begleitenden Misteltherapie enthalten, gegeben werden.
Executive Summary
Background
Cancer is the second most common cause of death in Germany after cardiovascular disease. For women, breast cancer ranks first in terms of cancer-specific deaths and new cancer cases, accounting for 18,736 deaths and 30.8 % of all new cancer cases in 2016. The age-standardised incidence of breast cancer in 2016 was 112.2 women per 100,000, and the age-standardised incidence of death was 23.4 women with breast cancer per 100,000. The mean (median) age of onset is 64 years and the relative survival rate after ten years is 82 %, indicating that the chances of cure and survival are relatively good. In addition to surgery and depending on the tumour status, chemotherapy can be used to treat breast cancer. Chemotherapy is usually associated with side effects such as diarrhoea, fatigue, hair loss, fever, and blood formation disorders. This significantly impairs the patients’ quality of life during treatment.
Mistletoe preparations are used for the concomitant treatment of cancer in Germany. A major goal of treatment is to improve the health-related quality of life during therapy, which is limited due to the toxicity of chemotherapy. Mistletoe therapy is classified as complementary or integrative medicine. The biochemical mechanisms of action of mistletoe preparations are attributed to mistletoe lectins and viscotoxins, which have a non-specific immunostimulant and a cytostatic effect. Anthroposophical mistletoe extracts without standardised lectin content and mistletoe preparations registered as herbal remedies with standardised lectin content are sold on the German market. All mistletoe preparations are available without prescription. The costs of mistletoe therapy as part of palliative treatment for patients with metastatic breast cancer are covered by the statutory health insurance. Mistletoe therapy as a part of adjuvant treatment for non-metastatic breast cancer is not covered due to the uncertain evidence currently available. The HTA report by Lange-Lindberg et al. (2006) “Mistletoe therapy as an adjuvant treatment to reduce the toxicity of chemotherapy of malignant diseases” concluded that only in the case of breast cancer were there indications that an adjuvant mistletoe therapy could improve the patient’s quality of life. The current German medical guideline on early detection, diagnosis, and therapy of breast cancer states that mistletoe therapy does not improve the survival of patients with breast cancer, and an improvement in quality of life is questionable due to insufficient data. This raises the question of whether there is new evidence on medical efficacy and safety that can clarify these questions. In addition, the present report aims to systematically examine costs and cost-effectiveness, patients’ aspects and social implications, and ethical questions associated with concomitant mistletoe therapy.
Research questions
-
1. The following research questions were investigated to evaluate medical efficacy and safety: Does the administration of mistletoe preparations reduce patient-relevant side effects of conventional chemotherapy and improve health-related quality in patients with breast cancer compared to chemotherapy without concomitant therapy with mistletoe preparations? Does the administration of mistletoe preparations in addition to conventional chemotherapy influence progression-free survival or overall survival in patients with breast cancer?
-
2. To evaluate economic aspects, the following research questions were investigated: What are the differences in the costs of concomitant mistletoe therapy and what is the cost-effectiveness of concomitant mistletoe therapy compared to treatment without mistletoe preparations?
-
3. The evaluation of patients and social aspects examined the following research questions: What are the attitudes, experiences, perceptions, and knowledge of patients and professionals regarding concomitant mistletoe therapy? Are there barriers to accessing mistletoe therapy for interested patients? What does communication about concomitant mistletoe therapy look like, and are there particular points that should be communicated to ensure adequate uptake?
-
4. The ethical evaluation examined the following research questions: Which ethical aspects on an individual, social, and professional level are relevant for mistletoe therapy as a concomitant therapy in patients with non-metastatic or metastatic breast cancer compared to conventional therapy alone? What is the outcome of an evaluation and weighing of the identified ethical aspects and challenges regarding the use of mistletoe therapy as concomitant therapy in patients with breast cancer, i. e., under what conditions is the use of concomitant mistletoe therapy in adjuvant and palliative treatment of breast cancer ethically justifiable?
Evaluation of efficacy and safety
Methods
Main inclusion and exclusion criteria for primary studies, systematic reviews, HTA reports and evidence-based guidelines
Published randomised controlled trials (RCT) on the efficacy and safety of adjuvant or palliative mistletoe therapy in patients with breast cancer were included that examined outcomes on at least one of the following outcome measures: adverse effects of standard therapy, health-related quality of life, overall survival, progression-free survival, adverse effects of mistletoe therapy. For the assessment of adverse effects of mistletoe therapy, observational studies were also included. In addition, systematic reviews and HTA reports with literature searches from 2004 onwards that met the above inclusion criteria as well as evidence-based clinical practice guidelines for the treatment of breast cancer with statements on complementary medicine from 2008 onwards were included.
Literature search, selection, assessment of study quality, data extraction and evidence synthesis
A systematic literature search was conducted in the following databases: MEDLINE, EMBASE, Cochrane Library and in the HTA Database of the Centre of Reviews and Dissemination. The search period ranged from January 1st, 2004 to March/April 2017. Between April 2017 and October 2020, further publications were identified through a continuous update function in PubMed. Search terms for the disease (breast cancer) and for the therapy (mistletoe preparations) were combined in the form of free text and database-specific thesaurus terms. An internet search was conducted using the Grey Matters checklist of the Canadian Agency for Drugs and Technologies in Health. Guidelines were also searched for in three guideline databases. All references were selected independently by two authors using the predefined inclusion and exclusion criteria. Differences were resolved through discussion. In addition, a hand search was conducted in the bibliographies of the identified included systematic reviews, HTA reports, primary studies, and guidelines.
Cochrane’s Risk of Bias tool was used to assess potential bias of the RCT, and the Appraisal of Guidelines for REsearch & Evaluation (AGREE) tool was used to assess the methodological quality of the guidelines.
Identified HTA reports and systematic reviews were used to search for additional primary studies. From the included studies and guidelines, the relevant characteristics and results were extracted by one person and checked for accuracy by a second. The results from the primary studies on the efficacy and safety of concomitant mistletoe therapy in breast cancer were presented in evidence tables and figures and described in summary texts. Due to the heterogeneity of the studies, no meta-analyses were performed. The recommendations of the clinical guidelines on concomitant mistletoe therapy are described in text form.
Results
In the literature search, 242 references were identified after removing duplicates. After screening of titles and abstracts, 80 articles were reviewed in full text and a total of seven studies were included in the information synthesis for the evaluation of clinical efficacy and safety. For the description of guideline recommendations, two guidelines were included after reviewing 199 references and 163 full texts.
Efficacy
No study on the effect of concomitant mistletoe therapy on overall survival was identified. A three-arm RCT with a small sample size comparing two different mistletoe preparations with a placebo control showed no effect of concomitant mistletoe therapy on progression-free survival after five years – 72.4 and 67.9 % with concomitant therapy and with the mistletoe preparations, 78.6 % in the control group (p‑value compared to the control group 0.551 and 0.746, respectively). Three RCT (719 patients) investigated the change in health-specific quality of life and adverse symptoms of the standard therapy after 15 and 18 weeks. Four different validated quality of life instruments (FACT‑G [Functional Assessment of Cancer Therapy – General], GLQ‑8 [Global Life Quality], Spitzer analogue scale, EORTC-LQ-C30 [European Organisation for Research and Treatment of Cancer]) were used. In one study (352 patients), the FACT‑G questionnaire was used. The group difference of the total score (range 0 to 80 points, control group score in placebo group at baseline 50 points), after 15 weeks was four points (p‑value < 0.0001) in favour of the mistletoe group. A value for a minimal clinically relevant difference is not given. Two studies (598 patients) used the GLQ‑8 symptom scale, a visual analogue scale measured in mm. In one study (272 patients), the change in the GLQ‑8 symptom scale (range 0 to 800 mm) after 15 weeks was 30 mm (p‑value 0.0121) in favour of the mistletoe group. The values at baseline ranged from 128.9 to 171.5 mm in four study arms. In the second study (352 patients), the difference in favour of the mistletoe group was 40 mm (p‑value < 0.01). At baseline, the value was 150 mm. The indication of a minimal clinically relevant difference was missing. However, the difference was considered clinically relevant by the study authors. The Spitzer analogue scale questionnaire on quality of life (theoretically possible range 0 to 100) showed a change in favour of the mistletoe group after 15 weeks in the same two studies. The difference was 5.8 and approximately 5.0 mm, respectively. The values at baseline varied between 29 and 46.4 mm in the study arms. Again, there is no statement about a clinically relevant minimum difference. One study (95 patients) investigated two mistletoe preparations in parallel versus a control group and used the EORTC QLQ-C30 questionnaire. The EORTC QLQ-C30 consists of five functional scales, one total health subscale and nine symptom scales, which are reported individually (range 0 to100 points each). A difference of at least five points is considered clinically relevant. After 18 weeks, both groups with mistletoe preparations had statistically significant values (p‑value < 0.05) above five points difference from the control group in three functional scales (role, social, and emotional) and five symptom scales (nausea and vomiting, insomnia, loss of appetite, diarrhoea, and financial problems). The differences compared to the control group ranged from 6.01 to 14.09 points.
Risk of bias in studies
All studies were adequately randomised and have low data loss in the analysis. For two studies, it is unclear whether group allocation was concealed. One study was unblinded and two studies were double blinded with a placebo. However, due to the frequent local reactions, unblinding is likely. Because health-related quality of life is a patient-reported outcome, there is a high risk of performance and detection bias. The risk of bias due to attrition was low or unclear, and the risk of bias due to other causes was low.
Safety
A total of seven studies with 1,951 patients were included for the question of undesirable side effects due to concomitant mistletoe therapy, three of which are the RCT already identified for the question on efficacy. From these seven studies, only the data from the study arm with concomitant mistletoe therapy were taken. Known side effects of mistletoe injections are local skin reactions and systemic reactions such as fever and flu-like symptoms. In six studies with eight intervention groups, a median of 25.2 % (range 4.6 to 94 %) of the patients had local reactions of low or moderate severity.
Seven studies reported numbers of mild and moderate systemic reactions in the study populations, with a median of 1.95 % (range 0 to 8.2 %).
Discussion
In summary, there is no evidence on the effect of concomitant mistletoe therapy on overall survival and little evidence that concomitant mistletoe therapy has no effect on progression-free survival after five years. The improvements in health-related quality of life compared to the control group are small to moderate. Since there was a high risk of bias in all studies due to the lack of or inability to maintain blinding, it is possible that the difference is not caused by the concomitant mistletoe therapy. It seems unclear whether the study results are fully transferable to the current conditions in German-speaking countries. The included studies were conducted before 2004 or between 2005 and 2007. All studies took place in Eastern or South-Eastern Europe. Recent developments in breast cancer therapy as well as differences in health care and culture in the German-speaking countries compared to these countries could have an influence on the transferability of the study results.
Overall, there is great uncertainty as to whether the presented small to moderate improvements in health-related quality of life or the reduction of symptoms caused by chemotherapy and disease can be causally attributed to mistletoe therapy. Additionally, it is uncertain whether the results of the studies can be transferred to the current conditions in German-speaking countries. Thus, new studies could lead to a change in the overall assessment of the evidence.
New randomised studies on health-related quality of life should try to solve the central methodological problem of maintaining double blinding.
The present review on clinical efficacy and safety is subject to several limitations. The comprehensive systematic literature search was conducted in 2017. However, automatically updated notifications from one of the bibliographic databases and the review of current systematic reviews allowed us to confirm that no additional recent studies (with a censor date of December 2020) are available. Full texts of two RCT identified in previous reviews were not available, so we did not report the results from those studies. These studies had small case numbers ranging from 17 to 46 patients, poor reporting quality, and a high risk of bias. Accordingly, inclusion or exclusion of these studies would not change the outcome of the evaluation. Due to the heterogeneity of the studies, we did not consider it appropriate to conduct a metaanalysis for efficacy or safety outcomes. However, the statistical uncertainty that can be reduced by a meta-analysis was not the main limitation. Our main limitation was the high potential for systematic bias in the effect sizes.
Evaluation of costs and cost-effectiveness
Methods
Main inclusion and exclusion criteria for studies
For the assessment of costs and cost-effectiveness of concomitant mistletoe therapy, we applied the same inclusion and exclusion criteria of the assessment of efficacy and safety for study population, intervention, and comparator intervention. Outcome measures were the additional costs of concomitant mistletoe therapy as well as additional costs per life year gained or quality-adjusted life year. All health economic study types were included. The evaluations had to relate to the German-speaking region.
Literature search, selection, assessment of study quality, data extraction and evidence synthesis
Literature search and selection were conducted analogously to the assessment of clinical efficacy and safety. Standardised extraction forms were used for data extraction, and the criteria catalogue for the methodological quality of health economic studies of the German Scientific Working Group Technology Assessment in Health Care was used for quality assessment. Study characteristics and results were summarised in evidence tables.
Results
In the literature search, 243 references were identified after removing duplicates. After screening of titles and abstracts, five full-text articles were reviewed, and one study was included in the information synthesis.
A comparative cost analysis of concomitant mistletoe therapy was identified based on data from 15 to 20 years ago. The underlying multi-centre, retrospective cohort study investigated the efficacy and safety of concomitant mistletoe therapy in patients with breast cancer during routine follow-up in 53 randomly selected hospitals and medical practices in Germany. Direct medical costs in inpatient and outpatient settings as well as indirect costs for a loss of productivity of up to 90 days were collected after surgery and the completion of adjuvant chemotherapy or radiotherapy. In total, the data of 741 patients were analysed—167 patients with concomitant mistletoe therapy, 514 patients with Standard therapy without concomitant mistletoe therapy, 60 patients who had switched between standard therapy alone and concomitant mistletoe therapy.
The average total costs within five years for a patient with concomitant mistletoe therapy were 4,504 euros, compared to 9,996 euros for a patient with standard therapy. The difference was mainly due to inpatient costs and lost productivity costs. Data on statistical uncertainty were not reported. The study has many limitations in data quality, but the main weakness is that the observational study on which the economic evaluation is based did not control for systematic bias with the study design.
Discussion
Studies on the cost-effectiveness of concomitant mistletoe therapy were not found.
The large cost difference in favour of concomitant mistletoe therapy in the comparative cost analysis cannot be attributed to a causal effect of mistletoe therapy due to the high risk of bias, as the data are based on an observational study without any control for systematic bias due to confounders. However, data on the level of education as well as other prognostic factors that are known confounders were not collected in the study. It therefore remains unclear whether an accompanying mistletoe therapy can reduce the costs of illness in the follow-up care of breast cancer.
As long as the question of the clinical effectiveness of concomitant mistletoe therapy is uncertain, the question of cost-effectiveness cannot be answered.
Evaluation of patients’ and social aspects
Methods
Main inclusion and exclusion criteria for studies
All published studies on mistletoe therapy in patients with breast cancer that refer to the German-speaking region and have reported results on relevant outcome measures on patients and social aspects were included. Relevant outcome measures are the following: use of mistletoe therapy, knowledge, attitude, acceptance, satisfaction, experiences, expectations of users of mistletoe therapy, access to mistletoe therapy, type and extent of communication and information on mistletoe therapy, and mistletoe therapy evaluation by patients. The outcome measures could be reported from the perspective of the patients, from the perspective of their caregivers or family members, or from the perspective of the treating health professionals. Quantitative and qualitative study types without further restriction could be included.
Literature search, selection, assessment of study quality, data extraction and evidence synthesis
For the literature search, in addition to the cross-domain search and the comprehensive search for grey literature described above, a systematic database search was conducted in twelve databases from the fields of medicine, economics, sociology, and psychology. All references were selected independently by two authors using the predefined inclusion and exclusion criteria. Differences were resolved through discussion. In addition, a hand search was conducted in the bibliographies of the included primary studies. The checklists of the Critical Appraisal Skills Program were used in original or adapted form to assess the risk of bias. Relevant characteristics and results were extracted from the included studies by one person and checked for accuracy by a second. Results for quantitative primary studies were summarised and presented in evidence tables. The qualitative studies were analysed using qualitative content analysis.
Results
The literature search identified 318 references after removing duplicates. After screening of titles and abstracts, 96 articles were reviewed in full text. A total of twelve cross-sectional studies – nine on the patient perspective and three on the practitioner perspective – and three qualitative studies were included in the information synthesis for the assessment of patient aspects and social aspects.
Ten studies with 3,421 patients with breast cancer report results on the frequency of use of complimentary and integrative medicine (CIM) and mistletoe therapy. A median of 24.9 % (range 7.3 to 46.3 %) of patients with breast cancer use mistletoe therapy. Seven of the ten studies with 2,482 patients report sociodemographic, disease-related, or therapy-related characteristics that are more frequent in patients with breast cancer when using complementary methods than in patients not using them. CAM users (CAM = Complementary and alternative medicine) are younger, have a higher level of education, and a more severe disease course.
Three studies with 654 professionals (mostly physicians) report results on the frequency of use of CIM and concomitant mistletoe therapy and on characteristics of the professionals who use them. .A median of 29.3 % (range: 29.3 to 79.2 %) use concomitant mistletoe therapy. CIM and concomitant mistletoe therapy users of the treating professionals are typically older and work in private practice or have a higher hierarchical status in the hospital.
Eight studies describe the respondents’ attitudes towards concomitant mistletoe therapy and what benefits they expect from its use, including two cross-sectional studies with 197 patients with breast cancer, three cross-sectional studies with 654 treating professionals, and three qualitative studies with 43 patients with breast cancer. In one study, trust in the counsellor and perceived competence regarding CIM was important for 90 % of CIM users because it made them feel that the use of CIM was good for them. In another study, patients want to leave nothing untried (47 %), want an active role in treatment (47 %), want to complement conventional therapy (31 %), want to have a gentle treatment free of side effects (18 %), or did not respond to conventional therapy and mistletoe therapy (3.6 %). Specifically, the use of mistletoe therapy is associated with the expectation of having fewer side effects with conventional cancer therapy and stimulating the immune system.
Reasons for the application of mistletoe therapy among treating professionals were the patients’ wish (82 %), patients’ motivation (62 %), the expansion of their own range of services (59 %), their own conviction (55 or 66 %), or the belief in the ineffectiveness of conventional therapy (46 %). Reasons against using mistletoe therapy include that time is lost (32.9 %), unconventional methods are too expensive (30.4 %), and the use of conventional methods is prevented (27.3 %). In addition, specific expertise and personnel are lacking.
An online cross-sectional study with 80 patients and two qualitative studies with 34 patients report results on the assessment of patient information and doctor-patient communication. Seventy of the patients thought that the consultation time on CIM was not sufficient and only 53 % thought that the doctor was well informed about CIM. The qualitative studies showed that patients would like personal advice on CIM or mistletoe therapy from their attending physician, and not only advice but also not mentioning CIM or mistletoe therapy can be interpreted as advice.
No study reported access restrictions. As a particular challenge in the application of mistletoe therapy, only physicians in the hospital setting reported in one study that CIM is not part of routine care and reimbursement schemes, which makes its application hardly possible and billable.
Risk of bias and methodological quality of studies
The results of the cross-sectional studies are considered valid. It is questionable whether the recruitment of the samples in the individual study centres was suitable to obtain representative results for all patients with breast cancer in Germany. The respective study setting and the self-selection of the participants could have influenced the results. The transferability of the results from the studies to the target population of the HTA report is thus unclear and is reinforced by deficiencies in data quality, such as a non-transparent description of patient characteristics in an anonymous online survey. The qualitative studies show different methodological deficiencies. For example, the relationship between respondents and interviewers was not adequately considered or described in any of the studies, and the data analysis was not reported sufficiently in many places.
Overall, the evidence base for all outcomes from the patient’s perspective, except for the frequency of utilisation, is low, with 197 patients in cross-sectional studies and 43 in qualitative studies. The evidence base on the perspective of the treating professionals is somewhat better, with three studies and 654 participants. However, two of the three studies are already 20 years old.
Discussion
Approximately one quarter of patients with breast cancer make use of concomitant mistletoe therapy. In the setting of the identified cross-sectional studies from the treating perspective, about 29 % of healthcare professionals offer concomitant mistletoe therapy to their patients.
Deficits became apparent in knowledge about mistletoe therapy, communication, and patient information. Patients feel insufficiently informed about mistletoe therapy and would like more and longer personal advice from a competent specialist, preferably from an oncologist or general practitioner. The possibility to obtain information independently on the internet does not replace this need for counselling. This lack of knowledge was also stated by the treating professionals who commented on their own uncertainty regarding mistletoe therapy due to the unclear evidence on its efficacy and the lack of knowledge about complementary methods in general.
Mistletoe therapy or CIM in general should be proactively discussed in doctor-patient consultations. The goal for doctor-patient communication should be to address the need for counselling, determine which need should be or is fulfilled by mistletoe therapy, and address that need in therapy planning.
The S‑3 Guideline of the Association of the Scientific Medical Societies “Complementary Medicine in the Treatment of Oncological Patients” (December 2020), which is currently available in the consultation version, can provide the basis for evidence-based decisions in doctor-patient communication. When developing, using, and recommending information for patients, the internet should not be disregarded as a source of information.
There is a lack of high-quality surveys of patients on all patient aspects, except for the use of mistletoe therapy, as well as more recent surveys of treating professionals. Additional high-quality surveys of both patients and healthcare professionals could form the basis for improved patient information and communication processes.
Limitations of the present analysis are that it may not have been possible to identify all relevant studies through the literature search. There is too little data available on knowledge, attitudes, acceptance, satisfaction, experiences, expectations, access, type and scope of communication, information on mistletoe therapy available to patients, and evaluation of this information by patients. Whether the included studies are representative of patients with breast cancer and the treating professionals in Germany is questionable.
Ethical Evaluation
Methods
The ethical evaluation consisted of three parts. In the first part, a search was conducted to determine whether there are existing recommendations or guidelines for dealing with the ethical aspects of mistletoe therapy in breast cancer. In the second part, a systematic review was conducted with the aim of identifying ethical aspects of mistletoe therapy in breast cancer. For this purpose, the included literature was evaluated using methods of qualitative content analysis. In a third part, the results of the literature review were assigned to the ethical principles relevant to medicine and public health (i. e., benefit, harm, efficiency (costs), justice, self-determination, and legitimacy) using an ethical framework. In addition, further aspects were added based on theoretical reflection.
The following databases were used for the literature search: PubMed, PhilPapers, Sowiport, and Ethicsweb. Ethical aspects were identified using the principles of the framework mentioned above (i. e., something is an ethical aspect if the aspect has a relation to benefit, harm, justice, etc.).
The ethical aspects extracted from the included literature were categorised using the framework with which they were identified, and by means of inductive categorisation (i. e., formation of superordinate categories based on comparison of the material found), they were classified into specific subcategories.
Results
Seventeen professional articles were included. In the evaluation of these articles, 22 ethical aspects were identified. Through the supplementary theoretical reflection, four additional ethical aspects were identified that were not represented in the included literature. Similarly, the literature search did not yield any specific contributions on professional ethical aspects. No further aspects were added from the other domains. This made it possible to identify a total of 26 ethical aspects that could potentially be relevant for concomitant mistletoe therapy in breast cancer.
The 26 ethical aspects were divided into six main categories. These correspond to the ethical principles used (benefit, harm, self-determination, justice, efficiency (cost), and legitimacy). For the principles “justice” and “legitimacy”, no ethical aspects could be assigned. For a more concrete thematic classification of the aspects, eight subcategories were also formed. Of the 26 aspects, 21 were classified as ethical risks (risk of insufficient consideration of an ethical principle) and five as ethical challenges (balancing between ethical principles required). These ethical aspects were concretised and combined into eight criteria (what is ethically required?) and four conflicts (what needs to be weighed?).
In summary, six overarching themes can be identified based on the aspects and criteria/conflicts:
General topic(s) that may in principle also apply to other therapies in the field of complementary and integrative medicine or to conventional therapies include:
-
1. Difficulties in informed consent to therapy (e. g., what content is required to ensure sufficient information, or how to ensure freedom of consent from too much influence, especially from outside).
-
2. A possible danger of a “therapeutic misunderstanding”, e. g., an erroneous conviction on the part of a patient that a therapy used only palliatively is part of a causal therapy (i. e., serves to treat the breast cancer).
-
3. Difficulties in weighing the potential harms and benefits of the therapy, including interactions and side effects, or failure to do so.
In addition, there are more specific issues that arise particularly in concomitant mistletoe therapy including:
-
4. Problems of quantitatively and/or qualitatively insufficient evidence to assess potential benefits and harms and underlying problems of evidence generation for mistletoe therapy.
-
5. The possible lack of communication or information between physicians, complementary/integrative medicine practitioners, and/or patients as to whether mistletoe therapy is or has been started and with which modalities.
-
6. Difficulties in dealing with possible placebo or nocebo effects in mistletoe therapy.
Discussion
A pivotal point in the ethical evaluation of palliative as well as adjuvant mistletoe therapy for breast cancer is the problematic evidence situation regarding efficacy and safety. On the one hand, some ethical aspects or criteria/conflicts relate directly to this. For example, all aspects that have to do with the assessment and weighing of potential benefits and harms are directly related to efficacy and safety of mistletoe therapy. On the other hand, other ethical aspects or criteria/conflicts are dependent on the evidence situation, such as the conditions for successful informed consent to a therapy (e. g., information about potential benefits and harms, information about the evidence situation or the state of science) or the communication between doctors and complementary/integrative medicine practitioners due to possible discrepancies in the assessment of effectiveness.
In these decisions – at least as long as the potential for harm is considered minimal and financing is unproblematic – the autonomy of the patients will be ethically decisive to a particular extent in each individual case. Furthermore, in the case of a possible adjuvant (non-palliative) mistletoe therapy, which must be paid out of pocket by the patients, additional questions could arise regarding the fairness of the legal regulation since the statutory health insurance only reimburses mistletoe therapy as a palliative, not as an adjuvant, therapy.
Beyond the individual case, decisions must also be made at the political level as to whether reimbursement of palliative mistletoe therapy for breast cancer should continue in view of the uncertainties surrounding its effectiveness. At the institutional level, it is unclear whether this uncertainty can be resolved in the medium and long term through several new and/or better studies.
However, in the case of palliative as well as adjuvant mistletoe therapy for breast cancer, special emphasis must be placed on the danger of both an unfair assessment of the potential benefits and harms and/or insufficiently neutral education about the therapy due to prejudices based on its affiliation with complementary or integrative medicine. In this context, both possible negative and positive prejudices (e. g., due to ideological convictions) must be considered, as an uncritical and overly-optimistic assessment of the benefit potentials and a distorted explanation of the benefits to the patient could be judged as ethically problematic.
Summary discussion, conclusions and recommendations
This HTA report contains a systematic literature review on efficacy and safety, costs and cost-effectiveness, patients and social aspects, and ethical evaluation.
Within the scope of this HTA report, no randomised controlled trials on the clinical efficacy of concomitant mistletoe therapy regarding overall survival in patients with breast cancer could be identified. One study with a small sample size showed no difference in disease-free survival after five years between patients with and without concomitant mistletoe therapy.
There is evidence from three randomised controlled trials that side effects of chemotherapy, as measured by symptom scales, are reduced and health-related quality of life, as measured by functional scales, is increased. However, the effects are rather small to moderate. It is uncertain whether these effects could be due to systematic bias of the only subjectively measurable outcome measures due to insufficient blinding in the studies.
Known side effects of mistletoe therapy, such as mild and moderate local reactions, that were recorded in these three RCT and four other non-randomised studies are common but of low magnitude. Possible interactions between anticancer drugs and mistletoe extracts, which could be due to immune stimulation, were not investigated in the included studies.
There are no sufficiently valid studies on the costs and cost-effectiveness of concomitant mistletoe therapy.
Given this overall uncertain evidence, the extension of the funding of mistletoe therapy to adjuvant therapy by statutory health insurance cannot be recommended. Beyond individual cases, decisions must also be made at the political level as to whether reimbursement of palliative mistletoe therapy for breast cancer should continue in view of the uncertainties surrounding its efficacy.
Although mistletoe therapy is approved and available without prescription, it is hoped that further randomised trials will be conducted to reduce the uncertainty regarding efficacy in improving quality of life and to capture possible interactions between anticancer drugs and mistletoe extracts as possible side effects. Efficacy in terms of overall survival and progression-free survival should also be investigated. A review on the methodological challenges of randomised trials of mistletoe therapy and corresponding approaches to solving them could then be used to develop an adequate study design.
Representative surveys should also be conducted on knowledge, attitudes, acceptance, satisfaction, experiences, expectations, access, type and extent of doctor-patient communication, and information on mistletoe therapy.
The uncertainty of the existing data makes it even more important to advise patients neutrally and competently, regardless of the attitude of the practitioners or counsellors themselves towards mistletoe therapy. The few studies from the patient point of view with small numbers of participants indicate that patients often do not feel adequately advised by professionals, and patients do not inform the practitioner about mistletoe therapy if the practitioner’s attitude is negative. An important component of patient counselling should be firstly the comprehensible and transparent communication of the fact that there is currently no scientific proof of whether mistletoe therapy relevantly improves overall survival time or progression-free survival in patients with breast cancer. Secondly, it should be made clear that an improvement in health-related quality of life is to be assessed as rather moderate and cannot be regarded as assured. In addition, it should be pointed out that interactions between cancer drugs and mistletoe therapy could possibly occur due to the immune stimulation, but there is currently insufficient data on this as well. For patients who would like to use medical information from the Internet, references should be made to trustworthy websites that contain information on concomitant mistletoe therapy.
Grundlagendokument
1 Einleitung und Hintergrund
1.1 Gesundheitspolitischer Hintergrund
Krebserkrankungen waren 2016 mit 230.725 von insgesamt 910.902 Todesfällen nach Herz-KreislaufKrankheiten die zweithäufigste Todesursache in Deutschland. Das entspricht 25,3 % aller Todesfälle.1 Brustkrebs (Hauptdiagnose nach ICD-10 C50) lag 2016 mit 18.736 Todesfällen bei einem Anteil von 2,1 % unter allen Todesursachen nach ICD-10.1 Grundsätzlich können auch Männer an Brustkrebs erkranken, jedoch liegt die standardisierte Erkrankungsrate bei 1,1 Erkrankungen je 100.000 pro Jahr (ICD = Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme, zehnte Auflage, engl.: International statistical classification of diseases and related health problems, 10th revision).2, 3
Bei Frauen steht Brustkrebs sowohl bei den Krebssterbefällen als auch bei den Krebsneuerkrankungen an erster Stelle. 2016 waren 4,0 % der gesamten Sterbefälle bei Frauen und 17,6 % der Krebssterbefälle bei Frauen in Deutschland auf Brustkrebs zurückzuführen. Dies sind 18.570 Fälle der insgesamt 462.598 im Jahr 2016 gestorbenen Frauen.1 Bei den Krebsneuerkrankungen liegt der Anteil von Brustkrebs bei 30,8 %. Die altersstandardisierte Erkrankungsrate betrug 2016 112,2 Frauen pro 100.000. Das waren 68.950 Frauen. Das mittlere (mediane) Erkrankungsalter liegt bei 64 Jahren.3
Die Neuerkrankungsrate stieg seit 1998 bis circa 2008 an. Die Einführung des Mammografie-Screenings 2005 bewirkte vorübergehend einen sprunghaften Anstieg der Neuerkrankungsrate. Seit 2009 ist diese Entwicklung jedoch wieder rückläufig. Die altersstandardisierte Sterberate liegt 2016 bei 23,4 Patientinnen mit Brustkrebs je 100.000 Personen.3 Der Durchschnitt der relativen Überlebensraten der einbezogenen Bundeslänger liegt nach fünf Jahren bei 87 %, die relative Überlebensrate nach zehn Jahren bei 82 %. Diese Zahlen zeigen, dass es sich um eine Erkrankung handelt, mit der die Betroffenen über einen langen Zeitraum leben.3
Die Krankheitskosten, die in Deutschland durch Patientinnen mit der Diagnose ICD-C50 entstehen, sind in den vergangenen Jahren stetig angestiegen.4 Im Jahr 2004 lagen die Kosten bei 1.605 Millionen Euro, 2006 bei 1.918 Millionen Euro5 und 2015 bei 2.196 Millionen Euro6. Grund hierfür ist neben der hohen Prävalenz und Inzidenz auch der technische Fortschritt. Die meisten Ressourcen für Diagnose, Therapie und Rehabilitation maligner Erkrankungen werden im stationären und teilstationären Sektor verbraucht.7
Auch der Bereich komplementäre und integrative Medizin (KIM), zu dem die Misteltherapie zählt, wird von vielen Patientinnen mit Brustkrebs in Anspruch genommen, jedoch sind nicht-palliativ behandelte Patientinnen oft Selbstzahlende. Die Kosten für Mistelextrakte variieren. In Deutschland kostet ein zwei-bis dreiwöchiger Behandlungszyklus etwa 60 Euro pro Person.8 Die Kosten werden vor allem deswegen nicht für alle Patientinnen von der Gesetzlichen Krankenversicherung (GKV) übernommen, weil bisher kein Zusatznutzen durch die Misteltherapie belegt werden konnte.
2006 wurde ein vom Deutschen Institut für Medizinische Dokumentation und Information (DIMDI) beauftragter Health Technology Assessment (HTA)-Bericht „Misteltherapie als begleitende Behandlung zur Reduktion der Toxizität der Chemotherapie maligner Erkrankungen” veröffentlicht. Dieser befasste sich mit der Sicherheit und Wirksamkeit der Misteltherapie. Der Bericht kam zu dem Schluss, dass die damals vorliegende Evidenz nicht ausreichend war, um eine Aussage darüber zu treffen, ob die zusätzliche Gabe von Mistelpräparaten die angestrebte Abmilderung der Toxizität der Chemotherapie bei Patienten mit verschiedenen Krebserkrankungen bewirkt. Ein Grund hierfür war die Wahl der verwendeten Zielparameter in den identifizierten Studien. Die Häufigkeit und der Schweregrad der Chemotherapie-bedingten Nebenwirkungen war in keiner der Studien der vorrangig betrachtete Zielparameter. Die Studien lieferten widersprüchliche Ergebnisse. Es wurden sowohl positive als auch keine Effekte auf Häufigkeit und Schweregrad der Chemotherapie-bedingten Nebenwirkungen berichtet. In fünf Studien wurde auch die gesundheitsezogene Lebensqualität (HRQOL) als primärer Endpunkt untersucht. Nur bei Brustkrebs wiesen die Ergebnisse darauf hin, dass die Gabe von Mistelpräparaten zusätzlich zur Chemotherapie die HRQOL positiv beeinflusst. Anhand der damaligen Studienlage konnte nicht abgeschätzt werden, ob durch eine zusätzliche Misteltherapie die Tumorremission oder die Überlebenszeit beeinflusst wird.7
Von der GKV wird vor allem wegen des fehlenden Wirkungsnachweises eine begleitende Misteltherapie nur bei Patientinnen mit metastasiertem Brustkrebs zur Palliativbehandlung erstattet, nicht hingegen bei der kurativen adjuvanten Behandlung. Im Kontext von Brustkrebs wird unter Palliativbehandlung stets die Behandlung von metastasiertem Brustkrebs verstanden, bei dem die Krankheit zwar therapierbar, aber nicht heilbar ist. Oberstes Therapieziel ist hier die Wiedererlangung und Erhaltung der Lebensqualität, ohne Behandlungen zur Lebensverlängerung auszuschließen.9, 10 Die adjuvante Therapie bezeichnet bei Brustkrebs die Therapie des nicht-metastasierten Brustkrebses und zielt auf Heilung ab. Sie wird im Anschluss an eine operative Sanierung einer Tumorerkrankung durchgeführt.11 Daneben gibt es zudem die präoperative (neoadjuvante) Therapie.
Der vorliegende Bericht untersucht nun mit der Hauptfragestellung, ob es seither neue Evidenz zur Wirksamkeit der Misteltherapie bei Patientinnen mit metastasierendem Brustkrebs als begleitende Behandlung zur Reduktion unerwünschter Nebenwirkungen der Chemotherapie und der Erhöhung der HRQOL gibt. Als weitere Fragestellung wird untersucht, ob auch Patientinnen in kurativer, adjuvanter Behandlung von der Misteltherapie profitieren. Die Effekte auf Tumorremission (Verkleinerung oder Verschwinden des Tumors) und Gesamtüberlebenszeit bei beiden Patentinnengruppen werden ebenfalls betrachtet. Darüber hinaus werden Kosten, Kosteneffektivität sowie ethische und soziale Aspekte der Behandlung untersucht.
Die Krankheitsbilder von Krebserkrankungen können je nach betroffenem Organ sehr unterschiedlich sein. Das Prinzip der Entstehung von Krebs ist jedoch bei allen Krebserkrankungen gleich. Es handelt sich um eine Erkrankung, bei der das Erbgut und die Zellstruktur von Körperzellen durch eine irreversible Veränderung (Mutation) geschädigt wurden, sodass die Regulierung der Zellteilung gestört wird. Weitere maligne Mutationen können spontan auftreten oder von Karzinogenen verursacht werden. Es kommt zu einem unkontrollierten Wachstum und genetischer Instabilität. Körpereigene Reparaturmechanismen versagen, da sich mutierte Krebszellen den Kontrollmechanismen der Zellteilung entziehen können. Der Prozess der Tumorentwicklung kann sich über viele Jahre erstrecken.12
Unterschieden wird zwischen malignen und benignen Tumorarten. Der Hauptunterschied ist, dass bei den benignen Tumoren das umliegende Gewebe nicht befallen wird und keine Tumorstreuung auftritt. Maligne Tumoren (das heißt bösartige Tumoren), die auch als Krebs bezeichnet werden, sind invasiv. Im Laufe des Tumorwachstums kommt es mit fortschreitendem Stadium zu einer Invasion in benachbarte Gefäße oder zur Zirkulation der Tumorzellen im ganzen Organismus. Durch den Verlust der Differenzierung ist es Krebszellen möglich, sich in anderen Organen anzusiedeln und dort Tochtergeschwülste zu bilden (Metastasierung).13, 14
Aufgrund des schnelleren Ablaufs der Zellteilung wächst das Tumorzellengewebe schneller als das angrenzende gesunde Gewebe. Vor allem die Raumforderung der Tumorzellen verursacht Schmerzen und physiologische Funktionsstörungen. Die Invasion und Destruktion benachbarten gesunden Gewebes führen in der Regel auch zu Schmerzen und Blutungen.7
Beim Brustkrebs ist das Gewebe der Brustdrüse von der entarteten Zellteilung betroffen. In der Kodierung ICD-10 C5015 sind bösartige Neubildungen der Brustdrüse (Mamma) zusammengefasst. Wie bei allen Krebsarten wird unterschieden zwischen der örtlich begrenzten Primärerkrankung und dem rezidivierten (wiederkehrenden) oder metastasierten Mammakarzinom.13
Grundlage für die Behandlung eines Mammakarzinoms ist der pathologisch-anatomische Befund. Für die Erfassung des Erkrankungsstatus und die Prognose einer Tumorerkrankung sind das histologische und das zytomorphologische Bild sowie die anatomische Ausbreitung des Tumors von Bedeutung. Neben der Festlegung des Tumorstadiums nach der Klassifikation der Union Internationale Contre le Cancer (UICC) spielt die Bestimmung der Tumorbiologie anhand morphologischer, molekularpathologischer und immunhistochemischer Parameter eine zunehmende Rolle für individuelle Therapieentscheidungen. Folgende Informationen sollen laut S3-Leitlinien bei einem pathologischanatomischen Befund erhoben werden: histopathologischer Typ (welches Gewebe), Graduierung beim invasiven Karzinom und bei duktalem Karzinom in situ (DCIS), Tumorgröße bei invasivem Karzinom und DCIS, Angaben zur Multifokalität oder Multizentrizität des Tumors, R‑Klassifikation zur Klassifizierung von Resttumorgewebe nach der Behandlung, die peritumorale Lymphgefäßinvasion (L‑Klassifikation), pTNM-Klassifikation, die postoperative histopathologische Ergänzung des TNM-Systems, der Hormonrezeptorstatus (Östrogen und Progesteron) bei invasivem sowie DCIS, und der Human epidermal growth factor receptor 2, (HER2)-Status bei invasivem Karzinom.13′ 16
Im Folgenden werden einige dieser Kriterien näher erläutert. Die Typisierungsrichtlinien sind von der Weltgesundheitsorganisation (WHO) festgelegt und als „International Histological Classification of Tumours“ veröffentlicht.17
Tabelle 1 zur Stadieneinteilung nach UICC ist zum besseren Verständnis eine ausführliche Erläuterung der Bezeichnungen im TNM-System vorangestellt.
Die Stadieneinteilung erfolgt anhand der lokalen Ausdehnung des Tumors, der Beteiligung von benachbarten Lymphknoten und des Vorhandenseins von Metastasen nach dem so genannten TNM-System (Tumor, Nodulus, Metastasen)13:
T: die Ausdehnung des Tumors zum Zeitpunkt der Diagnosestellung oder des Therapiebeginns.
-
- T0: kein Tumor nachweisbar
-
- Tis: Carcinoma in situ, nicht-invasiv
-
- T1mic: Microinvasion bis 0,1cm
-
- T1: Tumor bis 2 cm
-
- T2: Tumor > 2 cm bis 5 cm
-
- T3: Tumor > 5 cm
-
- T4: Tumor jede Größe mit Ausdehnung auf die Brustwand der Haut
N: vom Tumor befallene regionäre Lymphknoten. Beim Brustkrebs zählen dazu die ipsilateralen Lymphknoten in der Achselhöhle oder in oder unterhalb des Schlüsselbeins (infra‑, supraklavikularen). Ipsilateral bedeutet, dass die Lymphknoten auf derselben Körperseite wie der Tumor liegen.
Alle anderen außer den oben genannten Lymphknoten werden als Fernmetastasen klassifiziert (AWMF, 2012; AWMF = Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V.)
-
- N0: keine regionären Lymphknotenmetastasen
-
- N1: Metastasen in beweglichen ipsilateralen Lymphknoten in der Achselhöhle, > 0,2 cm
-
- N2: Metastasen in ipsilateralen Lymphknoten in der Achselhöhle, untereinander oder in
andere Strukturen fixiert oder in klinisch erkennbaren ipsilateralen Lymphknoten entlang der Arteria mammaria interna
-
- N3: Metastase(n) in ipsilateralen infraklavikulären Lymphknoten mit oder ohne Beteiligung
der Lymphknoten in der Achselhöhle entlang der Arteria mammaria interna
M: die Metastasierung
-
- M0: kein Nachweis von Fernmetastasen
-
- M1: Fernmetastasen sind vorhanden
Die TNM-Klassifikation erfolgt unter Verwendung klinisch-radiologischer Daten. „pTNM” steht für pathologisch beziehungsweise histologisch gesicherte Daten und wird mit pathologisch-anatomischen Daten bestimmt. Ein vorangestelltes „y” bei der pTNM-Klassifikation bedeutet, dass vor der Operation bereits eine Bestrahlung oder Chemotherapie stattgefunden hat. Ein nachgestelltes „X” (z. B. TX oder NX) bedeutet, dass keine Beurteilung möglich ist. Bei der pT- und der pN-Klassifikation können zusätzliche Informationen abgebildet werden, wie z. B. die (multiple) Mikroinvasion oder die Basierung der pathologischen Klassifizierung auf einer Sentinel-Lymphknotenuntersuchung.13
Anhand der erhobenen Daten aus der TNM-Klassifikation kann nach Vorgaben der UICC das Stadium einer Krebserkrankung bestimmt werden.9,18 Es gibt fünf verschiedene Stadien mit unterschiedlich vielen Unterstadien (siehe Tabelle 1). Je höher das Stadium, desto schlechter der Gesundheitszustand und desto schlechter die Prognose. In Stadium 0 ist kein Brustkrebs nachweisbar und in Stadium IV sind bereits Metastasen vorhanden und der Krebs ist nach heutigem Wissensstand nicht heilbar.10
Tabelle 1: Stadieneinteilung nach UICC
|
Stadium |
Unterstadium |
Tumor (T) |
Lymphknoten (N) |
Fernmetastasen (M) |
|
Stadium 0 |
Tis |
N0 |
M0 |
|
|
Stadium I |
A |
T1mic*, T1 |
N0 |
M0 |
|
B |
T0, T1mic*, T1 |
N1mi** |
M0 |
|
|
Stadium II |
A |
T0, T1mic*, T1 |
N1 |
M0 |
|
T2 |
N0 |
M0 |
||
|
B |
T2 |
N1 |
M0 |
|
|
T3 |
N0 |
M0 |
||
|
Stadium III |
A |
T0, T1mic*, T1, T2 |
N2 |
M0 |
|
T3 |
N1, N2 |
M0 |
||
|
B |
T4 |
N0, N1, N2 |
M0 |
|
|
C |
Alle T |
N3 |
M0 |
|
|
Stadium IV |
Alle T |
Alle N |
M1 |
* T1mic: Tumor < 1 mm an der Stelle mit der größten Ausprägung.
** N1mi: Micrometastasen (> 0,2 mm und/oder > 200 Zellen, aber keine > 2,0 mm). UICC = Union Internationale Contre le Cancer.
Mithilfe von bildgebenden Verfahren oder anderen präoperativen Diagnostikmöglichkeiten, wie anhand entnommener Gewebeproben, wird zur Bestimmung des Grads der Zelldifferenzierung eine Graduierung durchgeführt. Es gibt drei Gruppen, die den Malignitätsgrad beschreiben: G1 bedeutet der Tumor ist gut differenziert und hat einen geringen Malignitätsgrad, G2 beschreibt einen mäßig differenzierten Tumor mit einem mäßigen Malignitätsgrad und bei G3, der ungünstigsten Bewertung, handelt es sich um einen schlecht differenzierten Tumor mit einem hohen Malignitätsgrad.13
Eine wichtige Information für die Therapieplanung ist auch, ob das Tumorgewebe Rezeptoren für die weiblichen Geschlechtshormone Östrogen (ER+) und Progesteron (PgR+) besitzt und diese Hormone damit das Wachstum des Tumors fördern. In diesem Fall kann der Tumor durch eine Hormontherapie bekämpft werden. Weist der Tumor keine Hormonsensibilität (ER‑, PgR-) auf, ist dies nicht der Fall.13
Ein weiterer Biomarker, der in der Regel bei der histologischen Untersuchung erhoben wird, ist der HER2-Rezeptor-Status. HER2 ist ein Wachstumsfaktor, der das Zellwachstum anregt. Manche Brustkrebszellen besitzen deutlich mehr Rezeptoren für HER2 und werden dadurch zum Wachstum angeregt. Der HER2-Status kann sich im Verlauf der Krankheit ändern. Die Erhebung des HER2-Status ist wichtig dafür, ob eine Therapie mit Anti-HER2-Wirkstoffen infrage kommt.13
Die Häufigkeit eines Rezidivs innerhalb der zehn Jahre nach brusterhaltender Operation und Bestrahlung liegt bei 5 bis 10 %. Der Zeitpunkt des Auftretens des Rezidivs ist ein prognostischer Faktor für den klinischen Verlauf der Erkrankung. Unterschieden wird zwischen frühen (< 2 Jahre) und späten Rezidiven (> 2 Jahre), wobei die frühen Rezidive eine geringere Chance auf Heilung haben und mit einem höheren Risiko für Zweitrezidive und Fernmetastasenverbunde sind.13
Es gibt für die Prognose nach einer brusterhaltenden Therapie oder einer modifiziert radikalen Mastektomie einige Faktoren, die dabei helfen, abzuschätzen, wie hoch die Wahrscheinlichkeit ist, ein lokales Rezidiv zu bekommen und wie die Krankheit danach weiter verlaufen wird. Zu den prognostischen Faktoren für ein Rezidiv gehören die Anzahl der befallenen Lymphknoten, die Tumorgröße (maximaler Durchmesser), das Grading, der Hormonrezeptor‑, der Resektionsstatus (R0;
R1; R2) und die Fokalität (unifokal > multifokal > inflammatorisches Lokalrezidiv). Ist nach der ersten Krebstherapie ein Rezidiv aufgetreten, geben der Resektionsstatus des Lokalrezidivs (R0; R1; R2), die Tumorgröße des Lokalrezidivs, die Lokalisation, die Fokalität, das Grading, der Hormonrezeptorstatus, die Länge des krankheitsfreien Intervalls und der primäre Lymphknotenstatus Aufschluss darüber, wie die Prognose für den Krankheitsverlauf sein wird.9 Der Allgemeinzustand der Patientin ist ebenfalls ein Indikator für den Schweregrad der Erkrankung. Um eine vergleichbare Beurteilung und Dokumentation des Allgemeinzustands und der Funktionsfähigkeit der Patienten zu ermöglichen, werden standardisierte Fragebögen eingesetzt. Für die Fremdbeurteilung der Funktionsfähigkeit durch den behandelnden Arzt werden häufig der Karnofsky Performance Index (KPI) und der Eastern Coöperative Oncology Group (ECOG) Performance Status eingesetzt. Der KPI teilt den Zustand in elf Stadien zwischen null und 100 ein, wobei angenommen wird, dass der Abstand zwischen zwei Stufen einer Veränderung um 10 % entspricht. Beim KPI ist der bestmögliche Zustand 100 % – „normal, keine Beschwerden, keine Krankheitszeichen“ und der schlechteste 0 % – „tot“. Die ECOG-Skala ist gegenläufig und der bestmögliche Zustand „0“ und der schlechteste „5“. In Tabelle 2 werden beide Skalen gegenübergestellt. Für den KPI auf der linken Seite und die ECOG-Skala auf der rechten Seite sind jeweils die Werte und die Definitionen der Skalenwerte abgebildet.
Tabelle 2: Karnofsky Performance Index (KPI) und Eastern Coöperative Oncology Group (ECOG)
Performance Status – Gradeinteilung und Korrelation19, 20
|
Karnofsky Performance Status Scale |
ECOG-WHO-Zubrod Performance Status Scale |
||
|
Beschreibung |
% |
Grad |
Beschreibung |
|
Normal, keine Beschwerden, keine Krankheitszeichen |
100 |
0 |
Normal, Aktivität ohne Einschränkungen wie vor der Erkrankung |
|
Fähig zu normaler Aktivität, geringe Symptome oder Krankheitszeichen |
90 |
1 |
Ambulant, kann sich selbst versorgen, Einschränkungen bei anstrengenden |
|
Normale Aktivität mit einiger Anstrengung möglich, einige Symptome oder Krankheitszeichen |
80 |
körperlichen Aktivitäten, leichte Haus- oder Büroarbeit möglich |
|
|
Sorgt für sich selbst, normale Aktivität nicht möglich, nicht arbeitsfähig |
70 |
2 |
Ambulant, tagsüber mobil in mehr als 50 % der Zeit, kann sich selbst versorgen, nicht |
|
Benötigt gelegentlich fremde Hilfe, kann die meisten persönlichen Angelegenheiten selbst erledigen |
60 |
arbeitsfähig |
|
|
Benötigt oft Hilfe, braucht häufig medizinische Betreuung |
50 |
3 |
> 50 % der Zeit bettlägerig, pflegebedürftig |
|
Behindert, braucht besondere Betreuung und Hilfe |
40 |
||
|
Stark behindert, stationäre Behandlung erforderlich |
30 |
4 |
Bettlägerig, stationäre Behandlung erforderlich |
|
Sehr krank, stationäre Behandlung zur supportiven oder kausalen Therapie dringend erforderlich |
20 |
||
|
Sterbend, tödliche Erkrankung schreitet rasch voran |
10 |
||
|
Tot |
0 |
5 |
Tot |
ECOG = Eastern Coöperative Oncology Group. KPI = Karnofsky-Performance-Index. WHO = Weltgesundheitsorganisation.
Beide Instrumente werden auch in wissenschaftlichen Studien eingesetzt, um neben der Tumorklassifikation den Schweregrad der Erkrankung zu definieren. Die Erhebungsinstrumente können sowohl als Einschlusskriterium, als auch zur Messung des Behandlungseffekts herangezogen werden.21
In diesem Abschnitt wird die konventionelle Therapie von Brustkrebs, insbesondere die Chemotherapie, beschrieben, im darauffolgenden die Toxizität der Chemotherapie, gefolgt von einem Abschnitt zur Messung von HRQOL, einer wesentlichen Zielgröße zur Bewertung der Wirksamkeit und Sicherheit im vorliegenden Bericht. Die begleitende Misteltherapie wird in einem eigenen Kapitel 1.3 beschrieben.
Bei der Auswahl der geeigneten Therapieform und ‑planung steht den behandelnden Ärzten eine Reihe von invasiven und nicht-invasiven diagnostischen Maßnahmen zur Verfügung. Maligne Tumorerkrankungen werden in der konventionellen Brustkrebstherapie meistens mit einer Operation, medikamentöser Therapie und Strahlentherapie behandelt. Bei der chirurgischen Therapie wird unterschieden zwischen der brusterhaltenden Operation und der Mastektomie. Bei der brusterhaltenden Operation wird versucht, den Tumor so weit wie nötig zu entfernen, aber dennoch so viel wie möglich von der Brust zu erhalten. Wenn die Ausdehnung des Tumors diffus und eine komplette Entfernung nicht möglich ist oder bereits im Voraus abzusehen ist, dass die Brust nach Entfernung des Tumors kein für die Patientin akzeptables optisches Bild erreicht, kann es sinnvoll sein, eine Mastektomie, das heißt, eine vollständige Entfernung der Brust, durchzuführen. Diesem Schritt kann eine plastische rekonstruktive Therapie folgen, die jedoch nicht immer möglich oder gewünscht ist. In jedem Fall sollte die Patientin vor dem Eingriff über die Folgen aufgeklärt werden, sowohl zu körperlichen als auch zu psychischen Konsequenzen der Brustentfernung.13
Eine Strahlentherapie ist nach einer brusterhaltenden Operation immer erforderlich. Nur bei bestimmten Gegebenheiten ist davon abzusehen. Wenn eine Strahlentherapie von Beginn an nicht durchführbar ist, wird eine Mastektomie empfohlen. Sie wird nach der Operation unterstützend angewandt, um das Wiederauftreten eines Tumors (Rezidiv) zu vermeiden. Mithilfe von ionisierenden Strahlen wird versucht, die strahlensensiblen Tumoren zu zerstören. Dies kann entweder als Teilbrustbestrahlung oder Bestrahlung der ganzen Brust erfolgen. Nach einer Mastektomie wird die Brustwand bestrahlt. Sind die Achselhöhle und die Region um das Schlüsselbein bereits von Metastasen befallen, ist auch eine Bestrahlung dieser Areale indiziert. Nachweislich kann die Bestrahlung die Entstehung von Metastasen und somit das Risiko für das Fortschreiten der Erkrankung erheblich verringern.13 Die Strahlentherapie kann Nebenwirkungen haben. Kurzzeitige Nebenwirkungen treten während der Therapie und bis zu drei Monaten danach auf und heilen innerhalb von Wochen bis Monaten. Dazu gehören Fatigue, Hautveränderungen, Ödeme, Haarausfall und Schmerzempfindlichkeit. Es können jedoch auch Spätfolgen auftreten.22 Das Risiko für ischämische Herzkrankheiten ist in Abhängigkeit von der erhaltenen Strahlendosis erhöht. So steigt etwa das Risiko einer im Alter von 50 Jahren mit 3 Gray bestrahlten Frau, vor ihrem 80. Lebensjahr an einem Herzinfarkt oder anderem kardialen Ereignis zu versterben, von 1,9 auf 2,4 %, wenn sie keine kardialen Risikofaktoren hat. Mit einem oder mehreren Risikofaktoren steigt das Risiko von 3,4 auf 4,1 %.23 Des Weiteren können strahleninduzierte Krebserkrankungen auftreten.22
In dem Fall, dass der Tumor nicht vollständig mechanisch entfernt werden kann, besteht neben der Mastektomie die Möglichkeit, dass mithilfe einer neoadjuvanten primären systemischen Therapie vor der Operation der Tumor so weit verkleinert und entfernt wird, dass bisher inoperable Tumoren operiert werden können. Wenn die Chemotherapie aufgrund der Tumorbiologie in jedem Fall angezeigt ist, sollte auch eine neoadjuvante Therapie durchgeführt werden. Eine neoadjuvante systemische Therapie ist eine der Operation vorangestellte medikamentöse Therapie, bei der ein Chemotherapeutikum in den Blutkreislauf gebracht wird und somit auf den ganzen Körper einwirken kann. Durch die Wirkung des Medikaments kann der Erfolg der Operation unterstützt werden. Diese unterstützende Therapieform wird auch nach der Operation angewendet.13
Die konventionelle medikamentöse Therapie, oft auch als systemisch adjuvante Therapie bezeichnet, umfasst neben der Chemotherapie auch die endokrine Anti-Hormonbehandlung und die Antikörpertherapie.13, 24 Die Wahl der Therapiemethode ist vor allem abhängig von der TNM-Klassifikation, Gradierung, dem Hormonrezeptor- und HER2-Status, dem Alter und dem Menopausenstatus der Patientin.13, 24
Rezeptorpositive Tumoren sprechen besonders gut auf endokrine Therapien an. Diese können in circa zwei Drittel der Fälle mit einer rein endokrinen Therapie und einer brusterhaltenden Operation mit Bestrahlung behandelt werden. In diesem Fall profitieren die Patientinnen aufgrund der guten Prognose nicht von einer Chemotherapie. Entscheidend ist der menopausale Status für die Wahl des Medikaments. Bei prämenopausalen Patientinnen mit östrogen- und/oder progesteronrezeptorpositiven Tumoren kommt Tamoxifen zum Einsatz und bei sicher postmenopausalen Patientinnen Aromatasehemmer der dritten Generation, mit denen für diese Zielgruppe gegenüber Tamoxifen bessere Erfolge bezüglich des krankheitsfreien Überlebens verzeichnet werden können.13 Bei der Behandlung von postmenopausalen Patientinnen können auch Antiöstrogene oder ÖstrogenrezeptorAntagonisten zum Einsatz kommen, oder steroidale Aromataseinhibitoren können durch nicht-steroidale ersetzt werden.
Rezeptornegative und HER2/neu-positive Tumoren werden mit einer Chemotherapie behandelt. Der detaillierte Aufbau der Chemotherapie wird im folgenden Kapitel näher beschrieben. Eine kombinierte Therapie aus endokriner Therapie und Chemotherapie wird nicht empfohlen aufgrund der hohen Toxizität.13
Als dritte systemische medikamentöse Therapie, neben der endokrinen Therapie und Chemotherapie, gibt es die Antikörpertherapie. Indiziert ist diese Therapieform für Patienten mit einem positiven HER2/neu-Status (HER2/neu 3+ oder FISH positiv). In der Therapie des metastasierten Mammakarzinoms sind die häufigsten Medikamente in der Antikörpertherapie Trastuzumab mit Bevacizumab oder mit zwei- oder mehrfachen Thyrosinkinasehemmern wie z. B. Lapatinib.24–26 Adjuvante Therapien bedürfen bei jeder Patientin einer individuellen Abwägung von Nutzen und Nebenwirkungen.13
Liegt ein maligner metastasierter Tumor vor und ergibt sich aus den prognostischen Faktoren, dass die Krankheit lebensbedrohlich ist, dann werden palliativmedizinische Maßnahmen eingeleitet.17 Die WHO definiert Palliativmedizin als einen Ansatz zur Verbesserung der Lebensqualität von Patienten und ihren Familien, die mit Problemen konfrontiert sind, die mit einer lebensbedrohlichen Erkrankung verbunden sind. In den Bereich der Palliativmedizin fällt auch die Vorbeugung und Linderung von Leiden durch frühzeitige Erkennung, sorgfältige Einschätzung und Behandlung von Schmerzen und anderen Problemen körperlicher, psychosozialer und spiritueller Art.27
Palliativmedizinische Maßnahmen haben in der leitlinienkonformen Behandlung einen festen Platz. Im Fokus steht dabei die Lebensqualität der Patientin, die regelmäßig durch deren Selbsteinschätzung, beispielsweise mithilfe eines Fragebogens, überprüft wird. Alle Betroffenen sollen frühzeitig über Möglichkeiten der Betreuung und Unterstützung informiert werden, ebenso zu relevanten Themen wie dem Erstellen einer Vorsorgevollmacht. Das Behandlungskonzept orientiert sich am Willen und den Wünschen der Patientin sowie eventueller Vertrauenspersonen. Palliativmedizinische Behandlung erfolgt zusätzlich zu krankheitsmodifizierenden Therapien, die in erster Linie eine Verlängerung der Lebenszeit erreichen wollen oder auch zusätzlich zu Behandlungen, die die Nebenwirkungen der Therapien mildern oder ihnen vorbeugen wollen. Es gilt vor allem, einen Zustand mit möglichst hoher Lebensqualität zu erreichen. Die palliative Behandlung ersetzt die kurative Therapie nicht, sondern ergänzt diese.9
Eine Verbesserung der Lebensqualität kann durch die Verminderung der durch die Chemo- oder Strahlentherapie verursachten Nebenwirkungen und der Linderung von Schmerzen in Verbindung mit einer angepassten psychologischen Betreuung erreicht werden. Bei Patientinnen mit Brustkrebs in fortgeschrittenem Stadium sind Luftnot und Schmerzen häufige Belastungen, die es, beispielsweise durch eine Opioidtherapie zu behandeln gilt.9
Auch bei einer erfolgreichen kurativen Therapie besteht bei jeder Krebserkrankung die Möglichkeit eines Rezidivs, das auch noch nach Jahren auftreten kann. Daher umfasst die Therapie auch die Nachsorge und Kontrolluntersuchungen in den Jahren nach der Erkrankung.
Zum Gesamtkonzept der Krebstherapie nach der Leitlinie gehört insbesondere auch die psychoonkologische Betreuung der Patientinnen.9 Patientinnen sowie deren Angehörige sollen in einer verständlichen Ausdrucksweise mit patientengerecht aufbereiteten Informationen zu Hilfsangeboten beraten werden.9 Die Verwendung validierter Messinstrumente zur individuellen Bedarfsfeststellung kann von Vorteil sein.
Die Chemotherapie ist eine Therapieform, bei der maligne Tumoren mithilfe von chemischen Substanzen bekämpft werden.28 Als Chemotherapeutika beziehungsweise Zytostatika sind natürlich vorkommende oder synthetisch hergestellte niedermolekulare Substanzen zu verstehen, die durch eine Blockade des Stoffwechsels eine (weitgehend) selektiv schädigende Wirkung auf Krankheitserreger oder Tumorzellen haben.29 Die chemischen Substanzen schädigen die DNA einer (Tumor-)Zelle während der Nukleinsäuresynthese und hemmen dadurch vor allem eine Vermehrung schnell wachsender Zellen.30 Derzeit werden vor allem Substanzen eingesetzt, die in die Signalübertragungswege eingreifen, die Wachstumsrezeptoren am Zellkern blockieren oder die bestimmte Schwachstellen einzelner Krebszelltypen ausnutzen und dort angreifen können. Die Zytostatika können dabei nicht zwischen Tumorzellen oder gesunden Zellen unterscheiden. Dennoch werden aufgrund der schnelleren Zellteilungsrate von Tumorzellen vermehrt diese Zellen getroffen.28 Die Zellteilungsrate ist entscheidend bei der Wirkweise von Zytostatika, weil viele Substanzen die Erbsubstanz einer Zelle angreifen, die vor allem im Zellteilungsprozess zugänglich ist.
Aufgrund der schmalen therapeutischen Breite der zytotoxischen Medikamente ist vor Beginn einer Therapie abzuwägen, ob der erwartete Nutzen das Risiko übersteigt und ob das gewünschte Ziel durch die gewählte Therapieform überhaupt erreicht werden kann. Theoretisch möglich sind die kurative Chemotherapie (ohne Operation), die adjuvante, die neoadjuvante, die palliative oder die prophylaktische Therapie. Eine kurative Chemotherapie ohne Operation ist in der Behandlungsleitlinie nicht empfohlen. Voraussetzung dafür ist ein guter Allgemeinzustand der Patientin, da hier vor allem Herz, Nieren und Leber einer besonders hohen Belastung ausgesetzt sind.13, 31 Empfohlen sind die neoadjuvante und die adjuvante Chemotherapie vor beziehungsweise nach der Operation, wie im vorherigen Kapitel beschrieben. Auch in der palliativen Therapie kann in manchen Fällen eine Chemotherapie zur Bekämpfung von Symptomen sinnvoll sein, wie bei Schmerzen durch die Raumforderung eines schnell wachsenden Tumors.31 Eine prophylaktische Therapie kann bei Patientinnen durchgeführt werden, die gesund sind, aber aufgrund ihrer Gene ein erhöhtes Risiko für Brustkrebs haben oder bei Patientinnen, die bereits Brustkrebs hatten und vermeiden wollen, dass sie erneut eine Diagnose für Brustkrebs oder andere gynäkologische Krebsarten erhalten. Eine prophylaktische Therapie besteht entweder aus einer intensivierten Früherkennung, aus prophylaktischen Operationen, wie der Mastektomie oder einer Entfernung der Eileiter, oder aus einer präventiven Medikamentengabe. Die aktuelle Evidenzlage lässt keine klare Empfehlung zu, ob präventive Operationen durchgeführt werden sollten oder nicht, die Abwägung zum Nutzen und Risiko ist im Einzelfall mit der Patientin abzustimmen. Auch eine prophylaktische Gabe von Tamoxifen wäre möglich, aber auch hierbei ist bisher kein medizinischer Nutzen nachgewiesen.9
Zytostatika werden, je nach Wirkprinzip, in verschiedene Gruppen eingeteilt. Jede Gruppe versucht, die Zellteilung auf andere Weise zum Stillstand zu bringen und greift die Zelle in unterschiedlichen Stadien des Zellzyklus‘ an.
Alkylanzien gehen mit der DNA des Zellkerns eine Verbindung ein und verbinden dessen Stränge oder bringen diese zum Zerbrechen, sodass keine Erbinformation weitergegeben werden kann (Beispiel: Cyclophosphamid).28
Antimetabolite unterbrechen eine normale Zellteilung, indem sie sich durch ihre Ähnlichkeit zu körpereigenen Substanzen in Stoffwechselprozesse einbauen lassen und diese dadurch blockieren (Beispiel.: Methotrexat, 5‑Fluorouracil, Gemcitabin und Capecitabin).28
Anthrazykline greifen direkt im Zellkern an und verhindern durch die Modifizierung der Zellmembran und die Zerstörung der Erbsubstanz die Synthese von DNA und RNA. Diese Wirkung und die damit verbundenen Nebenwirkungen sind kontinuierlich und unabhängig vom Zellteilungszyklus (Beispiel: Doxorubicin – oft mit dem Markennamen Adriamycin® bezeichnet – und Epirubicin).28
Taxane greifen an den Mikrotubuli an. Diese sorgen in der Zellteilung für die Verteilung der Erbinformation auf die neuen Tochterzellen. Die Taxane stoppen diese Verteilung indem die Fäden dieser Mikrotubuli versteift werden (Beispiel: Paclitaxel und Docetaxel).28
Vincaalkaloide (auch Spindelgifte oder Tubulinhemmer genannt) sind pflanzliche Chemotherapeutika, die ebenfalls an den Mikrotubuli angreifen und die Zellteilung blockieren (Beispiel: Vinblastin und Vincristin).28
Die Zytostatika werden in Zyklen verabreicht. In Form von Infusionen, Tabletten oder Spritzen werden die Substanzen an einem oder an mehreren Tagen pro Zyklus zugeführt und wirken auf den gesamten Organismus. Auf diese Weise können auch unentdeckte Metastasen behandelt werden. Derzeit sind über 50 Zytostatika zugelassen, die die Zelle in verschiedenen Phasen des Zellteilungszyklus’ angreifen.28 Die Substanzen werden entweder als Polytherapie oder als Monotherapie verabreicht. In der Monotherapie wird nur ein Wirkstoff verabreicht, in der Polytherapie mehrere Wirkstoffe gleichzeitig. Zur Auswahl stehen: Anthrazykline, Alkylanzien, Anthrachinone, Taxane, Vinorelbin, Fluorpyrimide, Platinkomplexe und Halichondrin.9
Tumorzellen können gegenüber einzelnen Chemotherapeutika auch eine Resistenz entwickeln. Durch die Kombination von Substanzen (Polytherapie), die in verschiedenen Phasen des Zellteilungszyklus angreifen, kann einerseits die Resistenz gegenüber einer Substanz umgangen und andererseits die zerstörende Wirkung auf die Krebszellen verstärkt werden. Allerdings sind von der zerstörerischen Wirkung auch alle anderen Zellen betroffen und die Toxizität der Therapie steigt. Damit verbunden ist eine höhere Belastung der Patientin durch stärkere Nebenwirkungen. Unabhängig von der Wahl der Substanzen muss zwingend eine regelmäßige Kontrolle des Therapieerfolgs und der Toxizität durch den behandelnden Arzt erfolgen. Bei einer nicht tolerablen Toxizität muss die Therapie abgebrochen werden.13 Eine typische Polytherapie, die bei Patientinnen mit Brustkrebs verwendet wird, ist beispielsweise das CMF-Schema (CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil.). Die Chemotherapie nach CMF-Schema ist eine Polychemotherapie, bei der die drei zytostatischen Wirkstoffe Cyclophosphamid, Methotrexat und 5‑Fluorouracil kombiniert werden.28, 32
Eine weitere Option sind zielgerichtete Therapien (targeted therapies). Diese blockieren mit monoklonalen Antikörpern bestimmte Zellrezeptoren, die Signale für ein Zellwachstum auslösen können. Monoklonale Antikörper können durch die Bindung an den Zellrezeptor auch eine verstärkte Immunreaktion auslösen, die ebenfalls der Tumorbekämpfung dient.33 Beispiele hierfür sind die Anti-HER2-Therapie oder die Hemmung der VEGF-Rezeptoren, die das Endothelwachstum beeinflussen (Endothelwachstumsfaktor engl.: Vascular Endothelial Growth Factor). Eine Anti-HER2-Therapie besteht entweder aus einer Kombination aus Trastuzumab und einer sequentiellen anthrazyklin-taxan-haltigen Chemotherapie oder aus einer der anthrazyklinfreien Optionen mit Carboplatin-Docetaxel oder Docetaxel-Cyclophosphamid.9 Zielgerichtete Therapien durch Signalinterzeptoren sind kein Ersatz für zytotoxische Substanzen, sondern sie werden miteinander kombiniert.9, 34
Eine ausführliche Zusammenstellung der am häufigsten in der Chemotherapie von Brustkrebs eingesetzten Medikamente ist im folgenden Abschnitt in Tabelle 3 „n der Mammakarzinom-Therapie eingesetzte Zytostatika und ihre Toxizität” zu finden. Trastuzumab, Pertuzumab und Cetuximab, sind nicht in der Tabelle aufgeführt, da es sich nicht um Chemotherapeutika handelt, sondern um die gezielte Krebstherapie, die an einzelnen Wirkmechanismen wie Wachstumsfaktoren ansetzen. Trastuzumab hat eine gewisse Sonderstellung, da es auch in anderen systemischen Therapien verwendet wird.25, 35
Unsere Darstellung der Behandlung bei Brustkrebs basiert auf der AWMF-Leitlinie von 2017. Mittlerweile wurde diese Leitlinie aktualisiert.36 Um aktuelle Informationen über die Behandlung zu erhalten, bitten wir Leser und Leserinnen die jeweils aktuellen evidenzbasierten Leitlinien der AWMF zu konsultieren.
Die Toxizität der in der Chemotherapie verwendeten Substanzen ist ein wichtiger Faktor, denn der Wirkmechanismus der Therapie basiert auf der Zerstörung der kanzerogenen Zellen. Gleichzeitig werden immer auch nicht befallene Zellen im Körper zerstört. Besonders anfällig sind Zellen, die sich, ähnlich wie Krebszellen, häufig teilen (z. B. Schleimhäute, Haare, Knochenmark). Ist die Toxizität zu hoch, kann die Chemotherapie dauerhaft schädigend für den Körper sein und pathologische Veränderungen in allen Organsystemen hervorrufen.31
Vor einer Chemotherapie sind Patientinnen über die Folgen zu unterrichten. Für die verschiedenen Substanzen kann anhand der Daten aus Studien abgeschätzt werden, welche Organe von Spätschäden betroffen sein können. Cisplatin kann beispielsweise einen Hochtonschaden am Gehör verursachen und sollte bei Personen, die ihren Lebensunterhalt als Musiker oder Tontechniker verdienen, vermieden werden.31 Der Therapieerfolg ist wahrscheinlicher, wenn die Beurteilung der Toxizität bereits vor Beginn der Chemotherapie erfolgt und abgewägt wird, ob der körperliche Zustand der Patientin die Kompensation der Nebenwirkungen zulässt. Therapieabbrüche erfolgen vor allem als Folge der hohen Belastung durch die Nebenwirkungen. Faktoren, die das Auftreten und den Schweregrad der Toxizität der Zytostatika beeinflussen, sind die Wirkstoffe, die Dosis (mg/m2 oder mg/m2 pro Woche), die Applikationsform und der Allgemeinzustand der Patientin. Jede Patientin besitzt eine individuelle Verträglichkeit, die auch durch einen genetisch bedingten Enzympolymorphismus (Vielgestaltigkeit der Enzyme) bedingt sein kann. Tabelle 3 beschreibt die möglichen toxischen Effekte der verschiedenen Gruppen von Zytostatika im Einzelnen.
Tabelle 3: In der Mammakarzinom-Therapie eingesetzte Zytostatika und ihre Toxizität (Eigene Darstellung nach7, 24, 37)
|
Wirkstoffgruppe |
Wirkstoffe |
Mögliche sofortige oder frühe Toxizität (Stunden bis Tage nach der Applikation)* |
Mögliche verzögerte oder späte Toxizität (Wochen bis Monate nach der Applikation)* |
|
Alkylanzien |
Cyclophosphamid Ifosfamid Trofosfamid Melphalan Miltefosin Thiotepa Mitomycin C Bendamustin |
Übelkeit, Erbrechen, Durchfall, Krampfanfälle, _ anaphylaktische Überempfindlichkeit, Flush, -Tachykardie, Schweißausbruch, Blutdruckabfall |
Nekrosen der Nieren und ableitenden Harnwege, Knochenmarksschäden mit Granolozytopenie, Lymphozytopenie, Thrombozytopenie und gelegentlich Anämie, Alopezie (Haarausfall), Lungeninfiltrate, allergische Reaktionen, sekundäre Leukämie und solide Tumoren, Sterilität, Leberschäden |
|
Antimetaboliten |
5‑Fluoracil (5‑FU) Capecitabin Methotrexat Gemcitabin |
Übelkeit, Erbrechen, Durchfall, Fieber, .Anaphylaxie, Müdigkeit, grippeähnliche Symptome |
Ulcerationen im Mund und Magen-Darm-Bereich, Knochenmarkhemmung mit Leukopenie, Thrombopenie und Anämie, Leberschäden, Nierenschäden, Alveolitis, Dermatitis, Haarausfall, toxische Hautreaktionen, Enzophalopathie, Unfruchtbarkeit, Neutropenie, Angina Pectoris, Herzinsuffizienz |
|
Interkalanzien |
Epirubicin Doxorubicin liposomales Doxorubicin pegyliertes liposomales Doxorubicin Mitocantron Daunorubicin (liposomal) |
Übelkeit, Erbrechen, Durchfall, Hautausschlag, .Appetitlosigkeit, Müdigkeit, Allergie |
Kardiomyopathie, Knochenmarksdepression, Anämie, Haarausfall, Thrombozytopenie, Neutropenie |
|
Topoisomerase-Hemmer |
Topotecan Etoposid (VP-16) |
Erbrechen, Übelkeit, Verstopfung, Durchfall, Appetitlosigkeit, Überempfindlichkeitsreaktionen (mit Schüttelfrost, Fieber, Herzrasen, Bronchialkrämpfen, Atemnot, Blutdruckabfall) |
Anämie, Thrombozytopenie, Neutropenie, Mundschleimhautentzündung, Speiseröhrenentzündung, Haarausfall, Fatigue, Leberfunktionsstörungen, Knochenmarksdepression |
|
Tabelle 3 – Fortsetzung |
|||
|
Spindelgifte |
Vindesin Vinblastin Vinorelbin Vincristin Paclitaxel Docetaxel |
Übelkeit, Erbrechen, Durchfall, Fieber, _______Blutdruckabfall, Anaphylaxie, Bronchospasmus, ——Hautreaktionen |
Knochenmarkhemmung mit Granolozytopenie, Thrombozytopenie, Anämie, Mukositis, Leukämie, Leberschäden, Muskelschmerz, Stomatitis, Haarausfall, Schädigung der Gonaden, Neuropathie |
|
SchwermetallKomplexe |
Carboplatin Cisplatin |
Übelkeit, Erbrechen, Anaphylaxie |
Hörverlust, Knochenmarkhemmung, Neurotoxizität |
*Mögliche Nebenwirkungen aller Präparate innerhalb der Wirkstoffgruppe; kein Anspruch auf Vollständigkeit.
Wie in Tabelle 3 aufgelistet, können die unerwünschten Nebeneffekte der Chemotherapie den gesamten Organismus physisch und psychisch negativ beeinflussen, sowohl in einzelnen Regionen des Körpers als auch den Allgemeinzustand der Patientin. Bei den unerwünschten Arzneimittelwirkungen (UAW) wird nach dem zeitlichen Auftreten der Symptome unterschieden zwischen frühen Reaktionen, späten Reaktionen und Reaktionen, die während der Therapie durch die Toxizität der Zytostatika entstehen.
Frühreaktionen treten unmittelbar oder in den folgenden Tagen auf. Die häufigsten Frühreaktionen sind Erbrechen, Fieber und allergie-ähnliche Reaktionen. Bei manchen Substanzen wie Cisplatin oder Cyclophosphamid kommt es bei über 90 %der Patienten nach der Gabe zu Erbrechen. Bei anderen Präparaten wie Taxanen oder 5‑Fluoruracil liegt der Anteil der Patienten mit Brechreiz unter 30 %. Es gibt sowohl den frühen Brechreiz am Tag der Therapie als auch den späten Brechreiz in den nachfolgenden Tagen. Dieser Nebenwirkung kann und muss durch die Kombination mit anderen Medikamenten entgegengewirkt werden, um eine Konditionierung des Körpers, auf die Gabe des Zytostatikums mit Erbrechen zu reagieren, zu verhindern.31
Fieber wird durch Zytokine hervorgerufen, die durch zytotoxische Substanzen freigesetzt werden. Manche Zytokine sind an Prozessen der Immunabwehr beteiligt und führen zur Erhöhung der Körpertemperatur oder einer allergie-ähnlichen Reaktion. Taxane bewirken ebenfalls eine ausgeprägte allergie-ähnliche Reaktion. Deshalb sollten diese mit Glucocorticoiden und H1- und H2-Antagonisten kombiniert werden. Allergische Reaktionen treten vor allem bei monoklonalen Antikörpern auf.31
Spätreaktionen sind vor allem bedingt durch die Hemmung der DNA-Synthese (Proliferationshemmung) und den Zellzerfall. Davon sind Zellen betroffen, die sich häufig teilen und schnell wachsen, wie Schleimhäute im ganzen Körper (Dickdarm, Mund, Anal- und Rektalbereich, Haare, Vaginalbereich und Knochenmark). Die angegriffene Schleimhaut in Mund, Darm und Anal- und Rektalbereich führt neben einem hohen Infektionsrisiko und leichter Reizbarkeit zu Durchfällen. Im Vaginalbereich kann es zu Geschwüren kommen. Zudem wird der Eisprung gehemmt, jedoch ist die Verhütung trotzdem empfohlen, da zytotoxische Substanzen bei Embryonen zu Fehlbildungen führen können.31
Alle zytotoxischen Substanzen und einige der Kinasehemmer bewirken eine Knochenmarksdepression. Damit ist ein hohes Infektions- und Blutungsrisiko verbunden. Die Knochenmarksdepression hat erheblichen Einfluss auf blutbildende Prozesse. Erschöpfungszustände, die durch eine Blutarmut hervorgerufen werden, könnten durch zusätzliches Erythropoetin kompensiert werden, jedoch kann dies auch das Tumorwachstum unterstützen.31 Die Dosis für den Folgezyklus orientiert sich an der Regenerationsfähigkeit der Patientin.
Nach der Chemotherapie können auch Sekundärtumoren auftreten. Das kommt vor allem beim myelodisplastischen Syndrom und der myeloischen Leukämie vor. Das myelodisplastische Syndrom ist eine erworbene Erkrankung des Knochenmarks, die verbunden ist mit einer gestörten Blutbildung. Die myeloische Leukämie ist eine akut oder chronisch auftretende Erkrankung, bei der ein Tumor das Knochenmark befällt und die Zahl der Blutzellen zurückdrängt.38 Das Auftreten von Lymphomen, Sarkomen und anderen Tumorarten kann ebenfalls durch die Chemotherapie unterstützt werden.31
Chemotherapien stellen immer eine starke Belastung für die Organe dar. Stark betroffen sind die Nieren, die ableitenden Harnwege, die Leber, das Herz, die Lunge und die Haut. Die jeweiligen Ausprägungen werden in den folgenden Absätzen nach Organ getrennt beschrieben.
Saurer Harn kann beispielsweise die Folge von Methotrexat sein. Vincrisin und Vinblastin dagegen können zur hypotonen Hyperhydratation führen, die ein Hirnödem auslösen kann. Damit verbunden sind Übelkeit, Benommenheit und ein langsamer Puls. Um die Entgiftungsorgane zu unterstützen und Schäden durch eine zu hohe toxische Belastung zu verhindern, ist auf eine ausreichende Flüssigkeitszufuhr zu achten (drei Liter am Tag).31
Das Herz erfährt zum einen eine Mehrbelastung durch die großen Infusionsmengen und zum anderen können Zytostatika Funktionsstörungen auslösen. Für Kinase-Inhibitoren wie Trastuzumab, Bevazincumab, Lapatinib oder Sunitib ist beispielsweise eine Herzinsuffizienz nicht untypisch. Cyclophosphamid oder Ifosphamid können bei einer hohen Dosis eine Herzmuskelentzündung hervorrufen.31
Lungenfibrosen und Entzündungen der Lunge (Pneumonitis) kommen bei den für die Behandlung von Brustkrebs verwendeten Zytostatika eher selten vor. Pulmonalergüsse sind möglich.31
Die Leber ist besonders anfällig für eine Leberfibrose bei konstanter, wenn auch niedrig dosierter Gabe. Eine Thrombose der Lebervenen ereignet sich eher bei hochdosierter Gabe von Alkylanzien und Carboplatin.31
Schwermetallkomplexe und Taxane können das Nervensystem beeinträchtigen und Neuropathien auslösen. Cisplatin, ein Schwermetallkomplex, kann einen Hochtonschaden verursachen. 5‑Fluorouracil kann Auslöser sein für Störungen der Bewegungskoordination. Zwar wurde der Zusammenhang noch nicht geklärt, aber bei manchen Patienten wurde eine Abnahme der Gedächtnisleistung, Konzentration und Fähigkeiten im Bereich der sprachlichen und intellektuellen Begabung als Folge der Chemotherapie festgestellt.31
Juckende Hautausschläge, Entzündungen und Überpigmentierung kann eine Nebenwirkung von 5‑Fluoracil sein. Ebenso möglich ist ein Hand-Fuß-Syndrom. Symptome des Hand-Fuß-Syndroms sind Schwellungen und schmerzhafte Rötungen an Handflächen und Fußsohlen.31, 39
Die jeweilige Behandlungsempfehlung zur Minderung der spezifischen Nebenwirkungen eines Präparats muss individuell angepasst werden.
Unterstützende Therapieformen haben zum Ziel, diese UAW der Chemotherapie zu behandeln oder ihnen vorzubeugen. Elemente einer unterstützenden Therapie sind Blutprodukte, blutbildende Wachstumsfaktoren, antimikrobielle Prophylaxe, Breitspektrumantibiotika, eine die Übelkeit reduzierende Therapie, die Behandlung von toxischen Wirkungen auf das Organsystem oder eine Ernährungsanpassung. Auch die Misteltherapie zielt auf die Verminderung der Nebenwirkungen ab.
Um die Effekte der Behandlung bei Brustkrebs zu erfassen, stellt die HRQOL des Patienten eine wichtige subjektive Zielgröße dar. Es gibt generische und krankheitsspezifische Messinstrumente. Neben physischen Symptomen erleben Patienten auch psychosoziale Belastungen durch Krankheit und Therapie, die durch standardisierte Messinstrumente der HRQOL erfasst werden sollen. Dementsprechend weisen HRQOL-Messinstrumente in der Regel eine physische, psychische und soziale Dimension auf, die versuchen, die HRQOL über die körperliche Funktionalität, das psychische Wohlbefinden und die soziale Unterstützung zu erheben.40, 41 Einige Instrumente haben eine vierte, spirituelle Dimension, die Aspekte wie Religiosität, Bedeutung der Erkrankung, Transzendenz, innere Stärke und Hoffnung enthält.42 Anders als KPI und ECOG erfolgt in diesen Fragebögen die Beurteilung der Lebensqualität durch den Patienten selbst, sodass Diskrepanzen, wie sie durch die Beurteilung Dritter auftreten, vermieden werden.41 Das führt aber auch zu einer Beeinflussung der Ergebnisse durch das jeweils subjektive Empfinden der Lebensqualität durch die Patientin. Es gibt eine Vielzahl unterschiedlicher krebs- und brustkrebsspezifischer Messinstrumente. Brustkrebs ist eine komplexe Erkrankung mit einer hohen Diversität der Patientinnen. Die Herausforderung ist, einen Lebensqualitätsfragebogen auszuwählen, der alle bedeutsamen Veränderungen durch die Therapie in allen Stadien sensitiv genug erfasst, ohne gleichzeitig den Umfang des Fragebogens untauglich für die Praxis zu machen.40 Dementsprechend ist die Auswahl geeigneter Messinstrumente für die jeweilige Fragestellung wichtig.
Validität, Reliabilität und Sensitivität der Messung sind Gütekriterien für ein Messinstrument und beschreiben die Qualität eines Fragebogens. Die Validität gibt an, ob der Fragebogen die Eigenschaften misst, die er messen soll. Sie wird häufig gemessen, indem der Fragebogen mit einem als „Goldstandard” dienenden Fragebogen verglichen und die Korrelation gemessen wird. Allerdings steht nicht immer ein Goldstandard zur Verfügung. Die Reliabilität meint die Konsistenz oder Wiederholbarkeit der Messung unter gleichen Bedingungen. Sie wird häufig durch den Vergleich wiederholter Messungen bestimmt und als Korrelationskoeffizient angegeben. Es kann auch die interne Konsistenz gemessen werden, die angibt, ob die einzelnen Items im Fragebogen letztlich das Gleiche messen. Dies wird durch eine statistische Maßzahl, Cronbachs a, gemessen, die aus den paarweisen Korrelationen zwischen den einzelnen Items gebildet wird. Mit der Sensitivität des Fragebogens ist gemeint, dass sich klinisch wichtige Veränderungen im zeitlichen Verlauf im Messergebnis widerspiegeln.43 Gezeigt werden kann die Sensitivität über einen Vergleich mit bekannten Instrumenten oder im Vergleich mit zusätzlichen Fragen an die Patienten, die gezielt den Übergangszustand messen.44 Neben der Reliabilität, der Validität und der Sensitivität gegenüber relevanten Veränderungen der Lebensqualität aufgrund der Behandlung, ist auch die Anwendbarkeit im Klinik- beziehungsweise Praxisalltag ein Gütekriterium für einen Fragebogen.45,46 Im Falle eines länderübergreifenden Einsatzes des Fragebogens ist auf eine richtige und für die Patienten verständliche Übersetzung zu achten.40
Eine aktuelle systematische Übersichtsarbeit (SR) über SR zu HRQOL bei Patientinnen mit Brustkrebs von Mokhatri-Hesari et al. (2020)47 identifizierte 17 SR zu HRQOL-Messinstrumenten für Patientinnen mit Brustkrebs im Zeitraum zwischen 2008 und 2018. Ein SR von Ghislain et al. (2016)48 untersuchte den Einsatz von HRQOL-Messinstrumenten in randomisierten klinischen Studien zur Behandlung von Brustkrebs zwischen 2001 und 2014. Die am häufigsten verwendeten Fragebögen waren der „European Organisation for Research and Treatment of Cancer Quality of Life Core Questionnaire 30-item“ (EORTC-QLQ-C30) in 46 %, der „Functional Assessment of Cancer Therapy Questionnaire for Breast Cancer” (FACT‑B) in 40 %, die „Rotterdam Symptom Checklist“ in 8 % und der „EuroQoL Five Dimension Scale“ in 4 % der insgesamt 49 identifizierten Studien. Die psychometrischen Eigenschaften der verwendeten Fragebögen wurden in 37 der eingeschlossenen Studien angegeben, jedoch wurden sie auch in den übrigen Studien als ausreichend bewertet.48
Komplementäre Therapieansätze, die den gleichen evidenzbasierten Grundsätzen unterliegen wie die Schulmedizin, werden in der konventionellen Medizin nicht kategorisch ausgeschlossen. Die komplementäre Therapie unterstützt die konventionelle Behandlung und ersetzt diese nicht. Seit einiger Zeit wird auch der Begriff integrative Medizin verwendet. Witt et al. (2017)49 geben basierend auf einem Expertenkonsens folgende Definition einer integrativen Onkologie: “Integrative oncology is a patient-centered, evidence-informed field of cancer care that utilizes mind and body practices, natural products, and/or lifestyle modifications from different traditions alongside conventional cancer treatments. Integrative oncology aims to optimize health, quality of life, and clinical outcomes across the cancer care continuüm and to empower people to prevent cancer and become active participants before, during, and beyond cancer treatment.” [„Integrative Onkologie ist ein patientenzentrierter, evidenzbasierter Bereich der Krebsbehandlung, der neben konventionellen Krebstherapien auch geistige und körperliche Praktiken, Naturprodukte und/oder Lebensstilmodifikationen aus verschiedenen Traditionen einsetzt. Die integrative Onkologie zielt darauf ab, die Gesundheit, die Lebensqualität und die klinischen Ergebnisse über das gesamte Kontinuum der Krebsbehandlung zu optimieren und die Menschen zu befähigen, Krebs vorzubeugen und aktive Teilnehmer vor, während und nach der Krebsbehandlung zu werden.”]
In der S3-Leitlinie zur Behandlung von Brustkrebs ist festgehalten, dass Ärzte ihre Patientinnen auch zu komplementären Therapiemethoden beraten sollen, um die Selbstverantwortung der Patientinnen zu stärken, sie vor möglichen unseriösen Angeboten und Wechsel- oder Nebenwirkungen verschiedener Präparate zu schützen. Zudem sollen Betroffene zur Eigeninitiative motiviert werden. Alternative Therapiekonzepte, die eine konventionelle Behandlung ersetzen, werden jedoch nicht unterstützt.9, 13 Die AWMF hat im November 2020 eine Konsultationsfassung einer S3-Leitlinie „Komplementärmedizin in der Behandlung von onkologischen Patientinnen“ veröffentlicht. In dieser Leitlinie „sollen die wichtigsten zur komplementären und alternativen Medizin zählenden Methoden, Verfahren und Substanzen, die aktuell in Deutschland von Patienten genutzt werden beziehungsweise ihnen angeboten werden, nach den Kriterien der evidenzbasierten Medizin bewertet werden.“50 Darunter auch die Misteltherapie. Die Leitlinie ist als Querschnittsleitlinie konzipiert, für genauere Informationen zu einzelnen Krebsarten wird auf die organspezifischen Leitlinien verwiesen.
Im vorliegenden Bericht wird die zusätzliche Gabe von in Deutschland zugelassenen Mistelextrakten bei der Behandlung von Brustkrebs zusätzlich zur Standardtherapie untersucht. Der Mistel werden schon seit über 2000 Jahren heilende Kräfte nachgesagt. Die älteste schriftliche Überlieferung für die Verwendung der Mistel als Heilpflanze stammt von Hippokrates (460 bis 373 vor Christi) und auch bei Hildegard von Bingen (1098 bis 1179) wird die Mistel genannt. Die im europäischen Kulturkreis behandelten Indikationen und Zwecke waren vielseitig. Von Migräne, Blutungen, Gicht, Arthrose, Fieber, Wundschmerz, Dermatosen, Epilepsie bis hin zu Wurmbefall reichten die Einsatzgebiete von Misteln. In der Krebstherapie eingeführt wurde Viscum album 1920 von Rudolf Steiner, dem Begründer der Anthroposophie und der anthroposophischen Medizin, die die galenische Medizin und die Homöopathie vereint.7, 51
Eingruppiert werden Misteln in die Pflanzengattung Viscum der Familie der Mistelgewächse, Loranthaceae.52 Die weißbeerige Mistel, Viscum album L, stammt aus Asien und Europa und wird auch als europäische Mistel bezeichnet. Sie ist ein immergrüner Halbschmarotzer mit ledrigen, gelb-grünen Blättern und weißlichen Scheinbeeren. Die Photosynthese erfolgt selbstständig durch die Mistel, aber Wasser und Mineralien werden dem Wirtsbaum entnommen. Unterschieden wird, je nach Wirtsbaum, zwischen drei Unterarten: eine Art wächst ausschließlich auf Laubbäumen, die zweite auf Kiefern und Lärchen und die dritte nur auf Tannen.51
Als Arzneipflanze können das Kraut (Visci albi herba) – in getrockneter Form oder frisch – oder die Blätter (Visci folium) verwendet werden.51 Als „Kraut“ werden jüngere Zweige mit Blättern und Blüten bezeichnet, vereinzelt auch mit Früchten.53

Gemeine Mistel, Viacom aibutn.
Abbildung 1: Mistelpflanze54
A: Blüte, b: Blätter, c: Stiel; d: Beere; e: Staubbeutel; f: Fruchtknoten55
Die pharmakologisch aktiven Substanzen mit der höchsten Konzentration an Viscum album (je 0,1 %) sind Lektine und Viscotoxine. Mistellektine (Ml I bis III) sind Glykoproteine, die die Fähigkeit besitzen, mit spezifischen Zuckermolekülen Bindungen eingehen zu können. Die Viscotoxine A, B und P bestehen aus je 46 Aminosäuren. In geringerer Konzentration sind Flavonoide, Kaffeesäurederivate, Phenylpropane, Polysaccharide und Schleimstoffe enthalten. Sekundärstoffe können die Wirkung nachweislich beeinflussen.51
Mistelextrakte werden aus definierten Pflanzenteilen, zum Beispiel Blattsprossen und Mistelbeeren, in wässriger Lösung fermentiert (Zusatz von Milchsäurebakterien) oder unfermentiert gewonnen. Die Extrakte werden entweder nach homöopathischen, anthroposophischen oder phyotherapeutischen Verfahren hergestellt. Eine ausführlichere Übersicht über diese drei Therapierichtungen hinsichtlich der Herstellung von Mistelpräparaten findet sich in Lange-Lindberg et al. (2006).7 Bei der anthroposophischen Pharmazie hängt die Indikation vom Wirtsbaum ab. Deshalb werden die Extrakte getrennt nach Wirtsbäumen aufbereitet. Die Wirtsbäume der für die Misteltherapie verwendeten Mistelextrakte sind in Tabelle 4 „Verfügbare Mistelpräparate“ beschrieben.
Die genaue Zusammensetzung der Inhaltsstoffe von Mistelpräparaten ist stark abhängig vom Zeitpunkt der Ernte, auf welchem Wirtsbaum die Mistel gewachsen ist, ob das Kraut, die Früchte oder die ganze Pflanze verwendet wurden und nach welchen Prinzipien die Herstellung verlaufen ist. Daher können sich Mistelpräparate erheblich voneinander unterscheiden und werden abhängig von der Lokalisation der Tumorerkrankung in Dosis und Konzentration dem Anwendungsgebiet angepasst. Dabei orientiert sich die Dosierung häufig an der individuellen Reaktion der Patientin, z. B. an der Rötung um die Einstichstelle.56 Bei auf Mistellektin normierten Präparaten bleibt die Dosierung im Normalfall konstant. Mistelextrakte werden in der Regel subkutan injiziert, jedoch auch intravenös, peritumoral (um das Tumorgewebe) oder intrapleural (in das Brustfell). Je nach Art der Extrakte variieren die Behandlungsschemata und weisen konstante sowie variable Dosierungen auf. Meistens werden subkutane Injektionen zwei- bis dreimal wöchentlich gegeben. Die Behandlungsdauer kann sehr stark variieren zwischen einmaligen Applikationen, Monaten und Jahren.8, 57, 58
In der Therapie von Krebserkrankungen relevante Wirkungen zu Visci alba herbi (Mistelkraut) sind laut der Monografie phytotherapeutischer Arzneimittel59 eine unspezifisch immunstimulierende Wirkung und eine zytostatische Wirkung, die im Tierversuch erreicht werden konnte, angegeben.60 Die Wirkweise scheint von der Konzentration abzuhängen. Während bei niedriger Konzentration von Lektinen und Viscotoxinen nur das Immunsystem angeregt werden konnte, zeigte sich bei höheren Konzentrationen auch die zellschädigende Wirkung auf Tumorzellen.51 Die Mistellektine wirken bei in-vitro-Versuchen mit Krebszellen zytostatisch, indem sie den Zelltod (Apoptose) der Tumorzellen einleiten und sie verstärken möglicherweise die Wirkung der Zytostatika. Auch Viscotoxine wirken in vitro zytostatisch. Mistelextrakte induzieren nachweislich in vitro und in vivo die Produktion von Zytokinen und aktivieren Lymphozyten, Granulozyten und Phagozyten und stimulieren so das Immunsystem.8, 58 Ob dies zu klinisch relevanten Verbesserungen führt, ist in klinischen Studien nachzuweisen.
Auf dem deutschen Markt werden Mistelpräparate verschiedener Hersteller produziert und vertrieben. Dies sind: ABNOBA® GmbH, Helixor® Heilmittel GmbH, Iscador® AG, WALA® Heilmittel GmbH und MEDA® Pharma. Die meisten Produkte folgen den Prinzipien der anthroposophischen Medizin. Zu den anthroposophischen Präparaten gehören abnobaVISCUM®, Helixor®, Iscador®, Iscucin®. Ein Phytopharmakon ist Lektinol®. Bei diesem ist der Lektingehalt standardisiert.8 Anthroposophische Mistelpräparate unterscheiden nach dem Wirtsbaum der Mistel, Phytopharmaka nicht.
Die Produkte Cefalektin®, Eurixor® und Isorel® sind nicht mehr auf dem Markt erhältlich. Die meisten in Deutschland im Handel erhältlichen Mistelpräparate zur Tumorbehandlung sind in der Roten Liste® unter der Kategorie der Zytostatika, in der Untergruppe „Pflanzliche Zytostatika’ (ATC-Kodierung 86.1.1.A.1.1.) aufgeführt.37 Die Rote Liste ist nicht zwingend vollständig, da pharmazeutische Hersteller ihre Produkte freiwillig gegen ein Entgelt einstellen lassen können.37 Die Präparate sind frei zugänglich, da sie zwar apotheken‑, aber nicht rezeptpflichtig sind.8
Tabelle 4: Verfügbare Mistelpräparate37
|
Präparat |
Hersteller |
Wirts bäume (+ Zusatz bei Iscador®) |
Herstellung; Art der Anwendung |
Therapierichtung (gemäß Beipackzettel) |
Anwendungsgebiete laut Hersteller (Beipackzettel) |
|
Abnoba VISCUM® |
ABNOBA® GmbH |
A, Ac, Am, B, C, F, M, P, Qu |
Presssaft aus Mistelkraut; Injektionslösung |
Anthroposophikon |
Anwendungsgebiete gemäß der anthroposophischen Menschen- und Naturerkenntnis. Dazu gehören: Bei Erwachsenen: Anregung von Form- und Integrationskräften zur Auflösung und Wiedereingliederung verselbständigter Wachstumsprozesse, z. B.:
auch mit begleitenden Störungen der blutbildenden Organe
|
|
Helixor® |
Helixor® Heilmittel GmbH |
A, M, P |
Mistelkrautextrakt, wässriger Auszug; Injektionslösung |
Anthroposophikon |
Gemäß der anthroposophischen Menschen- und Naturerkenntnis; Anwendung bei Erwachsenen zur Anregung von Form- und Integrationskräften zur Auflösung und Wedereingliederung verselbständigter Wachstumsprozesse, z. B.:
auch mit begleitenden Störungen der blutbildenden Organe
|
|
Iscador® |
Iscador AG |
M M spezial Qu Qu spezial M + Arg. carb. M + Malachit D4 M + Hydr. sulf. P + Hydr. sulf. Qu + Arg. carb. Qu + Malachit D4 Qu + Hydr. sulf. U + Hydr. sulf. |
Fermentierter nativer Flüssigextrakt aus den frischen Blättern, Sprossen, Knospen und Beeren; Injektionslösung |
Anthroposophikon |
Gemäß der anthroposophischen Menschen- und Naturerkenntnis; Anwendung bei Erwachsenen zur Anregung von Form- und Integrationskräften zur Auflösung und Wedereingliederung verselbständigter Wachstumsprozesse, z. B.
|
Tabelle 4 – Fortsetzung
|
Iscucin® WALA Heilmittel GmbH |
A, C, M, P, Po, Qu, Extrakt, jeweils aus der Anthroposophikon Gemäß der anthroposophischen Menschen- und Naturerkenntnis; S, T ganzen Pflanze; Anwendung bei Erwachsenen zur Anregung von Form-und Injektionslösung Integrationskräften zur Auflösung und Wiedereingliederung verselbständigter Wachstumsprozesse, z. B.:
|
|
Lektinol® MEDA Pharma |
Keine Mistelkrautextrakt; Phytopharmakon Unterstützend bei allgemeinen Maßnahmen zur Verbesserung der Unterscheidung nach Injektionslösung Lebensqualität bei Brustkrebs während und nach der Wirtsbäumen Chemotherapie |
A = Abies (Tanne). Ac = Acer (Ahorn). Am = Amygdalus (Mandelbaum). B = Betulla (Birke). C = Crataegus (Weißdorn). F = Fraxinus (Esche). M = Malus (Apfelbaum). P = Pinus (Kiefer). Po = Populus (Pappel). Qu = Quercus (Eiche). S = Salix (Weide). T = Tilia (Linde). U = Ulmus (Ulme). Arg. carb. = Argentum carbonicum D4. Hydr. sulf. = Hydragyrum sulfuricum D4.
Das Sozialgesetzbuch (SGB) V stellt in § 2 fest, dass Krankenkassen den Versicherten die im dritten Kapitel genannten Leistungen unter Beachtung des Wirtschaftlichkeitsgebots (§ 12 SGB V) zur Verfügung stellen, wobei in Satz 2 speziell darauf hingewiesen wird, dass Behandlungsmethoden, Arznei- und Heilmittel der besonderen Therapierichtungen davon nicht ausgeschlossen sind.
Hinsichtlich anthroposophischer und homöopathischer Arzneimittel, wie etwa der Mistelpräparate, kommt § 34 SGB V zur Anwendung, der in Satz 2 bestimmt, dass der Gemeinsame Bundesausschuss (G‑BA) in den Richtlinien nach § 92 Abs. 1 Satz 2 Nr. 6 festlegt, welche nicht-verschreibungspflichtigen Arzneimittel, die bei der Behandlung schwerwiegender Erkrankungen als Therapiestandard gelten, zur Anwendung bei diesen Erkrankungen mit Begründung vom Vertragsarzt ausnahmsweise verordnet werden können. Danach ist gerade bei der Beurteilung von anthroposophischen und homöopathischen Arzneimitteln im Sinne der besonderen Therapierichtungen deren besondere Wirkungsweise Rechnung zu tragen (§ 34 Abs. 3 SGB V).
Basierend auf dieser gesetzlichen Grundlage des SGB V erließ der G‑BA die Richtlinie über die Verordnung von Arzneimitteln in der vertragsärztlichen Versorgung (Arzneimittel-Richtlinie/AM-RL).
Abschnitt F dieser RL behandelt Verordnungsausschlüsse in der Arzneimittelversorgung durch Gesetz und bezieht sich in § 12 auf apothekenpflichtige, aber nicht verschreibungspflichtige Arzneimittel gemäß § 34 Abs. 1 Satz 2 SGB V. Grundsätzlich werden damit nicht-verschreibungspflichtige Arzneimittel aus dem Leistungskatalog der GKV ausgeschlossen, es sei denn die Präparate gelten bei der Behandlung schwerwiegender Erkrankungen als Therapiestandard (vgl. § 12 Abs. 2 AM-RL). Schwerwiegende Krankheiten werden dabei wie folgt definiert (vgl. § 12 Abs. 3 AM-RL): „[…] Eine Krankheit ist schwerwiegend, wenn sie lebensbedrohlich ist, oder wenn sie aufgrund der Schwere der durch sie verursachten Gesundheitsstörung die Lebensqualität auf Dauer nachhaltig beeinträchtigt.“
Eine vollumfängliche Liste schwerwiegender Erkrankungen und Standardtherapeutika zu deren Behandlung werden in Anlage I zur AM-RL aufgeführt. Anlage I zum Abschnitt F der AM-RL beinhaltet demnach die zugelassenen Ausnahmen zum gesetzlichen Verordnungsausschluss (sogenannte over-the-counter (OTC)-Übersicht). Für die in Anlage I aufgeführten Indikationsgebiete kann der behandelnde Arzt bei schwerwiegenden Erkrankungen auch Arzneimittel der Anthroposophie und Homöopathie verordnen, sofern die Anwendung dieser Arzneimittel für diese Indikationsgebiete und Anwendungsvoraussetzungen nach dem Erkenntnisstand als Therapiestandard in der jeweiligen Therapierichtung angezeigt ist. Der behandelnde Arzt hat zur Begründung der Verordnung die zugrundeliegende Diagnose in der Patientendokumentation aufzuzeichnen (vgl. § 12 Abs. 6 AM-RL).
Hinsichtlich der Misteltherapie hält Anlage I zur AM-RL in Ziffer 32 fest, dass Mistelpräparate als Standardtherapeutika zur Behandlung schwerwiegender Erkrankungen eingesetzt werden können. Konkret führt Ziffer 32 aus: „Mistel-Präparate, parenteral, auf Mistellektin normiert, nur in der palliativen Therapie von malignen Tumoren zur Verbesserung der Lebensqualität.“ Folglich wird die Misteltherapie als Therapiestandard im Sinne des in Ziffer 32 angegebenen Indikationsgebietes, nämlich malignen Erkrankungen und der geforderten Anwendungsvoraussetzung, der palliativen Therapie anerkannt.
Zusammenfassend kann festgehalten werden, dass rezeptfreie homöopathische und anthroposophische Arzneimittel im Sinne der Misteltherapie, beschränkt auf die in der AM-RL (Anlage I, OTC-Übersicht) des G‑BA angegebenen Indikationsgebiete und Anwendungsvoraussetzungen verordnungsfähig sind.
Die damit geschaffenen Voraussetzungen für eine Verordnungsfähigkeit von Mistelpräparaten, nämlich Indikationsgebiet und Anwendungsvoraussetzung (entsprechende Therapieziele) sind das Ergebnis einer konkret geführten rechtlichen Auseinandersetzung darüber, ob sich die Gleichstellung nur auf die Erkrankung – in diesem Fall „maligne Tumoren” – bezieht, oder ob damit auch das Therapieziel „in der palliativen Therapie […] zur Verbesserung der Lebensqualität” umfasst sei. Befürworter der anthroposophischen Therapierichtung vertraten die Rechtsauffassung, die Bezugnahme umfasse nur die Voraussetzung des Vorliegens der schwerwiegenden Erkrankung „maligne Tumoren”, sodass Mistelpräparate auch für die kurative, adjuvante Therapie maligner Tumoren verordnet werden dürfe.
Der G‑BA sah dies als Fehlinterpretation seiner Regelung an und beschloss deshalb im Dezember 2004, im Anschluss an das Wort „Indikationsgebiete” zur Klarstellung den Passus „und Anwendungsvoraussetzungen” einzufügen (hinsichtlich des daraus resultierenden Rechtsstreits zwischen G‑BA und BMG sei auf das Urteil B 6 KA 25/10 R des sechsten Senats des Bundessozialgerichts (BSG) (2011) und Stebner F.A. (2011)61 verwiesen).
In der aktuellsten Entscheidung des BSG hinsichtlich der Anwendung von Mistelpräparaten (B 1 KR 30/15 R vom 15.Dezember 2015) stellt das Gericht erneut fest, dass Krankenversicherte keinen Anspruch auf Versorgung mit dem apotheken- und nicht verschreibungspflichtigen anthroposophischen Arzneimittel Iscador® M (Mistelpräparat) zur adjuvanten Behandlung maligner Tumore haben. Vielmehr hat der G‑BA Mistelpräparate ausschließlich beschränkt auf den Einsatz in der palliativen Therapie in die Liste der verordnungsfähigen nicht verschreibungspflichtigen Arzneimittel aufgenommen. Die Anwendungsbeschränkung „in der palliativen Therapie“ gilt auch für Arzneimittel der besonderen Therapierichtungen. Des Weiteren führt das BSG aus, dass der G‑BA demokratisch legitimiert ist, durch Richtlinien festzulegen, welche nicht-verschreibungspflichtigen Arzneimittel ausnahmsweise zu Lasten der GKV verordnet werden können.
Gegeben dieses regulatorischen Rahmens und der daraus resultierenden sozialgerichtlichen Rechtsprechung lässt sich festhalten, dass Mistelpräparate bei malignen Erkrankungen zur palliativen Therapie verordnungs- und damit auch erstattungsfähig sind. Mit anderen Worten müssen Krankenkassen nur palliativ eingesetzte anthroposophische Mistelpräparate bezahlen.
Zusätzlich zu schulmedizinisch indizierten Behandlungsstrategien wie der Bestrahlung, Hormon- oder Chemotherapie nehmen viele Patientinnen mit Brustkrebs nicht-konventionelle, komplementäre, integrative oder alternative Behandlungsmethoden in Anspruch. Da die Begriffe nicht klar definiert sind und die weitverbreitete Abkürzung „KAM“ den Bereich der alternativen Medizin beinhaltet, der jedoch nicht Gegenstand dieses HTA-Berichts ist, wird in diesem Bericht „KIM“ als Abkürzung für komplementäre und integrative Verfahren verwendet. Unter den Patientinnen mit Brustkrebs ist die Inanspruchnahme von KIM hoch und liegt im Rahmen der „integrativen Onkologie“ bei 50 bis 90 %.9, 62, 63 Ein neueres SR zur Inanspruchnahme von KAM durch Patienten und Patientinnen mit Krebserkrankungen fand neun Studien für Deutschland, die zwischen 2010 und 2018 publiziert wurden. Hier betrug die durchschnittliche Inanspruchnahme 41,1 % (95 %-KI: 28,5 bis 53,7 %; Spannbreite 18 bis 63 %; KI = Konfidenzintervall).64 Aus der Sicht von behandelnden Personen unterscheidet sich die Haltung zu KIM erheblich, denn nur circa die Hälfte der Ärzte bietet KIM-Leistungen an, vor allem deswegen, weil häufig das Wissen zu KIM-Methoden aufgrund mangelnder wissenschaftlicher Evidenz zu Wirksamkeit und Sicherheit des KIM-Verfahrens fehlt.63, 65 Daraus erklärt sich die von vielen Patientinnen wahrgenommene Lücke zwischen Interesse an KIM und tatsächlich erfolgter Beratung zu KIM durch die behandelnden Personen.66
Die Misteltherapie nimmt vor allem im deutschsprachigen Raum (insbesondere Deutschland und Schweiz) einen hohen Stellenwert bei der integrativen Behandlung von Patientinnen mit Brustkrebs ein, der sich deutlich von der Inanspruchnahme von Mistelextrakten in anderen europäischen Ländern unterscheidet. Eine Übersichtsarbeit zur Verwendung von KIM in Europa (Belgien, England, Griechenland, Island, Israel, Italien, Schottland, Serbien, Spanien, Schweiz, Tschechien und der Türkei) zeigt, dass ungefähr 45 % der Patientinnen mit Brustkrebs KIM verwenden.67 Davon nimmt die Gruppe der pflanzlichen Medizin den mit Abstand größten Teil ein, mit 46 % der komplementär verwendeten Medikamente. Die Gruppe der pflanzlichen Medizin ist jedoch sehr divers. Im europaweiten Durchschnitt liegt die Misteltherapie in der genannten Übersichtsarbeit bei einem Anteil von 5,4% der verwendeten Heilkräuter. In einzelnen Ländern, wie Schottland68 und der Türkei69, liegt der Anteil deutlich darunter, bei 3 bis 5 % der KIM.
Um die besondere Stellung der Misteltherapie im deutschsprachigen Raum angemessen wiederzugeben, werden Informationen zur Inanspruchnahme, zu soziokulturellen und patientenrelevanten Aspekten und zu Kosten aus volkswirtschaftlicher Perspektive auf Evidenz aus dem deutschsprachigen Raum eingegrenzt.
Die Nachfrage und Verwendung von Mistelpräparaten und anderen KIM-Therapien und die damit verbundenen Erwartungen sind auch Gegenstand der Domäne der Patienten- und der sozialen Aspekte. Die Ergebnisse der systematischen Literatursuche zu dieser Fragestellung werden dort sowohl aus der Perspektive der Patientinnen als auch aus der der Ärztinnen und Ärzte berichtet (siehe Abschnitt 5.3.7.1). In der ambulanten Versorgung sind Mistelpräparate die am häufigsten verordneten Präparate zur Behandlung von Krebserkrankungen. Hier muss jedoch berücksichtigt werden, dass die meisten Zytostatika innerhalb des stationären Sektors verordnet und deshalb nicht im Verordnungsreport erfasst werden.
Die Verordnungs- beziehungsweise Verkaufszahlen von Mistelpräparaten spiegeln die Vorliebe der deutschen Bevölkerung für die komplementäre Medizin wider. 2015 betrug die Zahl der verordneten Tagesdosen (DDD: definierte Tagesdosis pro Tag) 3,6 Millionen Dosen. Die Inanspruchnahme von Mistelextrakten hat jedoch in den vergangenen Jahren abgenommen. Die gängigen Arzneimittel mit den Markennamen Helixor®, Iscador®, Lektinol® und abnobaVISCUM® hatten 2015 insgesamt einen Umsatzrückgang von 8,7 % im Vergleich zum Vorjahr zu verzeichnen. Auf dem Höchststand waren die Verordnungen von Mistelpräparaten 1999. Seitdem nimmt die Verordnungszahl insgesamt ab. Die Bruttokosten pro Tagesdosis für die Misteltherapie liegen laut Arzneimittelverordnungsreport 2016 im Jahr 2015 bei ungefähr drei Euro.70
-
1.4 Hintergrund zur Bewertung von Patienten- und sozialen
Eine systematische Untersuchung der Patientensicht und soziale Aspekte werden derzeit noch selten explizit und ausführlich in HTA-Berichten durchgeführt. In die Hintergründe, die eine solche Bewertungsdimension generell als angemessen erscheinen lassen, wird hier kurz eingeführt. Diese Einführung basiert auf dem HTA Core Model® des European network for Health Technology Assessment (EUnetHTA). Das HTA Core Model® ist ein methodisches Rahmengerüst für die Produktion von HTA-Berichten, das von EUnetHTA entwickelt wurde, um eine gemeinsame Produktion von HTA-Berichten und den Austausch von HTA-Informationen zwischen HTA-Organisationen in Europa zu erleichtern. Dieses fasst Gründe für die Relevanz der sozialen Domäne („patients and social aspects“), relevante Forschungsfragen und die Methodik zu ihrer Bearbeitung zusammen.71
Die Patientinnenperspektive auf die Erkrankung und die zu bewertende Technologie liefert wichtige Einsichten, welche Auswirkungen eine Technologie auf das Alltagsleben haben kann. Nur die Patientin selbst, und eventuell auch betreuende Personen, können Auskunft über Erfahrungswerte und zum subjektiven Erleben der Erkrankung geben. Das Wissen von Betroffenen zum Verlauf der Brustkrebserkrankung und den Einsatz der Gesundheitstechnologie sind eine wichtige Quelle für die Bewertung der Eigenschaften und der Nützlichkeit der Misteltherapie.71 Die Anwendung der Gesundheitstechnologie kann neben einem möglichen Nutzen auch eine Belastung für die Patienten darstellen, wie es beispielsweise bei der Chemotherapie der Fall ist. Die Misteltherapie kann möglicherweise die Funktionsfähigkeit der Patientin mit Brustkrebs in verschiedenen Lebensbereichen beeinflussen. Auch weniger beachtete Faktoren wie eine Diskriminierung durch Krankheit und Therapie sollen von der Domäne abgebildet und in Betracht gezogen werden, um eine Stärkung („empowerment“) der Patientinnen im Versorgungsalltag weiter in den Fokus der Therapieplanung zu stellen.
Eine Gesundheitstechnologie wirkt nicht isoliert, sondern um befriedigende Ergebnisse zu erzielen, muss die Patientin in der Regel eigene Ressourcen, die z. B. körperlicher, psychischer oder finanzieller Natur sein können, für ihre täglichen Lebensaktivitäten heranziehen können.71 Auch die soziale Unterstützung durch Familie und Freunde ist ein wichtiger Faktor bei der täglichen Lebensführung.
Der Einsatz der Misteltherapie kann Veränderungen bei der Patientin bewirken, sowohl positive als auch negative. Patienten können einer Technologie und den Auswirkungen ihrer Nutzung verschiedene Bedeutung zumessen. Bei einer umfassenden Bewertung von Gesundheitstechnologien sollte deshalb auch die Patientensicht zur Krankheit, der zu bewertenden Technologie und die sozialen Beziehungen zwischen dem Patienten und, im Kontext seiner Gesundheit, wichtigen Personen oder Gruppen betrachtet werden. Hierbei ist die Kommunikation zwischen Arzt und Patient besonders wichtig, da sie die Basis für informierte Therapieentscheidungen ist. Darüber hinaus kann es sinnvoll sein, zu untersuchen, ob bestimmte soziale Gruppen für die Misteltherapie besonders relevant erscheinen oder ob der Zugang zur Misteltherapie für manche Gruppen erschwert ist. Die Wahrnehmung und Inanspruchnahme der Behandlung ist sowohl aus Patientensicht von Interesse als auch aus der Perspektive des behandelnden Fachpersonals.
Da die Misteltherapie ein komplementärmedizinisches Verfahren ist, kann die Einstellung zu solchen Verfahren bei den Patientinnen stark variieren und die Therapieentscheidung beeinflussen. Beispielsweise wäre zu erwarten, dass Befürworterinnen der anthroposophischen Medizin bereitwilliger zur Misteltherapie greifen als Patientinnen mit anderen Einstellungen. In Abhängigkeit von den Ergebnissen der Bewertung der Wirksamkeit und Sicherheit der begleitenden Misteltherapie, könnte dies Beratungsbedarf nach sich ziehen, sodass die Patientinneninformation darauf ausgerichtet sein müsste, entweder zu hohe Erwartungen zu dämpfen oder eine ungerechtfertigte Abwehrhaltung zu entkräften. Hier wäre von Interesse, welche Informationen zur Misteltherapie Patientinnen zur Verfügung stehen und ob sie damit zufrieden sind.
Innerhalb der Ärzteschaft gibt es ebenfalls unterschiedliche Einstellungen gegenüber der anthroposophischen Medizin und KIM-Verfahren wie der Misteltherapie. Diese Einstellungen der behandelnden Personen und deren Auswirkung auf die Arzt-Patientinnen-Beziehung sowie Informationen darüber, warum Ärzte die Misteltherapie befürworten oder ablehnen, sind ein wichtiger Teil der sozialen Aspekte in Bezug auf die Information und Kommunikation der Therapieoption an potenzielle Patientinnen.
Ethik ist eine ursprünglich philosophische und theologische Teildisziplin, die sich begrifflich, hermeneutisch und historisch mit den Fragen des moralisch Richtigen, Guten und Gerechten beschäftigt. Als Reflexionswissenschaft arbeitet Ethik vor allem mit konzeptuellen Analysen und begründender Argumentation. Mit unter anderem der Entwicklung der Medizinethik als interdisziplinär betriebene „Angewandte” Ethik in den 1960er Jahren72 sind auch empirische Methoden in der Ethik des Gesundheitswesens zunehmend heimisch geworden.73
Eine „Ethik des Gesundheitswesens” kann als ein Überbegriff für vier verschiedene Bereiche der Angewandten, das heißt auf Probleme eines spezifischen Handlungsfelds ausgerichteten Ethik verstanden werden. Diese Bereiche sind in der Regel die Klinische Ethik („Ethik der Patientenversorgung“, inklusive der ärztlichen Ethik und der Pflegeethik), die Public Health-Ethik und die (biomedizinische) Forschungsethik (vgl. Mertz 2018)74. Aufgabe einer Ethik des Gesundheitswesens ist es, auf die moralischen Voraussetzungen und Implikationen des Gesundheitswesens (und darauf bezogener Forschung) hin zu reflektieren, moralische Prinzipien, Werte und Normen für die Handlungsfelder des Gesundheitswesens zu rekonstruieren oder zu entwerfen, ethisch bedeutsame Herausforderungen zu identifizieren, Handlungsoptionen angesichts dieser Herausforderungen zu eruieren, diese hinsichtlich ihrer moralischen Tragweite zu bewerten und (dadurch) Orientierung hinsichtlich des Umgangs mit ethischen Herausforderungen zu geben. Zu den praxisorientierteren Aufgaben einer Ethik des Gesundheitswesens gehören ferner auch klinische Ethikkonsultation sowie zunehmend die ethische Bewertung im Rahmen von (Gesundheits-)Technikfolgenabschätzung. Die genannten Bereiche (Klinische Ethik, Public Health-Ethik und Forschungsethik) können zum Teil überlappende, zum Teil sich konfligierende und zum Teil sich ergänzende Perspektiven bei der Umsetzung der Aufgaben einer Ethik des Gesundheitswesens einnehmen.
Die Untersuchung ethischer Fragen im Zusammenhang mit alternativer‑, komplementärer und integrativer Medizin (KIM) gehört ebenfalls zu einer Ethik im Gesundheitswesen. Dabei stellt bereits die angemessene Definition von „Alternativmedizin“, „Komplementärmedizin” und auch „integrativer Medizin“ (vgl. z. B. Teichfischer/Münstedt (2011), aber auch AWMF (2012))13, 75 und damit der Gegenstände entsprechender ethischer Erörterungen nicht nur ein wissenschaftstheoretisches, sondern selber ein ethisches Problem dar, da die Zuordnung einer Therapie beispielsweise zu „Komplementärmedizin” sowohl negative (z. B. Nähe zu Scharlatanerie oder zumindest Wirkungslosigkeit) als auch positive (z. B. Ganzheitlichkeit, Unabhängigkeit von „der pharmazeutischen Industrie”) gesellschaftliche Konnotationen sowie zum Beispiel auch unterschiedliche institutionelle und rechtliche Regelungen mit sich bringen kann. (Aufgrund des Themas des HTA-Berichts wird im Folgenden nur noch von komplementärer und integrativer Medizin beziehungsweise KIM gesprochen). Neben der Frage, ob eine komplementär- oder integrativmedizinische Intervention aus ethischen Gründen überhaupt (regulär) in einem durch öffentliche Mittel bezahlten Gesundheitswesen angeboten, gefördert oder verwendet werden soll (z. B. weil sie die für auch konventionelle Interventionen geltenden Kriterien wie jene der Wissenschaftlichkeit, Wirksamkeit oder Sicherheit nicht erfüllt), stellen sich weitgehend dieselben ethischen Fragen, die sich in der Medizin generell stellen76 (so z. B. zur informierten Einwilligung, zur Abwägung von möglichem Nutzen und Schaden, zum Verhältnis zwischen Therapeut/in und Patient/in beziehungsweise Anbietendem und Kundin/Kunden usw.). Zusätzliche ethische Fragen können sich aber auf das Verhältnis zwischen etablierter und komplementärer oder integrativer Medizin beziehen76, so zum Beispiel auf den gegenseitigen professionellen Umgang oder auf die Pflicht von Ärztinnen und Ärzten, Patientinnen und Patienten auch über alternative Behandlungsmethoden im Bereich der komplementären und integrativen Medizin aufzuklären.
Während in der philosophischen Ethik vornehmlich Moraltheorien (wie beispielsweise die Kantianische Deontologie, Varianten des Utilitarismus, Gerechtigkeitstheorien, neoaristotelische Tugendethiken usw. (siehe zur Übersicht beispielsweise Düwell et al. (2011))72 entwickelt, kritisiert oder für die Beantwortung ethischer Fragen verwendet werden, sind in der Ethik im Gesundheitswesen Rahmengerüste (Frameworks) verbreitet, die im weitesten Sinne als „prinziplistisch” bezeichnet werden können. Solche Rahmengerüste sind zwar von den philosophischen Theorien und deren Debatten informiert, bauen aber auf Prinzipien „mittlerer Reichweite” auf, die in der Regel von mehreren Theorien getragen werden können und auch an die Alltagsmoral und/oder das professionelle Ethos (zum Beispiel der Ärzte) anschlussfähig sind. Entsprechend orientieren sich solche Rahmenwerke nicht an einem einzelnen Moralprinzip (wie beispielsweise dem Kategorischen Imperativ oder dem utilitaristischen Nutzenmaximierungsprinzip), das eine Handlung als moralisch rechtfertigen kann, sondern an einem kohärentistischen Begründungsverfahren mittels verschiedener Prinzipien im Sinne von Normen (vgl. Strech et al. (2012))77. Solche Prinzipien „mittlerer Reichweite” sind auf den ersten Blick bindend, müssen aber spezifiziert und gegeneinander abgewogen werden, um zu einem konkreten Urteil zu gelangen. Ethische Rahmengerüste dienen dadurch der grundlegenden Orientierung, der Bewertung und Begründung von Handlungen oder Handlungsregeln. Sie sind auch ein Hilfsmittel bei der Entscheidungsfindung. Sie müssen aber kontextsensitiv und argumentativ auf einen Fall angewendet werden.
Das bekannteste prinziplistische Rahmenwerk für die Medizinethik ist jenes von Beauchamp und Childress (2009)78, das auch als „Vier-Prinzipien-Ansatz” bekannt ist. Es verwendet die vier Prinzipien Respekt vor der Patientenautonomie (respect for patient autonomy), Wohltun/Fürsorge (beneficence), Nichtschaden (non-maleficence) und Gerechtigkeit (justice). Ein weiteres bekanntes Rahmenwerk, ausgelegt für biomedizinische Forschungsethik, ist jenes von Emanuel et al. (2008).79
Insbesondere für die Public Health-Ethik haben Strech und Marckmann (2012)80 ein Rahmengerüst mit Prinzipien und jeweils davon abgeleiteten Kriterien entworfen, das im Folgenden für die ethische Bewertung herangezogen werden wird (siehe auch Methodik, Kapitel 3.4.3). Die folgende Tabelle gibt eine Übersicht über die darin enthaltenen Prinzipien und Kriterien:
Tabelle 5: Normative Prinzipien und Kriterien für die Public Health-Ethik
Normative Prinzipien und Kriterien
Nutzenpotenzial der Maßnahme (Nutzen)
Bestimmung der Ziele der Maßnahme
Grad der Zielerreichung
Relevanz für Morbidität, Lebensqualität & Mortalität
Validität (Evidenzgrad) des Nutzennachweises
Schadenspotenzial der Maßnahme (Schaden)
Belastungen (individuell und gruppenbezogen)
Gesundheitliche Risiken
Validität (Evidenzgrad)
Selbstbestimmung
Förderung der Gesundheitskompetenz des Einzelnen (Empowerment)
Möglichkeit zur informierten Einwilligung
Auswirkungen auf die Entscheidungsfreiheit
Schutz der Privatsphäre (personelle Integrität, Vertraulichkeit, Datenschutz)
Gerechtigkeit
(Nicht-diskriminierender) Zugang zur medizinischen Versorgung
Verteilung der gesundheitlichen Nutzen- und Schadenspotenziale
Ausgleich bestehender Ungleichheiten in den Gesundheitschancen
Bedarf an Kompensation
Effizienz (Kosten)
Kosten-Nutzen-Verhältnis
Validität der Effizienzmessung
Legitimität
Legitimierte Entscheidungsinstanz
Fairer Entscheidungsprozess (Transparenz, Partizipation, rationale Begründung, Möglichkeit der Revision, Regulierung)
Grundsätzlich können anhand eines prinziplistischen Ansatzes ethische Aspekte in ethische Risiken und ethische Herausforderungen unterteilt werden (vgl. auch Mertz et al. (2018))81 Ethische Risiken bestehen bei der Gefahr, dass ein oder mehrere ethische Prinzipien missachtet oder unzureichend berücksichtigt werden. Von einer ethischen Herausforderung kann dann gesprochen werden, wenn ein oder mehrere Prinzipien in Konflikt zueinanderstehen und eine Abwägung erforderlich wird, welchem Prinzip gefolgt werden soll.
Darüber hinaus können ethische Aspekte beim Einsatz der begleitenden Misteltherapie in solche unterschieden werden, die sich aus allgemeineren Aspekten der komplementären oder der integrativen Medizin ergeben, sowie aus solchen, die spezifischer für den Kontext der begleitenden Misteltherapie zutreffend sind. Darüber hinaus lassen sich Aspekte identifizieren, die von der jeweiligen Evidenzlage (z. B. bezüglich Nutzen und Schaden, oder bezüglich Kosten) abhängig sind und solche, die unabhängig von der Evidenzlage bestehen, also selbst dann ethische Aspekte wären, wenn die Evidenzlage vollständig wäre.
Die in der konventionellen Therapie von Patientinnen mit Brustkrebs häufig angewendete Chemotherapie bringt Nebenwirkungen mit sich.9 Mistelpräparate werden eingesetzt, um Nebenwirkungen der Chemotherapie zu lindern und die Lebensqualität der Patientinnen zu erhöhen.82 Der HTA-Bericht von Lange-Lindberg et al. (2006)7 „Misteltherapie als begleitende Behandlung zur Reduktion der Toxizität der Chemotherapie maligner Erkrankungen” kam zu dem Schluss, dass sich nur bei Brustkrebs Hinweise dafür ergäben, dass eine begleitende Misteltherapie die Lebensqualität verbessern könnte. Die aktuelle deutsche medizinische Leitlinie zur Früherkennung, Diagnostik und Therapie des Brustkrebses trifft die Aussage, dass eine Misteltherapie das Überleben von Patientinnen mit Mammakarzinom nicht verbessert und eine Verbesserung der Lebensqualität aufgrund unzureichender Datenlage fraglich sei.13 So stellt sich die Frage, ob es inzwischen neue Evidenz zur medizinischen Wirksamkeit und Sicherheit gibt, die diese Fragen klären kann. Zudem sollen im vorliegenden Bericht auch die Kosten und die Kosteneffektivität, Patientenaspekte, soziale Implikationen und ethische Fragen, die mit einer begleitenden Misteltherapie verbunden sind, systematisch untersucht werden.
Alle in Deutschland erhältlichen Mistelpräparate sind rezeptfrei. Sie sind Gegenstand des vorliegenden Berichts. Die Kosten einer Palliativbehandlung bei Patientinnen mit metastasiertem Brustkrebs werden von der GKV übernommen. Eine adjuvante Behandlung bei nicht-metastasiertem Brustkrebs wird aufgrund der bisherigen unsicheren Evidenzlage nicht übernommen, soll aber hier auch untersucht werden. Anhand der vorliegenden Literatur sollen die in den nächsten Abschnitten beschriebenen Forschungsfragen beantwortet werden.
-
• Verringert die zusätzliche Gabe von Mistelpräparaten bei der konventionellen Chemotherapie deren patientenrelevante Nebenwirkungen bei Patientinnen mit Brustkrebs mit Metastasen (palliative Behandlung) oder ohne Metastasen (adjuvante Behandlung) im Vergleich zur Chemotherapie ohne eine Begleittherapie mit Mistelpräparaten?
-
• Wird durch die zusätzliche Gabe von Mistelpräparaten bei der konventionellen Chemotherapie bei palliativer oder adjuvanter Behandlung die HRQOL im Vergleich zur Chemotherapie ohne eine Begleittherapie mit Mistelpräparaten erhöht?
-
• Hat die zusätzliche Gabe von Mistelpräparaten bei der konventionellen Chemotherapie bei palliativer oder adjuvanter Behandlung einen Effekt auf das progressionsfreie Überleben oder auf die Gesamtüberlebenszeit?
Tabelle 6 stellt die Operationalisierung des Fragenkomplexes nach dem PICO-Schema dar.
Tabelle 6: Spezifizierung der Forschungsfrage zur medizinischen Bewertung anhand von P (Population) I (Intervention) C (Comparator = Vergleichsintervention) O (Outcome = Zielgröße)
Forschungsfrage
Population Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung)
Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung)
Intervention Begleittherapie mit in Deutschland zugelassenen Mistelpräparaten (subkutan,
intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie
Vergleichsintervention Standardtherapie allein
Tabelle 6 – Fortsetzung
|
Zielgrößen primär |
Unerwünschte Nebenwirkungen der Standardtherapie (Fatigue, Übelkeit, Schmerzen) Notwendige therapeutische Maßnahmen aufgrund von Nebenwirkungen (z. B. Bluttransfusionen, Antiemetika, Antibiotika etc.) HRQOL |
|
Zielgrößen sekundär |
Gesamtüberleben Progressionsfreies Überleben |
HRQL = Gesundheitsbezogene Lebensqualität.
w Wie hoch sind die inkrementellen Kosten beziehungsweise Einsparungen der zusätzlichen Gabe von Mistelpräparaten bei der konventionellen Therapie bei Patientinnen mit Brustkrebs mit und ohne Metastasen?
-
• Wie ist die Kosteneffektivität der zusätzlichen Gabe von Mistelpräparaten bei der konventionellen Therapie bei Patientinnen mit Brustkrebs im Vergleich zu einer konventionellen Therapie ohne Mistelpräparate?
Tabelle 7 stellt die Operationalisierung des Fragenkomplexes nach dem PICO-Schema dar.
Tabelle 7: Spezifizierung der Forschungsfrage zur gesundheitsökonomischen Bewertung anhand von PICO
|
Forschungsfrage |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Standardtherapie allein |
|
Zielgrößen |
Inkrementelle Kosten (direkt und indirekte) der begleitenden Misteltherapie Inkrementelle Kosten (direkte und indirekte) pro gewonnenem qualitätsadjustiertem Lebensjahr Inkrementelle Kosten (direkte und indirekte) pro gewonnenem Lebensjahr |
-
• Wie häufig nehmen Patientinnen und das behandelnde Fachpersonal die begleitende Misteltherapie in Anspruch, welche Einstellung haben sie zur begleitenden Misteltherapie und welchen Gewinn erwarten sie sich von ihr?
-
• Wie nehmen Patientinnen und das behandelnde Fachpersonal die Therapie wahr?
-
• Gibt es Faktoren, die eine Gruppe von Patientinnen daran hindern, Zugang zur begleitenden Misteltherapie zu erhalten, falls sich die Technologie als wirksam und sicher erweist? Wenn ja, welches sind die Faktoren?
-
• Wie werden Patientinnen über die Therapiemöglichkeiten im Zusammenhang mit der begleitenden Misteltherapie informiert und wie werden sie ihnen erläutert? Wie beurteilen Patientinnen die Information und Kommunikation?
-
• Welche besonderen Punkte gibt es, die kommuniziert werden sollten, um eine adäquate Inanspruchnahme zu gewährleisten?
Tabelle 8 stellt die Operationalisierung des Fragenkomplexes nach dem PICO-Schema dar. Weitere Themenbereiche können sich aus der gefundenen Literatur aufgrund der qualitativen Inhaltsanalyse ergeben.
Tabelle 8: Spezifizierung der Forschungsfrage zu Patienten- und sozialen Aspekten anhand von PICO
|
Forschungsfrage |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) |
|
Intervention |
Therapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Keine Vergleichsintervention Standardtherapie allein |
|
Zielgrößen |
Einstellung gegenüber/Akzeptanz der begleitenden Misteltherapie Erwartungen an die begleitende Misteltherapie Wissen über die begleitende Misteltherapie Inanspruchnahme der begleitenden Misteltherapie Zugang zur Misteltherapie für verschiedene Patientengruppen Erfahrungen mit der begleitenden Misteltherapie Zufriedenheit mit der begleitenden Misteltherapie im Alltagsleben Art, Umfang und Bewertung der Patientinneninformation zur begleitenden Misteltherapie Bewertung der Arzt-Patienten-Kommunikation hinsichtlich der begleitenden Misteltherapie Besondere Punkte, die kommuniziert werden sollen, um adäquate Inanspruchnahme zu gewährleisten |
w Welche ethischen Aspekte auf individueller, gesellschaftlicher und berufsethischer Ebene sind bei der Misteltherapie als Begleittherapie bei Patientinnen mit nicht-metastasiertem und metastasiertem Brustkrebs im Vergleich zur konventionellen Therapie allein relevant?
-
• Zu welchem Ergebnis kommen eine Bewertung und Abwägung der identifizierten ethischen Aspekte und Herausforderungen hinsichtlich des Einsatzes der Misteltherapie als Begleittherapie bei Patientinnen mit Brustkrebs, d. h. insbesondere unter welchen Bedingungen ist der Einsatz der begleitenden Misteltherapie bei adjuvanter und palliativer Behandlung von Brustkrebs ethisch vertretbar?
Tabelle 9 stellt die Operationalisierung der Forschungsfrage zu ethischen Aspekten dar. Für die Operationalisierung der Fragestellung ist ein Vorgehen nach PICO nicht möglich und auch methodisch nicht zielführend, da die zu prüfende Literatur nicht (oder wenn, dann eher nur zufällig) nach Populationen, Interventionen, Vergleichsgruppen und Outcome differenziert und dies entsprechend nicht transparent ausweist. Außerdem ist PICO auf empirische beziehungsweise kausale Zusammenhänge ausgerichtet, aber ethische Aspekte stellen konzeptuelle Zusammenhänge dar, die sich auch in einem meistens höheren Abstraktionsniveau bewegen als eine konkrete (Stu-dien-)Population.
Tabelle 9: Spezifizierung der Forschungsfrage zu ethischen Aspekten anhand von PICO
|
Forschungsfrage |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Keine Vergleichsintervention Standardtherapie allein |
|
Zielgrößen |
Ethische Aspekte (Details siehe Rahmengerüst Tabelle 5: Normative Prinzipien und Kriterien für die Public Health-Ethik) |
Um eine Übersicht zu den Empfehlungen aus klinischen Praxisleitlinien zur komplementären Misteltherapie bei Brustkrebs zu erstellen, wird nach evidenzbasierten Leitlinien zur Behandlung des Brustkrebses gesucht. Eingeschlossen werden alle Leitlinien mit Veröffentlichungsdatum innerhalb der letzten zehn Jahre (ab 2008), die Aussagen zumindest zur Komplementärmedizin beinhalten und die ihre Empfehlungen auf Grundlage einer systematischen Literaturrecherche treffen. Die systematische Recherche muss in der Leitlinie berichtet werden. Die Ein- und Ausschlusskriterien für die Durchsicht der Leitlinien sind in Tabelle 10 genannt.
Tabelle 10: Ein- und Ausschlusskriterien für Leitlinien zu Brustkrebs für die Aufnahme in die Informationssynthese
|
Einschlusskriterien Leitlinien |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Studientypen |
S3/S4-Leitlinien auf Basis randomisierter kontrollierter Studien Aktuell gültige Leitlinien, die nicht zurückgezogen sind |
|
Zeitraum |
Nicht älter als zehn Jahre (ab 2008) |
|
Sprachen |
Englisch, Deutsch |
|
Ausschlusskriterien Leitlinien |
|
|
Hauptgegenstand der Leitlinie ist nicht die Behandlung, (z. B. Screening, Mastektomie oder genetische Prädisposition und Risikofaktoren) |
|
|
Zurückgezogene Leitlinien |
|
|
Volltexte nicht verfügbar |
|
Außerdem wird zur Bewertung der medizinischen Wirksamkeit und Sicherheit ein SR nach den Methoden der evidenzbasierten Medizin in sechs Schritten durchgeführt.83, 84
-
1. Festlegung von Ein- und Ausschlusskriterien für die Literaturrecherche und das SR hinsichtlich Population, Intervention, Vergleichsintervention, Zielgrößen, Studientypen, Zeitraum der Suche, Sprache der Publikationen, 2. Literaturrecherche, 3. Studienselektion, 4. Datenextraktion, 5. Bewertung der Studienqualität, und 6. Analyse und Informationssynthese.
-
3.1.1 Ein- und Ausschlusskriterien für Sekundär- und Primärstudien
Die Ein- und Ausschlusskriterien für die Studien zur Evaluation der Fragestellung wurden vor dem Beginn der Literaturrecherche festgelegt und sind von Tabelle 11 bis Tabelle 13 dargestellt. Erstens werden SR und HTA-Berichte eingeschlossen, die die Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Patientinnen mit Brustkrebs oder generell bei allen Krebserkrankungen untersuchen, wenn die Ergebnisse zu Brustkrebs getrennt dargestellt sowie die zugehörigen Effektgrößen und deren Unsicherheitsmaße entnehmbar sind. Für einen Einschluss muss mindestens eine der unten in der Tabelle aufgelisteten Zielgrößen mit Effektschätzer und Unsicherheitsmaß berichtet werden oder berechenbar sein. Eingeschlossen werden nur SR und HTA-Berichte ab 01. April 2004, die nach Rechercheschluss des HTA-Berichts von Lange-Lindberg et al. veröffentlicht sind, dessen Recherche im Juni 2004 endet.7 SR und HTA-Berichte, die bereits im HTA-Bericht von Lange-Lindberg et al. enthalten sind, werden ausgeschlossen.
Tabelle 11: Ein- und Ausschlusskriterien für HTA-Berichte und SR zur medizinischen Wirksamkeit und Sicherheit der begleitenden Misteltherapie für die Aufnahme in die Informationssynthese
|
Einschlusskriterien Sekundärstudien |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Standardtherapie mit oder ohne Placebogabe |
|
Zielgrößen Wirksamkeit |
|
|
Zielgrößen primär |
Unerwünschte Nebenwirkungen der Standardtherapie (Fatigue, Übelkeit, Schmerzen) Notwendige therapeutische Maßnahmen aufgrund von Nebenwirkungen (z. B. Bluttransfusionen, Antiemetika, Antibiotika etc.) HRQOL |
|
Zielgrößen sekundär |
Gesamtüberleben Progressionsfreies Überleben |
|
Zielgrößen Sicherheit |
Unerwünschte Nebenwirkungen der Mistelbegleittherapie |
|
Studientypen |
SR, HTA-Berichte, die einen transparenten, nachvollziehbaren Methodenteil, eine ausführliche Ergebnisdarstellung aufweisen |
|
Zeitraum |
Ab 2004 |
|
Sprachen |
Englisch, Deutsch |
|
Ausschlusskriterien Sekundärstudien |
|
|
Bereits im HTA-Bericht von Lange-Lindberg et al. 2006 enthalten |
|
|
Qualitätskriterien nicht ausreichend erfüllt (siehe 3.1.5) |
|
|
Zusammenfassungen (Abstracts), für die keine Volltexte zur Verfügung stehen |
|
HTA = Health Technology Assessment. SR = Systematische Übersichtsarbeit.
Zweitens werden publizierte randomisierte kontrollierte Studien (RCT) zur Wirksamkeit und Sicherheit der begleitenden adjuvanten oder palliativen Misteltherapie bei Patientinnen mit Brustkrebs eingeschlossen, die mindestens eine der unten aufgeführten Zielgrößen untersuchen. Die Verminderung unerwünschter Nebenwirkungen der Chemotherapie und die HRQOL müssen mit validierten Messinstrumenten gemessen werden, die Symptome oder Lebensqualität mehrdimensional erfassen und nicht nur einzelne Symptome oder Lebensqualitätsaspekte. Hierbei werden alle RCT eingeschlossen, die verfügbar sind. RCT vor 2003 werden den SR und HTA-Berichten (Lange-Lindberg et al.7 und neu identifizierten) entnommen. Auch hier werden die Originalpublikationen der RCT für Datenextraktion, ‑analyse und ‑synthese herangezogen. Nicht-randomisierte Studiendesigns werden aufgrund des hohen Potenzials einer systematischen Verzerrung (Bias), nicht als Evidenz für die Bewertung der Wirksamkeit einbezogen. Für Fragestellungen zur Sicherheit, also zu unerwünschten Nebenwirkungen der Misteltherapie, werden auch Beobachtungsstudien, abgesehen von Fallstudien und ‑serien, einbezogen. Hier werden nur Studien eingeschlossen, bei denen unerwünschte Nebenwirkungen eine Hauptfragestellung darstellen und dies zumindest in der Zusammenfassung erwähnt ist. Um in der Durchsicht der Titel und Zusammenfassungen (Abstracts) bewerten zu können, ob die Zielgrößen zur Sicherheit adressiert werden, werden nur Referenzen eingeschlossen, die mindestens einen der folgenden Begriffe auf Deutsch oder Englisch beinhalten: safety/Sicherheit, tolerance/Verträglichkeit, adverse drug reaction/unerwünschte Arzneimittelwirkung, adverse event/unerwünschtes Ereignis oder side effect/Nebenwirkungen.
Die nachfolgenden Tabellen beschreiben die Ein- und Ausschlusskriterien für die Primärstudien zur medizinischen Wirksamkeit (Tabelle 12) und für die Sicherheit (Tabelle 13) der Misteltherapie.
Tabelle 12: Ein- und Ausschlusskriterien für Primärstudien zur medizinischen Wirksamkeit der begleitenden Misteltherapie für die Aufnahme in die Informationssynthese
|
Einschlusskriterien Primärstudien |
|
|
Wirksamkeit |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung). Es kann sich auch um ein Teilkollektiv der Studie handeln, wenn die Ergebnisse getrennt für das relevante Kollektiv berichtet werden. |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Standardtherapie mit oder ohne Placebogabe |
|
Zielgrößen primär |
Reduktion unerwünschter Nebenwirkungen der Standardtherapie (Fatigue, Übelkeit, Schmerzen) gemessen mit mehrdimensionalen validierten Messinstrumenten Notwendige therapeutische Maßnahmen aufgrund von Nebenwirkungen (z. B. Bluttransfusionen, Antiemetika, Antibiotika etc.) HRQOL gemessen mit mehrdimensionalen validierten Messinstrumenten |
|
Zielgrößen sekundär |
Gesamtüberleben Progressionsfreies Überleben |
|
Studientypen |
RCT |
|
Zeitraum |
Ab 2004 identifiziert in Datenbankrecherche (ab Ende des Recherchezeitraums des letzten eingeschlossenen HTA-Berichts oder SR) Vor 2004 identifiziert in eingeschlossenen SR und HTA-Berichten (Lange-Lindberg et al. und neuidentifizierte) |
|
Sprachen |
Englisch, Deutsch |
|
Ausschlusskriterien Primärstudien |
|
|
RCT mit nicht abgeschlossener Rekrutierung |
|
|
Doppelpublikationen ohne zusätzliche Informationen |
|
|
Zusammenfassungen (Abstracts), für die keine Volltexte zur Verfügung stehen |
|
HRQOL = Gesundheitsbezogene Lebensqualität. HTA = Health Technology Assessment. RCT = Randomisierte kontrollierte Studie, engl.: Randomised Controlled Trial. SR = Systematische Übersichtsarbeit.
Tabelle 13: Ein- und Ausschlusskriterien für Primärstudien zur Sicherheit der begleitenden Misteltherapie für die Aufnahme in die Informationssynthese
|
Einschlusskriterien Primärstudien |
|
|
Sicherheit |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung). Es kann sich auch um ein Teilkollektiv der Studie handeln, wenn die Ergebnisse getrennt für das relevante Kollektiv berichtet werden. |
|
Intervention |
Begleittherapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Standardtherapie mit oder ohne Placebogabe |
|
Zielgrößen |
Unerwünschte Nebenwirkungen der begleitenden Misteltherapie Notwendige therapeutische Maßnahmen aufgrund von Nebenwirkungen |
|
Studientypen |
RCT Beobachtungsstudien außer Fallstudien und Fallserien |
|
Zeitraum |
Ab 2004 identifiziert in Datenbankrecherche (ab Ende des Recherchezeitraums des letzten eingeschlossenen HTA-Berichts oder SR) Vor 2004 identifiziert in eingeschlossenen SR und HTA-Berichten (Lange-Lindberg et al. und neuidentifizierte) |
Tabelle 13 – Fortsetzung
Sprachen Englisch, Deutsch
Ausschlusskriterien Primärstudien
RCT mit nicht abgeschlossener Rekrutierung
Doppelpublikationen ohne zusätzliche Informationen
Zusammenfassungen (Abstracts), für die keine Volltexte zur Verfügung stehen
HTA = Health Technology Assessment. RCT = Randomisierte kontrollierte Studie, engl.: randomised controlled trial. SR = Systematische Übersichtsarbeit.
Wir führen eine systematische Literaturrecherche in den Datenbanken MEDLINE, EMBASE, Cochrane Library, in der Datenbank des Centre of Reviews and Dissemination und in der HTA Database durch. Der Recherchezeitraum reicht von 01. Januar 2004 bis März/April 2017. Die genauen Datumsangaben der Suchläufe sind in Tabelle 14 gelistet. Die durchsuchten Datenbanken und Schlagwortkombinationen sind im Anhang in Tabelle 84 dokumentiert.
|
Tabelle 14: Bibliografische Datenbanken domänenübergreifende Suche mit Zeitraum |
|||
|
# |
Datenbank |
Zeitraum |
Zeitraum eingeschlossen |
|
1 |
MEDINE via PubMed |
1946–2017 |
01.01.2004 bis 13.03.2017/KW 10 |
|
2 |
EMBASE via Ovid |
1988–2017 |
01.01.2004 bis 13.03.2017/KW 10 |
|
3 |
CRD Database |
1988–2017 |
01.01.2004 bis 13.04.2017/KW 14 |
|
4 |
The Cochrane Library |
1995–2017 |
01.01.2004 bis 23.03.2017/KW 11 |
|
5 |
CINAHL |
1937–2017 |
01.01.2004 bis 13.05.2017/KW 18 |
|
KW |
= Kalenderwoche. |
||
Für Publikationen, die zwischen April 2017 bis Oktober 2020 veröffentlicht wurden, wurde in Pubmed eine Aktualisierungsfunktion eingerichtet, sodass die Autoren regelmäßig per E‑Mail über neue Treffer informiert wurden. Möglicherweise relevante Titel wurden von einer Autorin (CS) durchgesehen und bei Bedarf im Volltext besorgt, um den Inhalt der jeweiligen Studie und die Referenzlisten der Veröffentlichung durchzusehen. Relevante Publikationen wurden in die Handsuche einbezogen.
Die Suchstrategie umfasst Freitextwörter und von der jeweiligen Datenbank abhängige, kontrollierte Begriffe aus deren Thesaurus (z. B. MESH-Terms in MEDLINE oder EMTREE in EMBASE).
Die Suchbegriffe zur domänenübergreifenden Suche enthalten eine Kombination der Begriffe für die Krankheit „Brustkrebs“ und für die Technologie „Mistel“. Die beiden Suchblöcke setzen sich jeweils aus den relevanten Begriffen und Verschlagwortungen zusammen, die der jeweiligen Datenbank angepasst werden. Die verwendeten Suchbegriffe sind im Anhang in Tabelle 85 dokumentiert. Die so identifizierten Referenzen werden in der Literaturselektion aller Domänen verwendet. Vor der Zusammenführung der Ergebnisse in eine EndNote X7 Bibliothek, werden jeweils die Referenzen, die älter sind als aus dem Jahr 2004, aussortiert.
Die Recherche zu Leitlinien umfasst sowohl große elektronische Datenbanken, mit der GIN Database, PubMed und EMBASE, als auch kleinere Datenbanken von Organisationen, mit der Cochrane Library, der NCCN Database (National Comprehensive Cancer Network) und der ESMO Database (ESMO = European Society for Medical Oncology).
Tabelle 15: Durchsuchte Webseiten der Internetsuche zu Leitlinien
|
Fachgesellschaft |
URL |
|
Guidelines International Network Database (GIN) |
|
|
European Society for Medical Oncology (ESMO) |
|
|
Leitlinienprogramm Onkologie |
www.leitlinienprogramm- onkologie.de/leitlinien/mammakarzinom |
|
Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) |
|
|
National Comprehensive Cancer Network (NCCN) |
-
3.1.2.3 Handsuche in Literaturverzeichnissen eingeschlossener Sekundär- und
Zusätzlich zur Datenbanksuche werden die Bibliografien aller später in die Informationssynthese eingeschlossenen Sekundär- und Primärstudien auf die Existenz weiterer, noch nicht identifizierter Sekundär- und Primärstudien, die die Einschlusskriterien erfüllen, von zwei Autoren unabhängig durchsucht, Diskrepanzen durch Diskussion ausgeräumt und gegebenenfalls in das Literaturverwaltungsprogramm aufgenommen.
-
3.1.2.4 Studienregister
Die Suche nach laufenden Studien dient zum einen der Abschätzung eines möglichen Publikationsbias, also einer selektiven Veröffentlichung von Studien, die statistisch signifikante Effekte einer Therapie nachweisen im Vergleich mit Studien, die solche Effekte nicht nachweisen. Zum anderen ist dies eine Möglichkeit abzuschätzen, ob die Fragestellungen dieses Berichts beforscht werden und ob zukünftig neue Evidenz zu erwarten ist. Für aufzufindende Studien in den Studienregistern gelten die gleichen Einschlusskriterien wie für publizierte RCT. Ausschlusskriterien und die Begrenzung des Publikationszeitraums auf 2004 und später sind bei den laufenden Studien irrelevant.
Die Suche in den Studienregistern erfolgt internetbasiert auf den jeweiligen Webseiten der Studienregister mit den in die Webseiten integrierten Suchmaschinen. Verwendete SuchbegriffsKombinationen waren „viscum album AND breast cancer“ und „mistletoe AND breast cancer“. Es wird in verschiedenen online zugänglichen Studienregistern nach registrierten randomisierten klinischen Studien zur Misteltherapie oder dem Wirkstoff viscum album bei Patientinnen mit Brustkrebs gesucht: ISRCTN registry, EORTC clinical trials, EORTC CT Database, ClinicalTrials.gov, EU Clinical Trials Register, Deutsches Register Klinischer Studien, International Standard Randomised Controlled Trial Number Register, International Clinical Trials Registry Platform/Search Portal, PROSPERO ‑International prospective register of systematic reviews, National Center for Complementary and Integrative Health und WHO International Clinical Trials Registry Platform Search Portal (siehe Tabelle 88 im Anhang).
Wenn keine Ergebnisse gefunden werden, was mitunter auf technische Gründe bei der Verwendung von Booleschen Operatoren zurückzuführen sein könnte, folgt je eine Suche zu „breast cancer“ oder „Brustkrebs“, je nach Sprache der Webseite, und zu „mistletoe“ oder „Mistel“. Eine Auflistung der Internetseiten mit den verwendeten Suchbegriffen ist im Anhang in Tabelle 88 Durchsuchte Studienregister aufgeführt.
Alle in der Internet- und Datenbanksuche identifizierten Leitlinien zu Brustkrebs werden als Volltext besorgt, sofern sie nicht bereits zurückgezogen sind. In der Regel werden Leitlinien, von denen bereits eine neuere Version existiert, zurückgezogen. Zwei Autoren (CS und PSI) bewerten die Leitlinien unabhängig voneinander daraufhin, ob die Einschlusskriterien erfüllt sind. Abweichende Urteile werden durch Diskussion gelöst.
Die in den Datenbanken identifizierten Literaturstellen werden inklusive Zusammenfassung in das Literaturverwaltungsprogramm EndNote Version X7 importiert. Bei Referenzen mit fehlenden Angaben zu Autor, Jahr oder Zusammenfassung, werden diese Angaben nach dem Import in EndNote ergänzt. Die Selektion erfolgt in einem zweistufigen Prozess. Zuerst werden Titel und Zusammenfassungen von zwei Autoren unabhängig darauf durchgesehen, ob sie die Ein- beziehungsweise Ausschlusskriterien erfüllen. Für Literaturstellen, die die Einschlusskriterien erfüllen oder bei denen dies anhand von Titel und Zusammenfassung nicht entschieden werden kann, werden Volltextpublikationen bestellt. Im zweiten Schritt werden die Volltextpublikationen wiederum von zwei Autoren unabhängig durchgesehen, ob sie den Ein- und Ausschlusskriterien entsprechen. Diskrepanzen in der Bewertung der Autoren werden in beiden Schritten durch Diskussion gelöst. Für alle im Volltext-Screening aus der Informationssynthese ausgeschlossenen Publikationen werden die Ausschlussgründe dokumentiert, siehe Abschnitt 9.2.
Die Selektion ist anhand des Flussdiagramms des „Preferred Reporting Items for Systematic Reviews and Meta-Analyses” (PRISMA)-Statements dargestellt (Abbildung 3 in Kapitel 4.1.2.1).
Für die in der Handsuche in den Literaturverzeichnissen eingeschlossener Studien identifizierten Primärstudien werden die Zusammenfassungen besorgt. Dann erfolgt die Beurteilung analog zum Vorgehen bei den in den bibliografischen Datenbanken identifizierten Referenzen unabhängig durch zwei Autoren. Diese so identifizierten Studien sind in Abbildung 3 im Feld „Handsuche“ erfasst.
Von den identifizierten Studien aus den Studienregistern werden die verfügbaren Beschreibungen von einem Autor heruntergeladen und in eine Word-Datei eingefügt. Als erstes wird geprüft, ob die Studie bereits veröffentlicht ist. Danach wird abgeglichen, ob diese Studie bereits über das Literaturreview identifiziert und auf Eignung bewertet ist. Für Studien, die noch nicht eingeschlossen sind, überprüfen zwei Autoren, ob die Einschlusskriterien erfüllt sind. Diskrepanzen werden durch Diskussion ausgeräumt.
Vor der Datenextraktion wird jeweils überprüft, ob mittlerweile eine aktuellere Fassung der Leitlinie vorliegt. Es wird immer nur die neueste Version einer Leitlinie verwendet.
Aus den Leitlinien werden folgende Merkmale in Tabellen extrahiert: Akronym, Titel, Herausgeber, Land, Publikationszeit, Evidenzgrad der Leitlinie, Empfehlungen zur Misteltherapie.
Die SR und HTA-Berichte werden daraufhin durchgesehen, ob sie weitere Primärstudien zur Wirksamkeit und Sicherheit enthalten, die über die Recherche in den bibliografischen Datenbanken nicht gefunden wurden. Ist dies der Fall, werden die Volltexte dieser Studien besorgt und auf die Erfüllung der Einschlusskriterien überprüft und gegebenenfalls dem Studienpool der Primärstudien hinzugefügt.
Aus den RCT werden folgende Merkmale in Tabellen extrahiert:
Fragestellung, Studientyp (Verblindung, Anzahl der Studienzentren), Ort und Zeit der Rekrutierung, Ein-und Ausschlusskriterien, Intervention (Art der Chemotherapie, auch Erst‑, Zweitlinientherapie gegebenenfalls weitere angewandte Therapien, Form der Misteltherapie), Vergleichsintervention (Art der Chemotherapie, ggf. weitere angewandte Therapien), Charakteristika der Studienpopulation (prognostische Faktoren: TNM-Klassifikation, Hormonrezeptorstatus), Anzahl der randomisierten, ausgewerteten und ausgeschiedenen Patienten für jeden Arm, Art der statistischen Analyse (z. B. Intention-to-treat-Analyse), Definition der Zielgrößen, Ergebnisse zu Zielgrößen: Effektschätzer und Unsicherheitsmaß.
Aus den Beobachtungsstudien werden folgende Merkmale extrahiert:
Fragestellung, Studientyp, Ort und Zeit der Rekrutierung, Ein- und Ausschlusskriterien, Art der Chemotherapie, auch Erst‑, Zweitlinientherapie ggf. weitere angewandte Therapien, Form der Misteltherapie in allen analysierten Gruppen, Charakteristika der Studienpopulation (prognostische Faktoren), Anzahl der eingeschlossenen, ausgewerteten und ausgeschiedenen Patienten für jede analysierte Vergleichsgruppe, Art der statistischen Analyse (z. B. Störgrößenadjustierung), Definition der Zielgrößen, Ergebnisse zu Zielgrößen: Effektschätzer und Unsicherheitsmaß.
Zur Bewertung der Leitlinien wird das Bewertungsinstrument AGREE II85 (AGREE = Appraisal of Guidelines for Research and Evaluation) verwendet. Bei der Qualitätsbewertung eingeschlossener Leitlinien liegt der Fokus auf der Methodik der Leitlinienerstellung. Deshalb beschränkt sich die Qualitätsbewertung auf Domäne 3 des AGREE II Tool: Genauigkeit der Leitlinienentwicklung.85 Diese Domäne umfasst folgende acht Fragen:
-
1. Es wurde systematisch nach Evidenz gesucht.
-
2. Die Kriterien für die Auswahl der Evidenz sind eindeutig beschrieben.
-
3. Die Stärken und die Schwächen der Evidenz sind eindeutig beschrieben.
-
4. Das methodische Vorgehen bei der Formulierung der Empfehlungen ist eindeutig beschrieben.
-
5. Der gesundheitliche Nutzen, Nebenwirkungen und Risiken wurden bei der Formulierung der Empfehlungen berücksichtigt.
-
6. Die zugrundeliegende Evidenz kann den Empfehlungen eindeutig zugeordnet werden.
-
7. Die Leitlinie wurde vor ihrer Veröffentlichung durch externe Expertinnen und Experten begutachtet.
-
8. Es existiert ein Verfahren zur Aktualisierung der Leitlinie.
Für jede der acht Fragen gibt es eine Likert-Antwortskala mit sieben verschiedenen Stufen. „1“ entspricht der Aussage „trifft überhaupt nicht zu“ und „7“ entspricht „trifft vollständig zu“. Die Stufen dazwischen werden in AGREE II nicht verbalisiert. Jede Leitlinie wird von zwei Autorinnen bewertet. Die maximal mögliche Punktzahl in Domäne 3 beträgt bei zwei Bewertern 112 Punkte. Die minimal mögliche Zahl 14 Punkte. Die erreichte Gesamtzahl wird als prozentualer Anteil der maximal möglichen Punktzahl dieser Domäne dargestellt:
Berechnete Punktzahl – minimal mögliche Punktzahl Maximal mögliche Punktzahl – minimal mögliche Punktzahl
Eine Bewertung der Studienqualität von SR und HTA-Berichten wurde nicht durchgeführt, da diese nur dem Auffinden weiterer geeigneter Primärstudien dienten. Für RCT erfolgt die Bewertung über das Risk of Bias Tool aus dem Cochrane Handbuch (Cochrane handbook 2011)83, sowohl auf Ebene der Studie als auch bezogen auf die einzelnen Zielgrößen. Je Studie werden die Zielgrößen für die Wirksamkeit und Sicherheit in einer Risk of Bias Tabelle zusammengefasst, in der bei den Kriterien zur Verblindung nach subjektiven und objektiven Zielgrößen unterschieden wird. Die Studienqualität von Beobachtungsstudien wird nicht über ein Bewertungsinstrument bewertet, sofern die Zielgrößen zur Sicherheit nur für die Mistelgruppe berichtet werden. Grund hierfür ist, dass sich die meisten Punkte bei der Bewertung des Verzerrungspotenzials auf einen Gruppenvergleich beziehen. Wenn für die Sicherheit der Misteltherapie keine Effekte geschätzt werden, beschränkt sich die Bewertung des Verzerrungspotenzials auf eine Verzerrung durch den Loss-to-follow-up und selektives Berichten. Dies wird deskriptiv berichtet.
Die Charakteristika der Leitlinien sowie deren Qualitätsbewertung werden zusammenfassend in Tabellen und Text beschrieben. Die Informationssynthese der Empfehlungen erfolgt in Textform.
Die Ergebnisse für die Primärstudien zur Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Brustkrebs werden in Evidenztabellen präsentiert und in zusammenfassenden Texten beschrieben. Zur zusammenfassenden Beschreibung von Patientencharakteristika und Zielgrößen aus mehreren Studien werden sofern relevant, Median und Spannweite berechnet. Gegebenenfalls kann auch der Median aus klassierten Daten berechnet werden.86 Metaanalysen können für die Evidenz aus RCT durchgeführt werden, wenn die Heterogenität der Studien nicht zu groß ist. Falls Metaanalysen durchgeführt werden, wird das Softwareprogramm Review Manager® der Cochrane Collaboration und zum Testen der Heterogenität der dort verfügbare Chi2-Test, als Maß für die Stärke der Heterogenität das Inkonsistenzmaß I2 verwendet. Wenn Metaanalysen sinnvoll erscheinen, werden für dichotome Zielgrößen als Effektmaß das Relative Risiko, für Überlebenszeitdaten das Hazard Ratio und für kontinuierliche Zielgrößen mit unterschiedlichen Skalen wie dies z. B. bei Lebensqualität-Scores der Fall ist, die standardisierte Mittelwertdifferenz verwendet.
Zur Bewertung der Kosten und der Kosteneffektivität wird ein SR in analogen Schritten zur medizinischen Bewertung durchgeführt. Die Einschlusskriterien für gesundheitsökonomische Studien werden um den Zeithorizont der Analyse und die gesundheitsökonomische Perspektive, aus der die Evaluation durchgeführt wird, ergänzt. Brustkrebs ist eine chronische, lebenslange Krankheit und dementsprechend sollte der Zeithorizont der Analyse lebenslang sein. Grundsätzlich wird in deutschen und internationalen Empfehlungen für gesundheitsökonomische Evaluationen meistens die gesamtgesellschaftliche Perspektive empfohlen, in die alle Kosten und Effekte einbezogen werden, unabhängig davon, wer sie trägt. Weit verbreitet ist auch die Evaluation aus der Perspektive des Gesundheitssystems, in der nur Kosten und Effekte, die für das Gesundheitssystem anfallen, einbezogen werden. Im Fall der Misteltherapie erscheint auch eine Evaluation aus der Patientinnenperspektive sinnvoll, weil im Fall der adjuvanten Behandlung die Patientin die Kosten zu tragen hat. Aufgrund der zu erwartenden spärlichen Studienlage werden hinsichtlich Perspektive und Zeithorizont für die Einschlusskriterien zwar keine Einschränkungen festgelegt, diesen Aspekten wird jedoch in der Bewertung der Studienqualität Rechnung getragen. Es werden ausschließlich Studien aus Deutschland einbezogen, weil gesundheitsökonomische Ergebnisse aus anderen Ländern in der Regel nicht auf das deutsche Gesundheitssystem übertragen werden können.87–95
Für die Bewertung der gesundheitsökonomischen Aspekte zur begleitenden Misteltherapie bei Patientinnen mit Brustkrebs werden Kostenanalysen oder vollständige gesundheitsökonomische Evaluationen einbezogen (siehe Tabelle 16), die sich auf den deutschsprachigen Raum beziehen. Entsprechend des Vorgehens bei der medizinischen Bewertung werden auch Studien zu anderen Krebserkrankungen eingeschlossen, wenn die Ergebnisse zu Brustkrebs im Vergleich zur Standardtherapie allein getrennt dargestellt und entnehmbar sind. Gesundheitsökonomische Studien zu komplementärer Medizin im Allgemeinen ohne konkrete Angaben zu den Kosten der Misteltherapie werden ausgeschlossen.
Für einen Einschluss muss mindestens eine der in Tabelle 16 aufgelisteten Zielgrößen berichtet werden.
Tabelle 16: Einschlusskriterien für gesundheitsökonomische Studien
|
Forschungsfrage |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung). Es kann sich auch um ein Teilkollektiv der Studie handeln, wenn die Ergebnisse getrennt für das relevante Kollektiv berichtet werden. |
|
Intervention |
Therapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Standardtherapie mit oder ohne Placebogabe |
|
Zielgrößen |
Inkrementelle Kosten (direkte und indirekte) der begleitenden Misteltherapie Inkrementelle Kosten (direkte und indirekte) pro gewonnenem qualitätsadjustierten Lebensjahr Zusätzliche Kosten (direkte und indirekte) pro gewonnenem Lebensjahr |
|
Studientypen |
Kostenanalysen, Kosten-Minimierungs-Analysen, Kosten-Konsequenzen Analysen, Kosteneffektivitätsanalysen, Kosten-Nutzwert-Analysen Kosten-NutzenAnalysen |
|
Zeithorizont |
Keine Einschränkung |
|
Perspektive |
Keine Einschränkung Gesundheitssystem, gesamtgesellschaftlich, Patient |
|
Setting |
Deutschsprachiger Raum |
|
Sprachen |
Deutsch, Englisch |
Da die Literaturrecherche zur medizinischen Bewertung in den bibliografischen Datenbanken in der Suchstrategie keine einschränkende Verknüpfung mit Studientypen vorgenommen hat, können diese Rechercheergebnisse auch als Ausgangsmaterial für die Identifizierung von gesundheitsökonomischen Studien verwendet werden. Die Selektion der Studien wird anhand der Einschlusskriterien für gesundheitsökonomische Studien und ansonsten analog zur medizinischen Bewertung vorgenommen. Auch hier wird ein PRISMA-Flussdiagramm zur Abbildung der Studienselektion erstellt (siehe Abbildung 4 in Kapitel 4.2).
In die Informationssynthese eingeschlossene Studien werden in systematischen Kurzbeschreibungen zusammengefasst. Die Beschreibung der Ziele, des Studiendesigns und der Ergebnisse jeder gesundheitsökonomischen Studie erfolgt entsprechend der „Dokumentationsstruktur für die standardisierte Berichterstattung von gesundheitsökonomischen Primärstudien und Synthesen von Primärstudien”, festgelegt von der „German Scientific Working Group Technology Assessment for Health Care“ (Tabelle 109).96 Die standardisierten Berichte basieren auf den Informationsaufbereitungsstrukturen der Datenbanken DARE und NEED und wurden an die Themenbereiche des Kriterienkatalogs angepasst.
Aus den berücksichtigten Studien werden die relevanten qualitativen Merkmale extrahiert und standardisiert wiedergegeben. Die Struktur der extrahierten Daten entspricht dem von der German Scientific Working Group Technology for Health Care entwickelten Raster zur standardisierten Berichterstattung der wesentlichen methodischen Merkmale und Ergebnisparameter in den Einzelstudien.96 Die qualitativen Merkmale umfassen die Identifikation (Autor, Jahr, Land), den Evaluationstyp und die Perspektive der gesundheitsökonomischen Evaluation, Merkmale der Zielpopulation, das Setting, die zu vergleichenden Technologien, die Wirkungsdimension beziehungsweise den Zeithorizont, den Ursprung der klinischen Effektdaten (Originalstudie, Literaturstudie, mit beziehungsweise ohne entscheidungsanalytische Modellierung), die Berücksichtigung von Nutzwerten (z. B. QALY), die berücksichtigten Kostenkomponenten, Art und Erhebung des Mengengerüstes, Art und Quelle der Preise, Währung und Bezugsjahr, Diskontierungsraten, Behandlung von Unsicherheiten (Variablen der Sensitivitätsanalysen) und die Autorenschlussfolgerungen. Außerdem werden die in den Publikationen diskutierten oder im Rahmen der Bewertung der Studienqualität aufgefallenen Biastypen systematisch dokumentiert. Als quantitative Ergebnisparameter werden systematisch extrahiert und berichtet: Kosten (individuell oder populationsaggregiert), Wirksamkeit, Kosten-Effektivitäts-Verhältnis und durchschnittliche und/oder inkrementelle Werte für jede der in den einzelnen Studien untersuchten Vergleichstechnologien, soweit die Parameter jeweils in den Publikationen der berücksichtigten Studien vorhanden oder berechenbar sind. Die qualitativen Studienmerkmale und die quantitativen Ergebnisparameter werden systematisch in Tabellenform zusammengestellt und im Text berichtet.
Die eingeschlossenen Studien werden anhand des 56 Punkte umfassenden Kriterienkatalogs zur methodischen Qualität gesundheitsökonomischer Studien bewertet. Dieser Kriterienkatalog wurde von verschiedenen gesundheitsökonomischen Projektgruppen der German Scientific Working Group Technology Assessment in Health Care im Konsensverfahren erstellt (siehe Anhang Tabelle 109).96
Qualitative Studiencharakteristika und quantitative Ergebnisparameter der eingeschlossenen Studien werden systematisch in Evidenztabellen zusammengefasst. Neben der Angabe des zugrundeliegenden ökonomischen Studientyps sind dies die Art der eingeschlossenen Kosten und – sofern vorhanden – die inkrementellen Kosten, die inkrementelle Effektivität und das inkrementelle Kosten-EffektivitätsVerhältnis.
Es wird ein SR zu Patienten- und sozialen Aspekten durchgeführt. Neben an quantitativen Zielgrößen orientierten Studien werden auch Studien mit qualitativem Studiendesign in die Auswertung einbezogen. Quantitative Ergebnisse sind zu erwarten von Querschnittstudien zur Inanspruchnahme der Misteltherapie und Studien zu Einstellungen und Erfahrungen, die beispielsweise in Likert-Skalen (Aussage plus abgestufte Antwortmöglichkeiten wie „trifft zu“, „trifft eher zu“, „trifft eher nicht zu“, „trifft nicht zu“) abgefragt werden. Qualitative Studien werden einbezogen, um Fragen zum Versorgungsprozess, dessen Wahrnehmung, der Bedeutung für die Patientin und die Akzeptanz, Angemessenheit und Zufriedenheit mit der Misteltherapie vertieft zu beantworten. Das SR zu Patienten-und sozialen Aspekten erfordert eine Integration quantitativer und qualitativer Studienergebnisse. Es gibt mehrere Leitfäden, die sich mit der Methodik solcher Übersichtsarbeiten im Kontext der Bewertung von Gesundheitstechnologien befassen, die hier herangezogen werden: Die Cochrane Qualitative and Implementation Methods Group Guidance Serie, das Cochrane Handbuch und die Serie zur Anwendung von GRADE-CERQual für SR.97–100
Für Fragestellungen zu Patienten- und sozialen Aspekten der begleitenden Misteltherapie bei Patientinnen mit Brustkrebs werden quantitative und qualitative Studien aller Art einbezogen, auch SR und Primärstudien, sofern diese wissenschaftlich publiziert sind. SR werden eingeschlossen, wenn für die Domäne „Patienten- und soziale Aspekte” der begleitenden Misteltherapie relevante Informationen enthalten sind und die Ergebnisse für Patientinnen mit Brustkrebs mit Misteltherapie getrennt entnehmbar sind. Auch Studien zu verschiedenen Krebsarten oder KIM-Verfahren oder verschiedenen komplementären Therapien werden verwendet, wenn sowohl für die Gruppe der Patientinnen mit Brustkrebs als auch für die Misteltherapie die Ergebnisse getrennt dargestellt und entnehmbar sind. Wenn die Ergebnisse nicht getrennt entnommen werden können, muss der Anteil der für den HTA relevanten Studienpopulation bei mindestens 80 % der gesamten Studienpopulation liegen.
Wir nehmen an, dass patienten-bezogene Aspekte und soziale Aspekte in der Gesundheitsversorgung auch maßgeblich vom kulturellen Umfeld abhängig sind, und beschränken deshalb die Zielpopulation auf den deutschsprachigen Raum. Auch Studien ohne Vergleichsarm werden einbezogen, da viele der Zielgrößen, wie Erwartungen an die Misteltherapie oder Art, Umfang und Bewertung der Patientinneninformation zur begleitenden Misteltherapie, keinen Vergleich erfordern. Die Studien müssen eine ausreichend hohe Berichtsqualität aufweisen, damit die Methodik der Datenerhebung und die Ergebnisse nachvollzogen werden können. Kommentare zu Veröffentlichungen, Konferenzbeiträge in Form einer Zusammenfassung oder Aufsätze werden ausgeschlossen.
Es werden nur Studien eingeschlossen, die Informationen zu Patienten- oder sozialen Aspekten berichten. Mindestens eine der in Tabelle 17 gelisteten relevanten Zielgrößen muss in den Veröffentlichungen dargestellt sein. Für die Durchsicht der Titel und Zusammenfassungen ist es ausreichend, wenn zumindest ein Anhaltspunkt dafür gegeben ist, dass mindestens einer der Aspekte in der Veröffentlichung berichtet wird.
Die Zielgrößen können sowohl aus der Perspektive der Patientinnen beschrieben werden als auch aus der Perspektive der betreuenden Person, der Familienangehörigen oder des behandelnden medizinischen Fachpersonals.
Tabelle 17: Einschlusskriterien für Studien zu Patienten- und sozialen Aspekten
|
Forschungsfrage |
|
|
Population |
Patientinnen mit metastasiertem Mammakarzinom (palliative Behandlung) Patientinnen mit nicht-metastasiertem Mammakarzinom (adjuvante Behandlung) Angehörige von Patientinnen mit Brustkrebs Patientinnen mit Brustkrebs behandelnde Ärztinnen und Ärzte (jeweils im deutschsprachigen Raum) |
|
Intervention |
Therapie mit Mistelpräparaten (subkutan, intravenös, ins Tumorgewebe, ins Rippenfell) zusätzlich zur Standardtherapie |
|
Vergleichsintervention |
Kein Vergleichsarm Standardtherapie mit oder ohne Placebogabe |
|
Zielgrößen |
Einstellung gegenüber/Akzeptanz der begleitenden Misteltherapie Erwartungen an die begleitende Misteltherapie Wissen über die begleitende Misteltherapie Inanspruchnahme der begleitenden Misteltherapie Zugang zur Misteltherapie für verschiedene Patientengruppen Erfahrungen mit der begleitenden Misteltherapie Zufriedenheit mit der begleitenden Misteltherapie im Alltagsleben Art, Umfang und Bewertung der Patientinneninformation zur begleitenden Misteltherapie Bewertung der Arzt-Patienten-Kommunikation hinsichtlich der begleitenden Misteltherapie Besondere Punkte, die kommuniziert werden sollen, um adäquate Inanspruchnahme zu gewährleisten |
|
Studientypen |
SR qualitativer und quantitativer Studien zu oben genannten Fragestellungen und Zielgrößen Qualitative und quantitative Primärstudien zu oben genannten. Fragestellungen und Zielgrößen |
|
Perspektiven (falls relevant) |
Patientinnen, Betreuende Person/Familienangehörige, Ärzte |
SR = Systematische Übersichtsarbeit.
Die Operationalisierung der Zielgrößen für die Ein- und Ausschlusskriterien erfolgte in Anlehnung an die in den „Assessment elements“ gestellten Fragen der Domäne Patienten- und soziale Aspekte im EUnetHTA HTA Core Model®.71
Die Literaturrecherche umfasst die Suchergebnisse aus der domänenübergreifenden Suche in den bibliografischen Datenbanken (siehe Abschnitt 3.1.2.1) sowie einer Reihe an zusätzlichen Suchen in weiteren bibliografischen Datenbanken, die auch sozialwissenschaftliche und psychosoziale
Themenbereiche erfassen und der Suche nach grauer Literatur im Internet. Auch die in der Suche zur ethischen Bewertung (siehe Abschnitt 3.4) identifizierten Referenzen sowie die Leitlinien zur Brustkrebsbehandlung, werden auf ihre Verwendbarkeit für die Beantwortung der Fragen zu Patienten-und sozialen Aspekte durchgesehen. Schließlich erfolgt eine Handsuche nach zusätzlichen Primärstudien in den Literaturverzeichnissen der eingeschlossenen Studien.
Die domänenübergreifende Suche ist in Kapitel 3.1.2.1 „Bibliografische Datenbanken“ konkret beschrieben. Ergänzt wird diese Suche durch Suchstrategien, die auch Quellen heranziehen, die nicht nur den medizinischen Bereich abdecken, sondern auch andere Fachbereiche wie Psychologie oder Ökonomie, um Patienten- und soziale Aspekte auch von einer anderen Perspektive abzubilden als über mehrheitlich englischsprachige, einschlägig medizinische Datenbanken. Die verwendeten Suchbegriffe in der ergänzenden Suche sind weniger systematisch und strukturiert als die domänenübergreifende Suche, weil die Suchbegriffe den Anforderungen der jeweiligen Suchfunktion angepasst werden, um Ergebnisse mit Bezug zu komplementärer und alternativer Medizin zu erhalten. Da soziale Aspekte in der Regel nicht über kontrollierte Thesaurussuchbegriffe verschlagwortet sind, werden einige Freitextbegriffe zu Patienten- und sozialen Aspekten im Suchterm ergänzt. Diese Freitextbegriffe ergeben sich aus einer Kombination von Begriffen, die sich thematisch auf die gesuchten Zielgrößen zu Patienten- und sozialen Aspekten beziehen, wie sie in den Einschlusskriterien in Tabelle 17 aufgeführt sind.
Über EBSCO werden die Datenbanken PsycINFO, PsycARTICLES, CINAHL Complete und Academic Search Élite und über Ovid die Datenbanken Books@Ovid, Journals@Ovid Full Text, BIOSIS Previews, Embase und Ovid MEDLINE(R) durchsucht. Die ausführliche Recherchestrategie ist im Anhang zu finden: Tabelle 92 zu den Datenbanken, die in die Suche über Ovid integriert sind; in Tabelle 94 Datenbanken, die Teil der Suche über EBSCO sind. Zudem wird in der fachbereichsübergreifenden Datenbank Web of Science gesucht. Details hierzu befinden sich im Anhang in Tabelle 91, in der Suchbegriffe zu Patienten- und sozialen Aspekten gelistet sind.
Im August 2020 wird zusätzlich auf Empfehlung eines Gutachters eine Suche in Datenbanken für Komplementärmedizin Allied and Alternative Medicine (AMED) und Alt HealthWatch via EBSCO durchgeführt. Die verwendeten Suchbegriffe befinden sich im Anhang in Tabelle 95.
Für den Zeitraum von Mai 2017 bis Oktober 2020 wurden regelmäßige Update-Suchen in Pubmed durchgeführt. Möglicherweise relevante Titel wurden von einer Autorin (CS) durchgesehen und falls die Einschlusskriterien erfüllt erschienen oder dies anhand der Zusammenfassung (des Abstract) nicht geklärt werden konnte im Volltext besorgt, um den Inhalt der jeweiligen Studie und die Referenzlisten der Veröffentlichung durchzusehen. Diese neuen Treffer wurden behandelt wie zusätzliche Veröffentlichungen aus der Handsuche.
33.2.2 Internetrecherche
Zur Identifizierung relevanter Internetseiten zu Fachgesellschaften, HTA-Institutionen und anderen Quellen, die möglicherweise Informationen zu integrativer Onkologie und Mistelextrakten beinhalten könnten, wird in erster Linie auf die Checkliste „Grey Matters – A Practical Search Tool for Evidence Based Medicine” zurückgegriffen, die vom Informationsdienst der kanadischen HTA-Agentur Canadian Agency for Drugs and Technologies in Health (CADTH) veröffentlicht wurde.101 Zudem wird gezielt nach potenziell relevanten Publikationen auf den Internetseiten von Fachgesellschaften gesucht.
Tabelle 19 fasst die Internetsuche zusammen. Jeder der Suchläufe ist im Anhang im Detail dokumentiert inklusive der verwendeten Suchbegriffe und der Anzahl an gefundenen Referenzen. Die vollständige Suchstrategie zur grauen Literatur ist im Anhang in Tabelle 90 dokumentiert.
Tabelle 18: Durchsuchte Internetseiten zu Patienten- und sozialen Aspekten der Misteltherapie
|
Gesellschaft/Organisation |
Website |
|
Cam on Pubmed |
www.ncbi.nlm.nih.gov/pubmed?&orig_db=PubMed&cmd_cur rent=Limits&pmfilter_Subsets=Complementary %20Medicine |
|
PubMed „social aspects“ |
|
|
Karger Verlag (2008 bis 2016) enthaltene Journals: Forschende Komplementärmedizin; Complementary Medicine Research; Oncology Research and Treatment; Translational Research in Biomedicine; Schweizerische Zeitschrift für Ganzheitsmedizin |
|
|
PRiO: Prävention und integrative Onkologie. Eine Arbeitsgemeinschaft der Deutschen Krebsgesellschaft |
www.prio-dkg.de/wissenschaftliche-informationen/komplementaere-und-alternative-medizin |
|
CADTH/Grey Matters |
CADTH = Canadian Agency for Drugs and Technologies in Health. CAM = Komplementäre und alternative Medizin.
Die Internetseite der Arbeitsgemeinschaft PRiO der deutschen Krebsgesellschaft hat keine Suchmaschine. Die Entscheidung, ob eine Publikation vorerst in die Durchsicht einbezogen wird, erfolgt anhand des Titels.
Der Verlag Karger wird gewählt, um häufig zitierte deutschsprachige Zeitschriften abzudecken wie „Forschende Komplementärmedizin“ und die „Schweizer Zeitschrift für Ganzheitsmedizin“. Da die Internetseite des Karger-Verlags eine Suchmaske besitzt, die in mehreren Fachzeitschriften gleichzeitig suchen kann, werden weitere Zeitschriften des Verlags hinzugefügt, die relevant erscheinen. Die Titel der Zeitschriften sind Tabelle 90 zu entnehmen.
Eine ausführliche Dokumentation der Suche auf Webseiten aus der „Grey Matters“-Checkliste101 mit verwendeten Suchbegriffen und Anzahl der Treffer ist in Tabelle 93 gelistet. Wenn Konferenz-Abstracts zu möglicherweise relevanten Studien in den Datenbanksuchen identifiziert werden, für die keine Volltextpublikationen vorhanden sind, wird nach möglichen Folgepublikationen gesucht. Für Autoren der eingeschlossenen Publikationen wird in deren Publikationslisten oder auf der Website des jeweiligen Lehrstuhls nach weiteren Publikationen zum Thema gesucht.
Aufgrund der schlechten Verschlagwortung in bibliografischen Datenbanken hat die Handsuche bei der Domäne Patienten- und soziale Aspekte einen besonderen Stellenwert. Im Rahmen der Durchsicht der eingeschlossenen Volltexte werden zusätzlich nicht nur alle Referenzlisten nach potenziell relevanten Publikationen durchsucht, sondern es wird auch nach weiteren Publikationen von Autoren der eingeschlossenen Literatur gesucht. Dies erfolgt entweder über die Autorensuche in PubMed oder die Durchsicht der Publikationslisten auf den jeweiligen Internetseiten der Lehrstühle, denen die Autoren angehören, sofern diese den Bereich der integrativen Medizin betreffen.
Die in den Datenbanken identifizierten Literaturstellen und die zusätzlich über das Internet identifizierten Referenzen werden wie bei der Suche zur medizinischen Wirksamkeit und Sicherheit in das Literaturverwaltungsprogramm EndNote Version X7 importiert. Bei Referenzen mit fehlendem Titel oder fehlender Zusammenfassung, werden diese Angaben ergänzt. Die Selektion erfolgt in einem zweistufigen Prozess. Zuerst werden Titel und Zusammenfassungen von zwei Autoren unabhängig darauf durchgesehen, ob sie die Ein- beziehungsweise Ausschlusskriterien erfüllen. Für Literaturstellen, die die Einschlusskriterien erfüllt haben oder bei denen dies anhand von Titel und Zusammenfassung nicht eindeutig entschieden werden kann, werden Volltexte besorgt.
Zwei Autorinnen bewerten die Volltexte unabhängig voneinander, ob die Einschlusskriterien erfüllt werden. Die Selektion der Studien wird anhand der Einschlusskriterien für Studien zu Patienten- und sozialen Aspekten vorgenommen, wie in Tabelle 17 beschrieben. Diskrepanzen werden durch Diskussion ausgeräumt.
Die Studienselektion ist in Kapitel 4.3 „Ergebnisse der Literatursuche und ‑Selektion zu Patienten- und sozialen Aspekten” in Abbildung 5 dargestellt. Für die in der Handsuche in den Literaturverzeichnissen eingeschlossener Studien identifizierten Primärstudien werden die Zusammenfassungen besorgt. Die Beurteilung der Texte erfolgt durch zwei Autoren unabhängig analog zum Vorgehen bei der Bewertung der medizinischen Wirksamkeit und Sicherheit. Diese so identifizierten Studien sind in auch im PRISMADiagramm in Abbildung 5 erfasst.
Aus den quantitativen und qualitativen Studien werden, soweit verfügbar, folgende Merkmale zu den Studiencharakteristika in Übersichtstabellen extrahiert:
Fragestellung, Studientyp, Ort und Zeit der Rekrutierung, Ein- und Ausschlusskriterien, Art der Standardtherapie, auch Erst‑, Zweitlinientherapie und ggf. weitere angewandte Therapien, Form der Misteltherapie in allen analysierten Gruppen, Charakteristika der Studienpopulation, Anzahl der eingeschlossenen, ausgewerteten und ausgeschiedenen Patienten.
Für quantitative Zielgrößen werden zusätzlich Tabellen extrahiert zu folgenden Merkmalen: Anzahl der eingeschlossenen, ausgewerteten und ausgeschiedenen Patienten für jede analysierte Vergleichsgruppe, Art der statistischen Analyse (z. B. Störgrößenadjustierung), Definition der Zielgrößen und Ergebnisse zu Zielgrößen (Effektschätzer und Unsicherheitsmaß). Falls RCT zu analysieren sind, wird die Methodik analog zur medizinischen Wirksamkeit erfolgen wie im Kapitel 3.1.4.2 beschrieben.
Für die Datenextraktion der Ergebnisse qualitativer Studien, mit dem Ziel eine thematische Inhaltsanalyse durchzuführen, wird die Software MAXQDA 18102, verwendet. Es handelt sich dabei um ein Literaturverwaltungs- und Analyseprogramm. Es ermöglicht die Erstellung von Tabellen und vereinfacht die Strukturierung von Kodierungen des zu analysierenden Inhalts. Die Software an sich hat keinen Einfluss auf den Inhalt der Auswertung und verändert das Datenmaterial nicht. Die Texte werden als PDF in die Software hochgeladen. Das Programm ermöglicht das Markieren von Textteilen, die Vergabe von Kodierungen zu markierten Textteilen und die Zusammenfassung von ähnlichen Kodierungen zu Kategorien.
Weitere Ausführungen zum methodischen Vorgehen bei der thematischen Inhaltsanalyse folgen in Abschnitt 3.3.6 zur Analyse und Informationssynthese.
Zur Bewertung des Verzerrungspotenzials der quantitativen und qualitativen Primärstudien auf Studienebene werden die Checklisten des „Critical Appraisal Skills Programme” (CASP)103, 104 verwendet. Die CASP-Checklisten sind ein studientyp-spezifisches Bewertungsinstrument für die Bewertung von Publikationen, das von der Cochrane Qualitative and Implementation Methods Group empfohlen wird.105,106 Da es für diese Checklisten keine offizielle deutsche Übersetzung gibt, werden die englischen Checklisten von einer der Autorinnen (CS) übersetzt (siehe Kapitel 9.3, Tabelle 110 für die qualitativen Studien und
Tabelle 111 für Kohorten- beziehungsweise Querschnittstudien). Bei der Übersetzung ins Deutsche gab es kleinere Anpassungen in der Wortwahl, um den Sinn richtig abzubilden. Die Erläuterungen zur Bewertung wurden wie im englischsprachigen Original beschrieben verwendet.
Die CASP-Checkliste für qualitative Studien103 wurde unverändert verwendet. Für Querschnittstudien gibt es keine eigene CASP-Checkliste. Daher wird für diese Studientypen die Checkliste für Kohortenstudien als Grundlage verwendet und angepasst auf Kriterien, die für Querschnittstudien anwendbar sind. Dadurch entfallen die Fragen K5a, K5b, K6a, K6b, K8, K11 und K12. Die modifizierte Checkliste mit Kommentaren und Begründungen zu Änderungen ist in
Tabelle 111 zu finden. Die Qualität der SR wird nicht bewertet, weil diese selbst nicht in die Analyse eingeschlossen, sondern nur zur Durchsicht nach potenziell relevanten Studien verwendet werden.
Die Ergebnisse der CASP-Checklisten werden in systematischen Übersichtstabellen zusammengefasst und in Textform dargestellt.
Die Ergebnisse für die quantitativen Primärstudien zu Patienten- und sozialen Aspekten der begleitenden Misteltherapie bei Brustkrebs werden in Evidenztabellen präsentiert und in zusammenfassenden Texten beschrieben. Zur zusammenfassenden Beschreibung von Patientencharakteristika und Zielgrößen aus mehreren Studien werden, sofern relevant, Median und Spannweite berechnet. Gegebenenfalls kann auch der Median aus klassierten Daten berechnet werden.86
Ein wichtiges Kriterium für die Auswahl der Analyse- und Synthesemethode im Kontext von SR über Gesundheitstechnologien ist eine transparente und nachvollziehbare Ableitung der Ergebnisse aus dem Datenmaterial. Der vorliegende Bericht orientiert sich hier an den Empfehlungen der Cochrane Arbeitsgruppe „Cochrane Qualitative and Implementation Methods Group“.99, 105–109 Die Ergebnisse für die quantitativen und qualitativen Studien zu den Patienten- und sozialen Aspekten der begleitenden Misteltherapie bei Brustkrebs werden getrennt voneinander in Tabellen und in zusammenfassenden Texten beschrieben. Publikationen, die quantitative Ergebnisse berichten, werden exzerpiert und zusammengefasst. Die Ergebnisse der qualitativen Studien werden mittels thematischer Synthese (thematic synthesis)110, einer Form der qualitativen Inhaltsanalyse, ausgewertet.111, 112 Ziel der thematischen Synthese ist es, die Ergebnisse aus qualitativen Studien hinsichtlich der Fragestellung der Übersichtsarbeit und den Zielgrößen zu den Patienten- und sozialen Aspekten zu integrieren.100
Bei der qualitativen Inhaltsanalyse ergeben sich die Zielgrößen aus dem Kodierungsprozess. Die Kategorien und Codes für den Beginn des Kodierungsprozesses, werden deduktiv aus dem EUnetHTA HTA Core Model®71 beziehungsweise aus den Fragestellungen zu den Patienten und den sozialen Aspekten abgeleitet (siehe Tabelle 19) und bilden einen Kodierleitfaden. Zeile für Zeile werden die Ergebnisteile der Publikationen zu den qualitativen Studien mit einzelnen Codes kodiert. Jedem Aspekt, den Patientinnen oder Ärztinnen und Ärzte nennen, wird ein Code zugeordnet. Diese einzelnen Textteile zu einem Code werden Kodierung genannt. Ein Code kann aus einem oder aus mehreren Kodierungen bestehen, die jeweils ein Ankerbeispiel für den Code darstellen. Über das induktive Kodieren Zeile für Zeile im Textmaterial der eingeschlossenen Publikationen werden neue Codes zum Kategoriensystem ergänzt und die Kategorien weiter spezifiziert (z. B. Ausprägungen der Akzeptanz der Misteltherapie). Falls die vorgegebenen Kategorien nicht ausreichen, um den Inhalt adäquat zu erfassen, werden neue Kategorien gebildet. Neue Codes werden zum bereits bestehenden Kategoriensystem (entspricht dem Kodierleitfaden) hinzugefügt, indem sie entweder einer bestehenden Unterkategorie zugeordnet werden oder es entstehen neue Unterkategorien. Wenn für bestehende Unterkategorien keine Kodierung in den Publikationen zu finden ist, werden diese entfernt. Ergebnis ist ein thematisch gegliedertes Kategoriensystem aus drei Ebenen: die Hauptkategorien, Unterkategorien und einzelne Codes. Nach jeder Überarbeitungsrunde folgt eine Diskussionsrunde (zwischen CS und PSI) zur Überprüfung auf die Konsistenz der Interpretation der deskriptiven und entwickelten analytischen Themen100 und zur Entscheidung, ob eine weitere Überarbeitung der Kodierung der Texte notwendig ist. Das Vorgehen wird auch als axiales Kodieren bezeichnet.
Die identifizierten deskriptiven und entwickelten analytischen Themen werden in Tabellen und Textform dargestellt.
|
Kategorie |
Code (Subkategorie) |
|
Patientenaspekte |
Einstellung gegenüber und Akzeptanz der Misteltherapie |
|
Patientenaspekte |
Erwartungen an die Misteltherapie |
|
Patientenaspekte |
Wissen über die Misteltherapie |
|
Patientenaspekte |
Inanspruchnahme der Misteltherapie |
|
Patientenaspekte |
Erleben der Misteltherapie |
|
Patientenaspekte |
Zufriedenheit mit der Misteltherapie |
|
Patientenaspekte |
Vorerfahrung von Familie und Angehörigen |
|
Patientenaspekte |
Vorerfahrung von Patienten |
|
Gesellschaftliche Aspekte |
Zugang zur Misteltherapie (Infrastruktur und finanziell) |
|
Gesellschaftliche Aspekte |
Zugangsbeschränkungen; Verhinderung des Zugangs zur Misteltherapie |
|
Kommunikationsaspekte |
Art, Umfang und Bewertung Patientinneninformation |
|
Kommunikationsaspekte |
Art und Umfang der Arzt-Patienten-Kommunikation |
|
Kommunikationsaspekte |
Bewertung der Arzt-Patienten-Kommunikation aus Sicht des Patienten |
|
Kommunikationsaspekte |
Bewertung der Arzt-Patienten-Kommunikation aus Sicht des Arztes |
Die ethische Bewertung besteht aus drei Teilen. Im ersten Teil wird recherchiert, ob bereits bestehende Empfehlungen oder Leitlinien zum Umgang mit den genuin ethischen Aspekten der Misteltherapie bei Brustkrebs vorliegen. Im zweiten Teil wird ein SR durchgeführt, das das Ziel verfolgt, ethische Aspekte bei der Misteltherapie bei Brustkrebs zu identifizieren. Hierfür wird die eingeschlossene Literatur mittels Methoden der qualitativen Inhaltsanalyse ausgewertet. In einem dritten Teil werden die Ergebnisse der Literaturrecherche anhand des Rahmengerüsts von Strech und Marckmann (siehe 1.1.1.2), den für Medizin und Public Health relevanten ethischen Prinzipien (kurz: Nutzen, Schaden, Effizienz (Kosten), Gerechtigkeit, Selbstbestimmung und Legitimität) zugeordnet. Dieses Rahmengerüst wird bevorzugt, da es für die Zwecke von HTA konkreter ausgelegt ist als beispielsweise der weitverbreitete Vier-Prinzipien-Ansatz (der aber zweifellos im Rahmengerüst wiederzufinden ist). Zudem werden auf Basis theoretischer Reflexion weitere Aspekte hinzugefügt.
Für die Identifizierung bestehender Leitlinien oder Empfehlungen wurden mittels Google Search mögliche relevante (Fach-)Gesellschaften oder Organisationen in Westeuropa (vor allem deutschsprachiger Raum aufgrund der dortigen Verbreitung von Anthroposophie und Homöopathie) und Vereinigten Staaten gesucht, dann deren Websites nach Empfehlungen oder Orientierungen in Bezug auf die ethischen Aspekte von (palliativer) Misteltherapie bei Brustkrebs durchforstet. Ebenso wurde direkt mit entsprechenden Suchbegriffen nach ethischen Empfehlungen oder Leitlinien gesucht. Die folgende Tabelle gibt Auskunft über die gefundenen Gesellschaften oder Organisationen und deren Internetseiten.
Tabelle 20: Internetseiten, die nach Leitlinien zu ethischen Aspekten der Misteltherapie durchsucht wurden
|
Gesellschaft/Organisation |
Website |
|
Anthroposophical Society, England |
|
|
Anthroposophical Society, USA |
|
|
Anthroposophische Gesellschaft inDeutschland |
|
|
British Homeopathic Association |
|
|
Dachverband Anthroposophischer Medizin in Deutschland (D.A.M.I.D) |
damid.de |
|
Deutsche Gesellschaft für Klassische Homöopathie (DGKH) |
|
|
Gesellschaft Anthroposophischer Ärzte (GAÄD) |
|
|
Homöopathieverband Schweiz (HVS) |
|
|
Internationale Vereinigung Anthroposophischer Ärztegesellschaften (IVAA) |
|
|
Medizinische Sektion am Goetheanum, Freie Hochschule für Geisteswissenschaft |
|
|
North American Society of Homeopaths (NASH) |
homeopathy.org |
|
Physicians’ Association for Anthroposophic Medicine (PAAM) |
paam.wildapricot.org |
|
Schweizerische Ärztegesellschaft für Homöopathie (sahp) |
|
|
The Society of Homeopaths |
|
|
Verband Klassischer Homöopathen Deutschlands (VKHD) |
Die Übersichtsarbeit orientiert sich an vergleichbaren Arbeiten zur Identifizierung von ethischen Aspekten (Strech et al. (2013)113, Kahrass et al. (2016)114, Seitzer et al. (2016)115). Sie wird folgende Fragestellung zu beantworten versuchen: „Welche ethischen Aspekte auf individueller und berufsethischer Ebene sind bei der palliativen Misteltherapie bei Patientinnen mit Brustkrebs relevant?”. Für die Literatursuche werden PubMed, PhilPapers, Sowiport und Ethicsweb verwendet. Identifiziert werden ethische Aspekte mittels der normativen Prinzipien des erwähnten Rahmengerüstes (das heißt, etwas ist dann ein ethischer Aspekt, wenn der Aspekt einen Bezug hat zu Nutzen, Schaden, Gerechtigkeit usw.).
Es kommt bei der Bearbeitung ethischer Aspekte in HTA allgemein nicht selten vor, dass sich wenig Literatur zu einer spezifischen Therapie finden lässt (mit Ausnahme von Therapieformen und Diagnosemethoden aufgrund meistens innovativer technischer Möglichkeiten, die offenkundig ethische Fragen aufwerfen, wie beispielsweise Genomeditierung, Pränataldiagnostik oder tiefe Hirnstimulation). Da zudem davon auszugehen ist, dass die ethische Forschung zu spezifischen komplementär- oder integrativmedizinischen Therapien – nicht zu komplementärer oder integrativer Medizin allgemein ‑noch geringer ausfällt als bei konventionellen biomedizinischen Therapien, ist ein „empty review” denkbar. Deshalb wird die Suche nach ethischen Aspekten beim Vorliegen weniger brauchbarer Treffer ausgeweitet auf „ethische Aspekte beim Einsatz von komplementär- und integrativmedizinischen Ansätzen bei Krebs”. Zeigt eine explorative Testsuche, dass damit zum einen brauchbare Literatur gefunden werden kann, zum anderen aber die Trefferzahlen noch bewältigbar im Rahmen der Möglichkeiten dieses HTA-Berichts sind, wird die Literaturrecherche auf diese Weise durchgeführt und Literatur mit relevanten Aspekten, die auf die ursprüngliche Fragestellung übertragbar sind, aufgenommen.
Die aus der eingeschlossenen Literatur extrahierten ethischen Aspekte werden anhand des ethischen Rahmengerüsts, mit dem sie identifiziert wurden, auch kategorisiert und mittels induktiver Kategorienbildung (das heißt, Bildung von übergeordneten Kategorien anhand des Vergleichs des gefundenen Materials) in weitergehende, spezifischere Unterkategorien eingeordnet.
Da für die Suche von Literatur zu ethischen Aspekten kein PICO-Format verwendet werden kann (siehe 2.4.), wurden unabhängig vom PICO-Format Ein- und Ausschlusskriterien bestimmt (siehe Tabelle 21). Diese orientieren sich vor allem am Gegenstand der Literatur und der inhaltlichen Erörterung dieses Gegenstands.
|
Tabelle 21: Ein- und Ausschlusskriterien für Literatur zu ethischen Aspekten |
|
Einschlusskriterien für Literatur zu ethischen Aspekten |
|
Publikationstyp Zeitschriftenartikel (inklusive Editorials, Kommentare, Meinungen (Viewpoints) und |
|
Tagungsberichte), wissenschaftliches Buch oder Kapitel aus einem solchen Buch |
|
Sprache Deutsch und Englisch |
|
Inhaltlich (a) Die Publikation muss folgenden Gegenstand haben: |
|
i. palliative Misteltherapie (vor allem, aber nicht ausschließlich, im Zusammenhang |
|
mit Krebserkrankungen beim Menschen), oder |
|
ii. Allgemein Anwendungen integrativer oder komplementärer Medizin (vor allem, |
|
aber nicht ausschließlich, im Zusammenhang mit Krebserkrankungen beim |
|
Menschen). |
|
(b) Die Publikation muss zudem explizite normativ-ethische Inhalte zu diesem |
|
Gegenstand enthalten, das heißt zum Beispiel sie muss: |
|
i. ethische Probleme/Herausforderungen (beispielsweise unklare |
|
Entscheidungsfindung, Konflikte zwischen Prinzipien/Normen, erforderliche |
|
Abwägungen zwischen verschiedenen ethischen Gütern oder ethische Dilemmata) |
|
thematisieren, oder |
|
ii. ethische Gründe (Argumente, Gesichtspunkte, Positionen) für oder gegen |
|
bestimmte Entscheidungen oder Regulierungen aufführen und/oder diskutieren, |
|
oder |
|
iii. ethische Regulierungen oder Empfehlungen zusammenfassen oder vorschlagen. |
|
(c) Diese normativ-ethischen Inhalte müssen darüber hinaus (auch) auf der Ebene |
|
individueller Behandler (Ärztinnen/Ärzte, Heilpraktikerinnen/Heilpraktiker usw.) |
|
verortet werden können. |
|
Ausschlusskriterien für Literatur zu ethischen Aspekten |
|
(a) Die Publikation beschäftigt sich vom Gegenstand her nur mit alternativmedizinischen |
|
Anwendungen (unabhängig der Erkrankung); oder |
|
(b1) Die Publikation erwähnt nur implizit oder beiläufig (zum Beispiel als Teil der |
|
Diskussion/Schlussfolgerungen einer empirischen Studie) normativ-ethische Inhalte |
|
(das heißt, es genügt nicht, dass die Ergebnisse oder die Diskussion ethisch |
|
relevant sind, sondern die Publikation muss selbst ethische Inhalte als solche |
|
thematisieren); oder |
|
(b2) die Publikation ist ausschließlich auf rechtliche Inhalte bezogen; oder |
|
(c) Die normativ-ethische Inhalte können ausschließlich auf die Ebene von |
|
grundsätzlichen politischen Entscheidungen im Gesundheitswesen bezogen werden |
|
(zum Beispiel ob grundsätzlich komplementärmedizinische Ansätze gefördert oder |
|
angeboten werden sollen); oder |
|
(d) Die normativ-ethischen Inhalte haben ausschließlich mit forschungsethischen |
|
Themen zu tun (zum Beispiel ethische Herausforderungen der Forschung in |
|
integrativer oder komplementärer Medizin); oder |
|
(e) die Publikation ist in einer anderen Sprache als Deutsch oder Englisch verfasst |
Neben der domänenübergreifenden Suche (siehe 3.1.2.1), deren Treffer auch hinsichtlich der Einschlusskriterien für ethische Aspekte durchgesehen werden, erfolgte eine weitere Literaturrecherche in bibliografischen Datenbanken. Neben PubMed wurden weitere Datenbanken, von denen erwartet werden kann, dass Publikationen mit ethischen Fragestellungen enthalten sind, verwendet (PhilPapers, Sowiport und Ethicsweb). Für die Suchstrategie werden, angepasst an die jeweilige Datenbank, verschiedene Kombinationen der Suchbegrifffelder zu Brustkrebs, Krebs, Mistelpräparat, Komplementärmedizin, Alternativmedizin, Integrative Medizin, Palliativsituation und Ethik getestet. Der Suchblock zur Alternativmedizin wird aufgenommen, obwohl es in diesem HTA-Bericht nicht um alternativmedizinischen Einsatz von Misteltherapie geht. Der Grund hierfür liegt darin, dass die im Diskurs verwendeten Begrifflichkeiten (Alternativ‑, Komplementär‑, Integrativmedizin) im Allgemeinen unterschiedlich von Autorinnen und Autoren aufgefasst werden können und daher nicht zwingend davon ausgegangen werden kann, dass Literatur, die „Alternativmedizin“ zum Gegenstand hat, nicht damit (auch) das abdeckt, was in diesem HTA-Bericht als „Komplementärmedizin“ oder „integrative Medizin“ definiert wird. Zudem wurden nur wenige zusätzliche Treffer durch die Aufnahme in den Suchblock erzeugt. Daher wurde entschieden, dass erst auf der Ebene der Selektion bestimmt werden soll, ob der Inhalt der jeweiligen Literatur relevant ist oder nicht, nicht aber bereits auf der Ebene der verwendeten Suchbegriffe.
Für PubMed wurden Freitextbegriffe und kontrollierte MESH-Begriffe verwendet, für die anderen Datenbanken nur Freitextbegriffe. Die genauen Suchstrategien und welche der Suchläufe jeweils für die Literaturselektion verwendet werden, sind im Anhang in Tabelle 96, Tabelle 97 und Tabelle 98 zu finden. Die Literaturselektion wurde in zwei Schritten jeweils von zwei Reviewern unabhängig durchgeführt: erstens auf Titel und Zusammenfassungs- (Abstract-) ‑ebene (MM und PSI, sowie MM und IO) zweitens auf Volltextebene (MM, IO).
Um sicherzustellen, dass die Übersichtsarbeit keine ethischen Aspekte übersehen hat, die theoretisch zu berücksichtigen wären, wird zuerst systematisch geprüft, ob bei Anwendung der jeweiligen Prinzipien des Rahmengerüsts weitere ethische Aspekte bei der palliativen Misteltherapie zu verorten sind. Etwaige weitere Aspekte werden den bestehenden Aspekten hinzugefügt und in bestehende Kategorien oder, falls erforderlich, neuen Subkategorien eingeordnet.
Anhand der identifizierten und kategorisierten ethischen Aspekte werden die Bewertungskriterien für palliative Misteltherapie bei Brustkrebs konkretisiert, das heißt, bestimmt, was angesichts eines jeweiligen ethischen Aspekts (oder einer verwandten Gruppe solcher Aspekte) bezüglich der Misteltherapie ethisch zu fordern wäre, beziehungsweise welche Bedingungen erfüllt sein müssen, damit der Einsatz der Misteltherapie ethisch vertretbar ist. Ebenso werden mögliche Konflikte zwischen verschiedenen ethischen Prinzipien dargestellt.
Auf der Basis der Ergebnisse werden ein Fließtext sowie eine tabellarische Übersicht zur deskriptiven Darstellung ethischer Aspekte erstellt.
Die Leitliniensuche in Datenbanken und Internet für den Zeitraum von 2007 bis 2017 erzielte 199 Treffer. Informationen zur Suchstrategie für die Leitlinien befinden sich in Tabelle 86 und Tabelle 87 im Anhang (Abschnitt 9.1). Nach dem Entfernen der Duplikate verbleiben 184 Referenzen. 21 Texte sind entweder nicht in deutscher oder englischer Sprache verfügbar (n = 9), der Zugang zum Text ist nicht möglich oder die Leitlinie ist bereits zurückgezogen (n = 12). Die verbleibenden 163 Volltexte werden aus dem Internet heruntergeladen. Drei der 163 Leitlinien oder Veröffentlichungen zu Leitlinien116–118 beziehen sich auf eine andere, möglicherweise relevante Leitlinie der Kommission Mamma (2018) zur Diagnostik und Therapie von Patientinnen mit primärem und metastasiertem Brustkrebs – herausgegeben von der Arbeitsgemeinschaft Gynäkologische Onkologie e. V.119. Da in den aktuellsten Fassungen der jährlich aktualisierten Leitlinie – die über die Handsuche hinzugefügt und im Volltext durchgesehen wurde – die systematische Literaturrecherche und ‑selektion nicht nachvollziehbar ist und keine zugrundeliegenden Studien zu den Empfehlungen zitiert werden, wird diese Leitlinie ausgeschlossen.
Wenn bereits eine aktuellere Fassung verfügbar ist, wird diese Version verwendet. Wenn für eine Leitlinie ein Leitlinienreport verfügbar ist, wird dieser ebenso eingeschlossen. Die so identifizierten zusätzlichen drei9,119,120 Referenzen sind im PRISMA-Diagramm (Abbildung 2) unter „Handsuche“ dokumentiert. Zusammen mit den 163 Leitlinien aus der Datenbank- und Internetsuche verbleiben 166 Leitlinien, die im Volltext auf Eignung beurteilt werden.
Drei Publikationen zu zwei Leitlinien erfüllen die Einschlusskriterien und werden für die Bewertung eingeschlossen. Eine der beiden eingeschlossenen Leitlinien wurde vom Leitlinienprogramm Onkologie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF), der Deutschen Krebsgesellschaft e. V. und der Deutschen Krebshilfe e. V. erstellt, mit dem Titel „Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms“.13 Verwendet wird die aktualisierte Version.9 Der zugehörige Leitlinienreport der AWMF120 enthält detaillierte Informationen zur Methodik und wurde deswegen auch als Informationsquelle für die Bewertung der Qualität der Leitlinie eingeschlossen. Die zweite eingeschlossene Leitlinie wurde von der Society for Integrative Oncology herausgegeben: Clinical practice guidelines on the use of integrative therapies as supportive care in patients treated for breast cancer).121
Die 163 ausgeschlossenen Leitlinien sind im Anhang in Tabelle 100 mit Ausschlussgrund aufgelistet.
Eine Erweiterung der Untersuchung auf komplementäre und alternative Behandlungsmethoden im Allgemeinen ist aufgrund der Ergebnisse nicht notwendig. Eine Verallgemeinerung wäre nur in Betracht gezogen worden, wenn keine Leitlinie Ergebnisse zur Misteltherapie beinhaltet hätte. Der Selektionsprozess ist in Abbildung 2 dokumentiert.

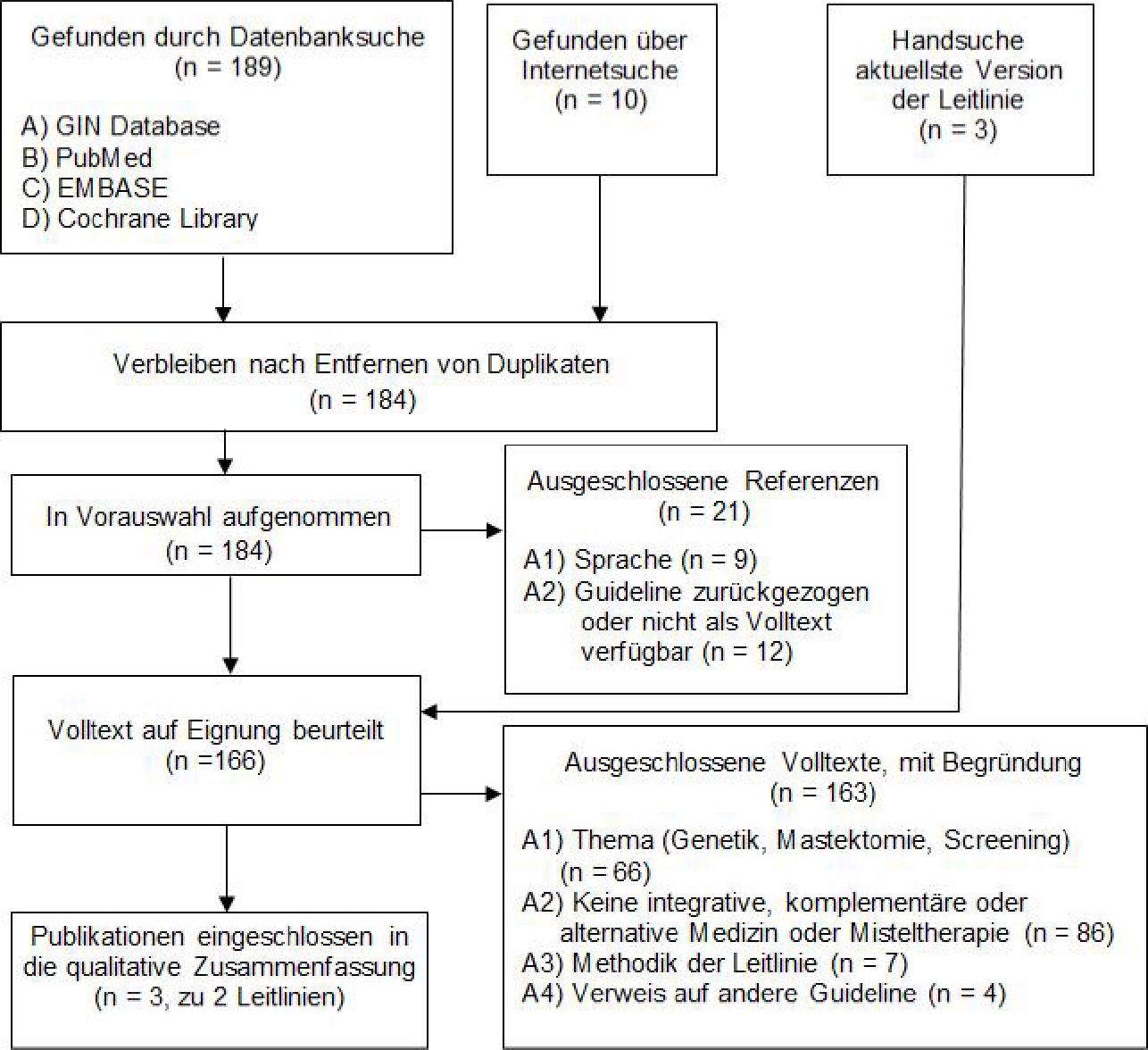
Abbildung 2: PRISMA-Flussdiagramm zur Leitliniensuche
PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Domänenübergreifende Suche (dokumentiert in Tabelle 84 (Übersicht) und Tabelle 85), Internet-122, 123 und Handsuche in Bibliografien124–131 liefern zusammen 343 Referenzen, von denen nach dem Entfernen der Duplikate 242 Referenzen für die Durchsicht der Titel und Zusammenfassungen (Abstracts) verbleiben.
Das PRISMA-Flussdiagramm (in Abbildung 3) beinhaltet die Selektion der Literatur zur medizinischen Wirksamkeit und Sicherheit.
Von den 242 in die Vorauswahl aufgenommenen Publikationen werden Titel und Zusammenfassungen (Abstracts) auf die Erfüllung von Ein- und Ausschlusskriterien überprüft. 72 Publikationen davon erscheinen als möglicherweise geeignet und wurden – soweit beschaffbar – im Volltext auf Eignung überprüft. Zusätzlich wurden bei neun identifizierten SR57, 82, 132–138 die Referenzlisten auf mögliche zusätzliche Studien, die die Einschlusskriterien erfüllen, durchgesehen. Zusammen mit den acht Referenzen aus der Handsuche wurden insgesamt 80 Volltexte auf Eignung beurteilt.
Ausschlussgründe bei der Durchsicht der Volltexte sind, dass entweder die Studienpopulation nicht aus Patientinnen mit Brustkrebs mit begleitender Misteltherapie besteht oder die Ergebnisse zu Brustkrebs nicht getrennt entnommen werden können (n = 3), die Intervention keine begleitende Misteltherapie ist (n = 3) die Vergleichsgruppe nicht aus Patientinnen besteht, die nur eine Standardtherapie bekommen (n = 1) oder die Zielgrößen anders sind, als in den Ein- und Ausschlussgründen in Tabelle 12 definiert (n = 5). Texte werden auch ausgeschlossen, wenn die Anzahl der Probandinnen sehr klein ist (unter 25) (n = 1), das Studiendesign nicht den Anforderungen der Ein- und Ausschlusskriterien entspricht (n = 22), es sich um eine Doppelpublikation zu einer bereits eingeschlossenen Studie handelt (n = 1) oder der Publikationstyp keine wissenschaftliche Veröffentlichung, sondern nur ein Kommentar oder Konferenzbeitrag ist (n = 4). Ebenso werden Referenzen ausgeschlossen, wenn das Thema der Veröffentlichung nicht zu den Forschungsfragen zur Bewertung der medizinischen Wirksamkeit und Sicherheit passt (n = 13). Für fünf Publikationen ist kein Volltext verfügbar. Eine Übersicht zum Selektionsprozess ist in Abbildung 3 dargestellt.
In die Informationssynthese zur medizinischen Wirksamkeit werden sechs Publikationen, die über drei Studien berichten, eingeschlossen. Die sechs eingeschlossenen Publikationen zur Bewertung der medizinischen Wirksamkeit sind: Semiglazov et al. (2004)139, Semiglazov et al. (2006)140, Tröger et al. (2009 und 2012)141,142 und Tröger et al. (2014 und 2016)143, 144.
Semiglazov et al. (2004)139 ist die eigenständige Dosisfindungsstudie zu Semiglazov et al. (2006)140. Das Patientenkollektiv überschneidet sich nicht. Weitere Informationen zu den Studiencharakteristika folgen in Abschnitt 5.1.2.1.2.
In die Informationssynthese zur Sicherheit werden elf Publikationen zu sieben Studien eingeschlossen: Bock et al. (2004a)145, Bock et al. (2004b)146, Eisenbraun et al. (2011)147, Loewe-Mesch et al. (2008)148, Schumacher et al. (2002)129, Schumacher et al. (2003)149, Semiglazov et al. (2004)139, Semiglazov et al. (2006)140, Tröger et al. (2009)141, Tröger et al. (2014)143 und von Hagens et al. (2005)131.
Die Referenzlisten zu den ausgeschlossenen Volltexten im Anhang (9.2) sind getrennt nach „systematische Reviews“, „medizinische Wirksamkeit“ und „Sicherheit“ im Anhang (Abschnitt 9.2) dokumentiert. Im PRISMA-Diagramm in Abbildung 3 beziehen sich die Ausschlussgründe für die ausgeschlossenen Volltexte auf die Bewertung der medizinischen Wirksamkeit. Abweichende Ausschlussgründe für die Bewertung der Sicherheit sind in Tabelle 103 markiert. Ebenso sind in den Tabellen in Abschnitt 9.2 alle Publikationen markiert, die für die Bewertung einer Zielgröße eingeschlossen, für eine andere Zielgröße jedoch ausgeschlossen wurden, da diese im PRISMADiagramm nicht bei der Anzahl der ausgeschlossenen Volltexte mit Ausschlussgrund mitgezählt wurden.


‘Troger 2012 und 2016 ausgeschlossen, weil keine Daten zur Sicherheit
Abbildung 3: PRISMA-Flussdiagramm zur Suche zur medizinischen Wirksamkeit und Sicherheit PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Insgesamt werden über die domänenübergreifende Suche in medizinischen Datenbanken und einer Internetsuche neun SR identifiziert (Abbildung 3): Ernst et al. (2003)132, Horneber et al. (2008)82, Kienle et al. (2003)134, Kienle und Kiene (2007)57, Kienle et al. (2009)133, Kienle und Kiene (2010)138, Ostermann et al. (2009)135, Shneerson et al. (2013)136 und Sood et al. (2007)137. Diese SR werden durchgesehen, um weitere relevante Publikationen zu finden, die über die Datenbanksuche nicht gefunden werden. Bei der Suche zu sozialen Aspekten wurde noch ein weiteres SR von Kalder et al. (2016)122 identifiziert, das aber keine zusätzlichen Studien ergeben hat.
Im HTA-Bericht von Lange-Lindberg (2006)7 sind drei SR beschrieben, die über die Suche nicht gefunden wurden, aber diese liefern keine neuen Studien.
Die Suche nach zusätzlichen HTA-Berichten unter Zuhilfenahme der „Grey Matters“-Liste der CADTH101, liefert keinen weiteren Treffer. Die Dokumentation der „Grey Matters“-Suche ist in Tabelle 93 zu finden.
Aus den SR ergeben sich elf zusätzliche, potenziell relevante und – mit Ausnahme des Publikationsjahrs – den Einschlusskriterien entsprechende Publikationen, die im Volltext durchgesehen wurden: Auerbach et al. (2005)125, Beuth (2008)128, Bock et al. (2004a)145, Bock et al. (2004b)146, Heiny et al. (1994)126, Hutt et al. (2001)127, Kienle et al. (2003)124, Klose et al. (2003)130, Schumacher et al. (2002)129, Steele et al. (2014)150 und von Hagens et al. (2005)131, 150. Die Durchsicht der Volltexte der SR ergibt zwei zusätzliche Referenzen für Primärstudien zur Domäne medizinische Wirksamkeit und Sicherheit: Schumacher et al. (2002)129 und von Hagens et al. (2005)131. Die beiden neu hinzugefügten Referenzen berichten keine neuen Ergebnisse, sondern sind Publikationen zu Studien, zu denen bereits Artikel eingeschlossen sind. Schumacher et al. (2002)129 berichten aus derselben Studie wie Schumacher et al. (2003)149 und von Hagens et al. (2005)131 berichten weitere Ergebnisse zur selben Studie wie der Artikel von Loewe-Mesch et al. (2005)148, der in der Durchsicht der Treffer aus der domänenübergreifenden Suche eingeschlossen wurde. Für die Bewertung der Sicherheit können beide Publikationen zusätzlich eingeschlossen werden.
Die Studie von Auerbach (2005)125 ist zwar ein RCT mit einer für die Bewertung der Lebensqualität relevanten Zielgröße, dem EORTC-QLQ-C30-Fragebogen, kann aber nicht in die Bewertung der Wirksamkeit einbezogen werden, weil die Berichtsqualität der Ergebnisse nicht ausreichend ist. Weder Effektgrößen noch KI können der Publikation entnommen werden, daher wird die Publikation nach der Durchsicht des Volltexts ausgeschlossen.
Die zusätzlich identifizierten Studien sind im PRISMA-Flussdiagramm zur medizinischen Suche unter „Handsuche“ dokumentiert (Abbildung 3).
Acht online zugängliche Studienregister werden bezüglich laufender Studien oder SR zur Misteltherapie bei Patientinnen mit Brustkrebs durchsucht. Letzter Stand der Suche in den Registern ist vom 25. Februar 2019. Die Suche hat keine Eingrenzung des Zeitraums.
Die verwendeten Suchbegriffe und die Internetlinks zu den Registern sind im Anhang in Tabelle 88 dokumentiert. Tabelle 89 beinhaltet die Ergebnisse der Suche aus den Registern. Insgesamt werden im Zeitraum von 2002 bis 2018 zehn Studienregistereintragungen in drei Registern gefunden, davon fünf Duplikate. Von den fünf Studien sind zwei bereits abgeschlossen und drei laufend. Die beiden abgeschlossenen Studien von Mansky (2007)151 und von Hagens (2005)131, 148 waren bereits in der Datenbankrecherche enthalten und bewertet. Bei den übrigen drei handelt es sich um noch nicht abgeschlossene Studien, zu denen es keine publizierten Ergebnisse gibt.
Eine Studie ist seit 2007 von der Bulgarian Drug Agency registriert (EudraCT-Nummer: 2007–00084136) mit geplantem Startdatum 2011, aber bisher sind keine neuen Informationen verfügbar. Die zweite und dritte Studie wurden von der University of Bristol durchgeführt. Der Titel der Studie mit dem Startdatum 2011 (EudraCT-Nummer: 2011–001224-37) lautet: „Mistletoe in early Breast Cancer (MBC): A pilot study for a randomised controlled trial“. Die zweite Studie der Universität Bristol mit dem eingetragenen Startdatum 20. April 2018 (EudraCT-Nummer: 2018–000279-34) trägt den Titel: „Mistletoe And Breast Cancer (MAB): A pilot study for a randomized double-blind controlled trial“.
Domänenübergreifende Suche (siehe Tabelle 84 und Tabelle 85) und Internetsuche zu Kosten und Kosteneffektivität liefern zusammen 334 Referenzen, von denen nach Entfernen der Duplikate 243 Referenzen für die Durchsicht der Titel und Zusammenfassungen (Abstracts) verbleiben.
Davon werden vier Artikel ins Volltext-Screening eingeschlossen: Schöffski et al. (2009)152, Standish et al. (2017)153, Stauder et al. (2010)154 und Kalder (2016)122. Ein weiterer Artikel von Kienle et al. (2013)155 wird über eine Handsuche identifiziert.
Insgesamt werden vier der fünf Publikationen ausgeschlossen: Zwei Publikationen122, 155 werden ausgeschlossen, weil es sich um SR ohne Kosten- oder Kosteneffektivitätsstudien handelt. Für die Referenz eines Konferenzbeitrags154 ist kein Volltext verfügbar und eine Studie153 wird ausgeschlossen, weil sie nicht im deutschsprachigen Raum, sondern in den USA durchgeführt wurde.
Nach der Durchsicht der Volltexte wird für die Bewertung der Kosten eine Kostenanalyse von Schöffski et al. (2009)152 in die Informationssynthese eingeschlossen.
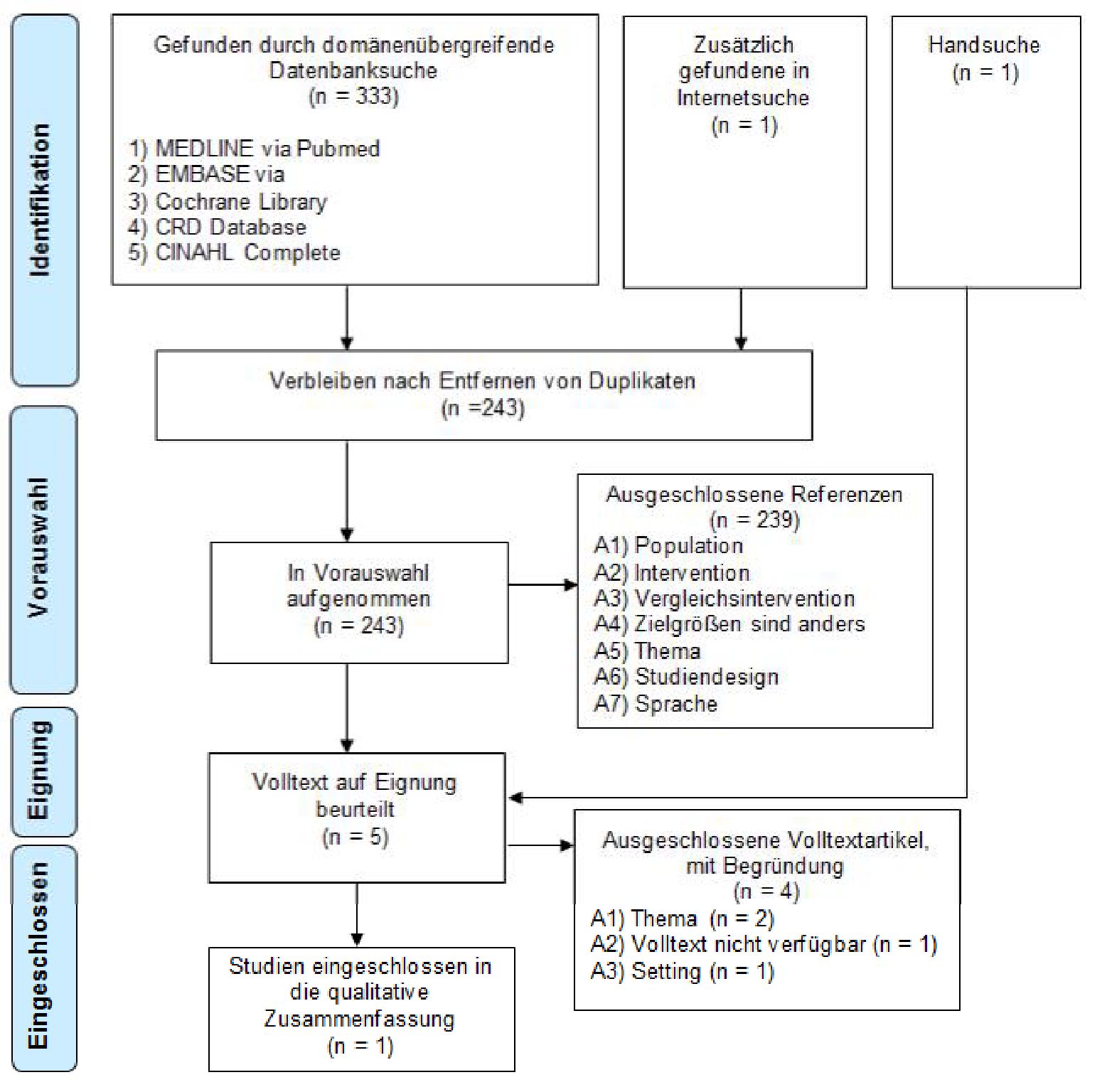
Abbildung 4: PRISMA-Flussdiagramm zur Suche zur Kosteneffektivität
PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Datenbank‑, Internet- und Handsuche ergeben 409 Referenzen. Die Suchergebnisse resultieren aus verschiedenen Quellen: die domänenübergreifende Suche (dokumentiert in Tabelle 84 und Tabelle 85), die Suche zu ethischen Aspekten (dokumentiert in Tabelle 96 bis Tabelle 99), die Suche zu Patienten-und sozialen Aspekten in weiteren Datenbanken – Web of Science und weitere Datenbanken über die Suchoberflächen Ovid und EBSCO (dokumentiert in Tabelle 91, Tabelle 92 und Tabelle 94), die Internetsuche zu deutschsprachigen Zeitschriften und Internetseiten (siehe Tabelle 90) und anhand der Grey Matters-Checkliste (siehe Tabelle 93), die Handsuche in den Referenzlisten bereits eingeschlossenen Publikationen und SR zum Thema (in Abbildung 5 dokumentiert unter „Handsuche“).
Nach dem Entfernen der Duplikate verbleiben 290 Referenzen aus der Datenbank- und Internetsuche sowie zwölf Referenzen aus der Handsuche für die Durchsicht der Titel und Zusammenfassungen (Abstracts).
Von den 318 in die Vorauswahl aufgenommenen Publikationen werden 75 als möglicherweise geeignet beurteilt und im Volltext beschafft. Inklusive der 21 Texte aus der Handsuche werden insgesamt 96 Volltexte – soweit verfügbar – in die Prüfung der Erfüllung der Einschlusskriterien einbezogen. In 57 Publikationen67, 156–211 ist das Thema der Veröffentlichung nicht passend für die Beantwortung der Forschungsfragen zur Bewertung der Patienten- und sozialen Aspekte der adjuvanten Misteltherapie bei Patientinnen mit Brustkrebs. Dreizehn Publikationen63, 66, 123, 212–221 werden ausgeschlossen, weil die Ergebnisse nicht für Patientinnen mit Brustkrebs mit Misteltherapie getrennt entnehmbar sind oder der Anteil der für den HTA relevanten Studienpopulation nicht bei mindestens 80 % liegt (relevant, falls für mehrere Krebs- oder KIM-Arten gleichzeitig berichtet wird). Drei Referenzen werden ausgeschlossen, weil der Publikationstyp nicht angemessen ist, da es sich um einen Kommentar zu einer anderen Studie222, eine Ankündigung für einen HTA-Bericht223 oder um einen Konferenzbeitrag224 handelt. Fünf Referenzen68, 69, 225–227 werden ausgeschlossen, weil die Studienpopulation nicht aus einem deutschsprachigen Land stammt oder die Ergebnisse der Publikation sich nicht auf den deutschsprachigen Raum beziehen. Brandenberger et al.228 ist eine Doppelpublikation zu einer eingeschlossenen Veröffentlichung.
Das in Abbildung 5 dargestellte PRISMA-Flussdiagramm beinhaltet die Selektion zu Patienten- und sozialen Aspekten.
Die in der domänenübergreifenden Suche identifizierten Übersichtsarbeiten werden – wie beim medizinischen Teil – hinsichtlich zusätzlicher relevanter Publikationen durchgesehen. Zwei SR zum Thema wurden gefunden: Kalder et al. (2016)122 und Evans et al. (2016)229. Es wurden in den SR keine zusätzlichen relevanten Publikationen identifiziert.
In die Informationssynthese zu Patienten- und sozialen Aspekten werden 15 Publikationen zu 15 Studien eingeschlossen: Brandenberger et al. (2012)230, Drozdoff et al. (2018)231, Fasching et al. (2007)232, Fremd (2017)62, Gschwendtner et al. (2016)233, Hübner et al. (2014)234, Kalder et al. (2001)65, Klein et al. (2017)235, Konitzer et al. (2001)236, Moschen et al. (2001)237, Münstedt (2000)238, Schad et al. (2018)239, Schönekaes et al. (2003)240, Tautz et al. (2012)241 und Templeton et al. (2013)242.
Die Analyse und Synthese zu den Patienten- und sozialen Aspekten basiert auf diesen 15 Publikationen.62, 65, 230–242 Zehn der Publikationen62, 65, 231, 232, 234, 235, 237, 238, 240–242 sind für die quantitative Erfassung der Inanspruchnahme der Misteltherapie bei Patientinnen mit Brustkrebs geeignet – eine zusätzliche Standardtherapie ist bei den Patienten- und sozialen Aspekten nicht notwendig. Davon beinhalten fünf auch quantitativ berichtete Ergebnisse zu den Zielgrößen für die Patiente- und sozialen Aspekte – zwei234′ 237 zur Patientinnen- und drei65′ 235′ 238 zur Behandelndenperspektive. Die drei qualitativen Studien230, 233, 236 werden in die qualitative Inhaltsanalyse einbezogen.
Aus sieben der Veröffentlichungen können ausschließlich Informationen zur Häufigkeit der Inanspruchnahme der Misteltherapie verwendet werden.62′ 231′ 232′ 239–242
Die qualitative Studie von Gschwendtner et al. (2016)233 wurde von den Autorinnen diskutiert’ da sowohl der Anteil der Patientinnen mit Brustkrebs an der Studienpopulation’ als auch der Anteil der Patientinnen mit Misteltherapie unter den Patientinnen mit Brustkrebs unter 80 % liegen. Die Studie wird dennoch eingeschlossen’ da die Ergebnisse zu den Beweggründen sehr allgemein beschrieben sind und keiner spezifischen Krebsart zugeordnet werden können. Die Studie identifiziert wichtige Aspekte zur Wahrnehmung der Misteltherapie’ zu Information und Beratung und welche Aspekte den Zugang zur Misteltherapie verhindern könnten.
Auch in der qualitativen Studie von Konitzer et al. (2001)236 ist der Anteil der Patientinnen mit Brustkrebs mit neun von zwölf Studienteilnehmenden knapp unter 80 %’ jedoch ist die Misteltherapie die einzige untersuchte Intervention. Deswegen wird diese Studie eingeschlossen.
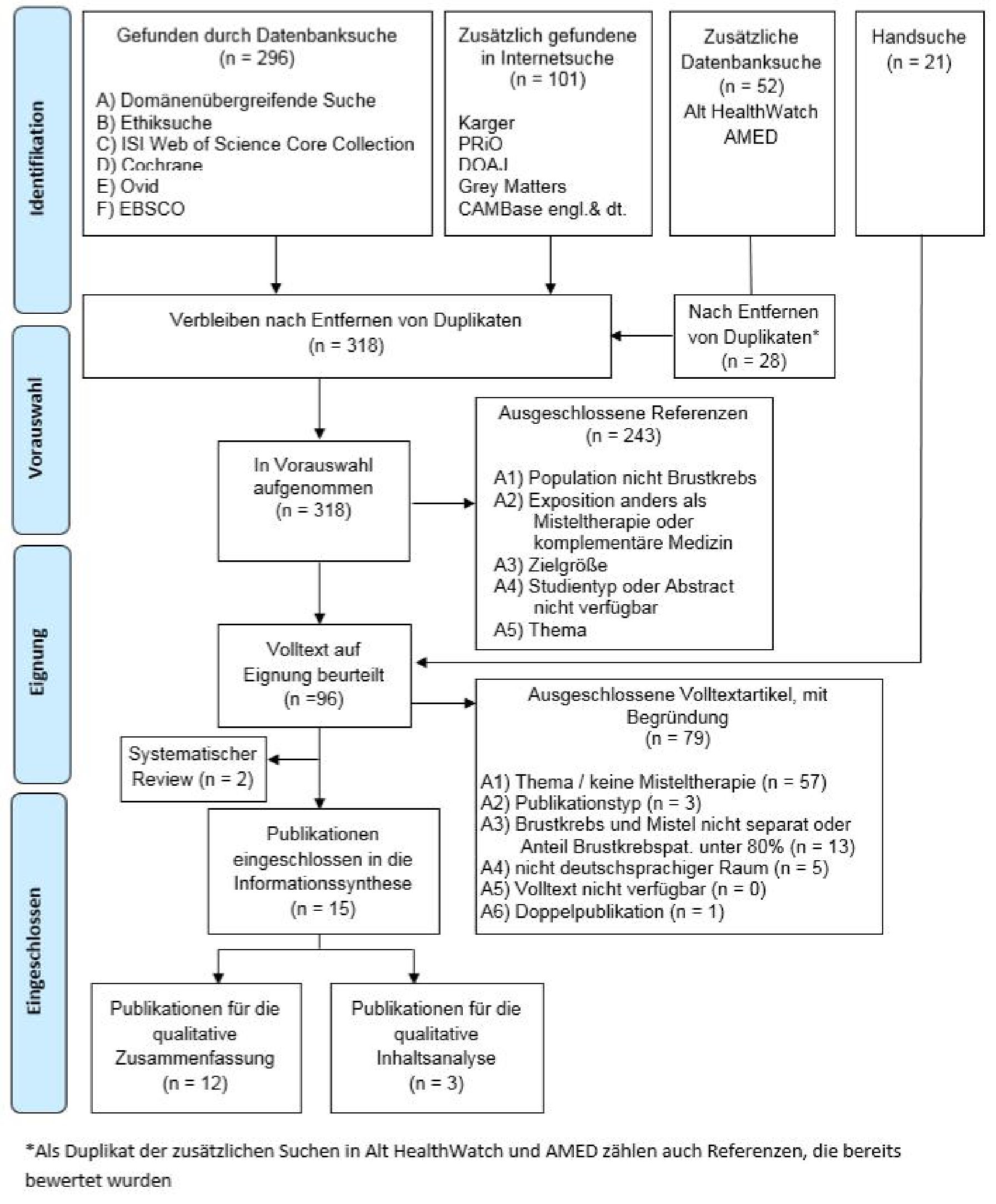
Abbildung 5: PRISMA-Flussdiagramm zur Suche zu Patienten- und sozialen Aspekten PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Es gibt keine bestehenden genuin ethischen Leitlinien oder ethischen Empfehlungen zur Misteltherapie generell oder spezifisch zur palliativen Misteltherapie. Die verschiedenen Fachgemeinschaften, Verbände oder sonstigen Organisationen wie die Gesellschaft Anthroposophischer Ärzte (GAÄD), Dachverband Anthroposophischer Medizin in Deutschland (D.A.M.I.D), aber auch die allgemeinere Anthroposophische Gesellschaft in Deutschland sowie der Verband Klassischer Homöopathen Deutschlands (VKHD) oder die Deutsche Gesellschaft für Klassische Homöopathie (DGKH) geben keine spezifisch ethischen Leitlinien oder Empfehlungen hinsichtlich des Einsatzes der Misteltherapie ‑oder überhaupt ethische Orientierungen bezüglich Therapien. Dasselbe gilt für die Medizinische Sektion am Goetheanum, Freie Hochschule für Geisteswissenschaft, oder für die Internationale Vereinigung Anthroposophischer Ärztegesellschaften (IVAA), die jedoch zumindest generelle Ethikkodizes für die anthroposophische Medizin festhält.243 Auch die Schweizerische Ärztegesellschaft für Homöopathie (sahp), die sich mehr als Ausbildungsforum versteht, oder der Homöopathieverband Schweiz (HVS) publizieren keine Empfehlungen.
Auch international bieten Organisationen wie die Physicians’ Association for Anthroposophic Medicine (PAAM), trotz eigener Unterseite für Misteltherapie, keine ethischen Empfehlungen oder Erwägungen an. Dasselbe trifft auf die britische und auf die US-amerikanische Anthroposophical Society zu. Ebenso sind bei der europäischen Society of Homeopaths, der British Homeopathic Association und der North American Society of Homeopath (NASH) keine entsprechenden normativen Informationen zu finden, selbst wenn NASH einen allgemeinen „code of ethics“244 anbietet.
Sofern es Empfehlungen für die Misteltherapie gibt, wie beispielsweise von anthroposophischer Seite (z. B. durch die Gesellschaft Anthroposophischer Ärzte in Deutschland245), beschränken sich diese auf die Fragen der Wirksamkeit, Sicherheit und Verträglichkeit beziehungsweise Nebenwirkungen, geben aber keine Orientierung hinsichtlich weiterer ethischen Herausforderungen, die entweder unabhängig von der Evidenzlage oder aufgrund der unklaren Evidenzlage bestehen. Dasselbe gilt für weitere komplementärmedizinisch ausgerichtete Auskunftsorgane (wie beispielsweise CAM-Cancer 2015246). Einige wenige ethische Anhaltspunkte für die Therapieentscheidung, jedoch aus Sicht der Patientinnen, enthalten die Informationen des Deutschen Krebsforschungszentrums.35 Die Zusammenfassung des National Cancer Institute (NIH)247 sowie die bereits in der medizinischen Bewertung erwähnten SR (vgl. 4.1.2 Systematisches Literaturreview zur medizinischen Wirksamkeit und Sicherheit) beschränken sich auf Aussagen über die gegenwärtige medizinische Evidenzlage.
Auch die S3-Leitlinie der AWMF zu Mammakarzinomen13 äußert sich nur – negativ – zur Evidenzlage, enthält aber keine ethischen Empfehlungen („Eine Misteltherapie verlängert das Überleben von Patientinnen mit Mammakarzinom nicht, eine Verbesserung der Lebensqualität ist nach derzeitiger Datenlage fraglich’, S. 282). Die Leitlinie weist aber allgemein zum Umgang mit komplementärmedizinischen Therapien darauf hin, dass zum einen in der Aufklärung der Patientin „[e]iner Forderung […] nach Informationen über alle relevanten verfügbaren Maßnahmen, inklusive supportiver und komplementärer Behandlungsmöglichkeiten […] nachgekommen werde[n] [sollte]” (S. 203), dass aber auch auf die möglichen Risiken und Interaktionen mit Standardtherapien hingewiesen werden sollen (S. 280). Darüber hinaus wird festgehalten, dass die diagnostischen Maßnahmen, die „im Rahmen von komplementären und alternativen Therapiekonzepten” angeboten werden und „auf wissenschaftlich nicht belegten Konzepten” oder auf „falschen Interpretationen von Zusammenhängen der Körperfunktionen” beruhen, nicht empfohlen werden sollten (S. 280). Alternative Therapieverfahren, nicht komplementär zur Standardtherapie, sollen nicht empfohlen werden (S. 284).
In der Datenbanksuche (dokumentiert im Anhang in Tabelle 96, Tabelle 97, Tabelle 98 und Tabelle 99) werden 826 Referenzen gefunden. Es wurde keine zusätzliche Internet- oder Handsuche durchgeführt. Nach der Entfernung von Duplikaten verbleiben 732 Referenzen, die anhand von Titel und Zusammenfassung (Abstract) hinsichtlich der Erfüllung der Einschlusskriterien durchgesehen werden. Davon werden 56 Referenzen im Volltext bestellt. Sechs Texte sind nicht verfügbar. Von den 50 im Volltext durchgesehenen Referenzen werden 17 in die Informationssynthese eingeschlossen. 39 Artikel werden ausgeschlossen, weil entweder Ethik nur implizit adressiert wird (n = 3), das Thema Ethik nur oberflächlich behandelt wird (n = 9) oder weil das Thema der Publikation für die Fragestellung des HTA-Berichts nicht relevant oder nicht übertragbar ist (n = 10). Eine der Publikationen, die als nicht übertragbar gewertet wird, ist Shaw (2010)248, da dieser Text ausschließlich dafür Argumente anführt, dass das englische National Health System (NHS) Homöopathie grundsätzlich nicht finanziell fördern sollte und damit eine gesundheitspolitische Debatte in einem anderen Land beschreibt, die nicht für palliative oder adjuvante Misteltherapie in Deutschland anwendbar ist. Daher wird dieser aus der Informationssynthese ausgeschlossen. Bei elf Publikationen ist das Thema anders als gesucht.
Der Selektionsprozess ist im PRISMA-Diagramm in Abbildung 6 dargestellt.
In die Informationssynthese eingeschlossen werden: Adams et al. (2002)249, Ben-Arye et al. (2008)250, Braun et al. (2014)251, Cohen et al. (2006)252, Ernst (1996)253, Fletcher (1992)254, Gruner (2000)255, Lynoe (1992)256, Mertz (2007)257, Sade (2003)258, Shahvisi (2016)259, Smith (2012)260,
Sugarman (2003)261, Tilburt et al. (2007)262, Torcello (2013)263, Tyreman (2011)264 und
Verhoef et al. (2008)206.

Abbildung 6: PRISMA-Flussdiagramm zur Suche zu ethischen Aspekten PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Insgesamt wurden zwei Leitlinien in die Informationssynthese eingeschlossen: Die „Interdisziplinäre SS-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms“ der AWMF9 aus Deutschland von 2017 gibt Empfehlungen zum gesamten Spektrum medizinischer Maßnahmen zum Mammakarzinom. Verfahren der integrativen Medizin und die Misteltherapie stehen hier nicht besonders im Fokus, sind aber enthalten. Die Leitlinie der Society for Integrative Oncology „Clincal Practice Guidelines on the Evidence-Based Use of Integrative Therapies During and After Breast Cancer Treatment”265 aus den USA von 2017 hingegen befasst sich ausschließlich mit Empfehlungen zur integrativen Medizin bei Brustkrebs und geht entsprechend detaillierter auf die Maßnahmen aus dem Bereich der integrativen Medizin, unter anderem die Misteltherapie ein.
Bei der Bewertung der Qualität der beiden eingeschlossenen Leitlinien liegt der Fokus vor allem auf der Methodik der Leitlinienerstellung. Daher beschränkt sich die Qualitätsbewertung in Tabelle 22 auf die Domäne 3 aus dem AGREE II Tool: Genauigkeit der Leitlinienentwicklung.85 Die Gesamtpunktzahl von Domäne 3 wird als prozentualer Anteil der maximal möglichen Punktzahl ausgedrückt (siehe Abschnitt 3.1.5.1). In den Spalten 2 bis 9 sind die erzielten Punktwerte der Einzelfragen für jede Leitlinie durch beide Bewerterinnen angegeben. Die mögliche Spannweite pro Frage durch zwei Bewerterinnen reicht von zwei bis 14 Punkten. Spalte 10 beinhaltet die Gesamtpunktzahl jeder Einzelbewertung für Domäne 3. Die einzelnen Fragen der Domäne 3 sind in der Legende zu Tabelle 22 aufgeführt.
Tabelle 22: Ergebnis Leitlinienbewertung mit AGREE II
|
Fragen |
|||||||||
|
Leitlinie, Jahr |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
Summe |
|
AWMF, 2017 |
|||||||||
|
Bewertung 1 |
7 |
6 |
6 |
7 |
7 |
7 |
7 |
7 |
54 |
|
Bewertung 2 |
7 |
7 |
4 |
7 |
7 |
6 |
7 |
7 |
52 |
|
Greenlee, 2014 |
|||||||||
|
Bewertung 1 |
7 |
7 |
6 |
7 |
7 |
7 |
7 |
3 |
51 |
|
Bewertung 2 |
6 |
7 |
4 |
7 |
6 |
7 |
6 |
2 |
45 |
Domäne 3: Genauigkeit der Leitlinienentwicklung
7. Es wurde systematisch nach Evidenz gesucht.
8. Die Kriterien für die Auswahl der Evidenz sind eindeutig beschrieben.
9. Die Stärken und die Schwächen der Evidenz sind eindeutig beschrieben.
10. Das methodische Vorgehen bei der Formulierung der Empfehlungen ist eindeutig beschrieben.
11. Der gesundheitliche Nutzen, Nebenwirkungen und Risiken wurden bei der Formulierung der Empfehlungen berücksichtigt.
12. Die zugrundeliegende Evidenz kann den Empfehlungen eindeutig zugeordnet werden.
13. Die Leitlinie wurde vor ihrer Veröffentlichung durch externe Expertinnen und Experten begutachtet.
14. Es existiert ein Verfahren zur Aktualisierung der Leitlinie.
AGREE = Appraisal of Guidelines for Research and Evaluation. AWMF = Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V.
Die Qualität und Transparenz der Methodik beider Leitlinien ist hoch. Die AWMF-Leitlinie erreicht 93,9 % der maximal möglichen Punktzahl, die Leitlinie der Society for Integrative Oncology (SIO) 83,7 %. Die Bewertung für die einzelnen Items der Domäne sind Tabelle 22 zu entnehmen. Bei der AWMF-Leitlinie sind die Qualitätsbewertungen der herangezogenen Evidenz für die Wirksamkeit und Sicherheit der Misteltherapie nicht angegeben, da diese Fragestellung nicht mittels eines neu durchgeführten systematischen Literaturreviews, sondern über eine Leitlinienrecherche adressiert wurde. Für die Qualität der eingeschlossenen Leitlinien gibt es aber nur generelle Summen-Scores zur Qualität der Leitlinie. Für die Empfehlungen zur Misteltherapie ist die Angabe der standardisierten Evidenzlevel der Leitlinie zu entnehmen. Es ist aber konkret nicht nachvollziehbar, worin die konkreten Mängel der Studien bestanden. In der Leitlinie der SIO sind die Vor- und Nachteile der der Empfehlung zugrunde gelegten Evidenz aus den vier randomisierten Studien diskutiert, trotzdem lässt sich die Konsistenz der Einschätzung zwischen Studienqualität und Grad der Empfehlung nicht nachvollziehen, weil die Ergebnisse der Qualitätsbewertung der einzelnen Studien nicht berichtet sind. Außerdem fehlen Angaben zum Aktualisierungsverfahren. Da es sich bei der Leitlinie um eine Aktualisierung der Leitlinie von 2014 handelt, kann allerdings festgestellt werden, dass Aktualisierungen durchgeführt werden.
In den folgenden Tabellen werden die Evidenz- und Empfehlungsgrade, die in den beiden eingeschlossenen Leitlinien verwendet wurden, gezeigt. Da es sich bei der Gabe von Mistelpräparaten um eine therapeutische Maßnahme handelt, werden nur Klassifikationen von Therapiestudien dargestellt. Die AWMF-Leitlinie verwendet die Klassifikation des Oxford Centres of Evidence-based Medicine von 2009266. Die Leitlinie der SIO verwendet keine Evidenzklassen für verschiedene Studientypen. Es wurden ausschließlich RCT eingeschlossen.
Tabelle 23: Evidenzgrade der AWMF-Leitlinie 20179 Übersetzung der Autoren des HTA-Berichts
Klasse Studientypen
|
1a |
Systematisches Review mit homogenen RCT |
|
1b |
RCT mit schmalem Konfidenzintervall |
|
1c |
Alles-oder-nichts-Situation: Vor Verfügbarkeit der Therapie starben alle Patienten an der Krankheit, seit Verfügbarkeit der Therapie überleben einige oder vor Verfügbarkeit überlebten einige Patienten, jetzt überleben alle. |
|
2a |
Systematisches Review mit homogenen Kohortenstudien |
|
2b |
Kohortenstudie (inklusive RCT mit < 80 % Follow-up) |
|
2c |
Versorgungsforschung (Outcomes Research), ökologische Studien |
|
3a |
Systematisches Review mit homogenen Fall-Kontrollstudien |
|
3b |
Fall-Kontrollstudie |
|
4 |
Fallserien und Kohorten- oder Fall-Kontrollstudien mit geringer Qualität |
|
5 |
Expertenmeinung ohne kritische Bewertung, physiologische Studien, Laborstudien, „erste Pri nzipien“ |
AWMF = Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. HTA = Health Technology Assessment. RCT = Randomisierte kontrollierte Studie.
Tabelle 24: Empfehlungsgrade der AWMF-Leitlinie 20179, 120
|
Empfehlungsgrad |
Beschreibung |
Ausdrucksweise |
|
A |
Starke Empfehlung |
Soll |
|
B |
Empfehlung |
Sollte |
|
0 |
Offen |
Kann |
|
EK |
EK: Empfehlungen, zu denen keine ausreichende Evidenz aus Studien, Leitlinien oder anderer aggregierter Literatur vorliegt. Diese Empfehlungen adressieren meistens Vorgehensweisen der guten klinischen Praxis, zu denen keine wissenschaftlichen Studien notwendig sind beziehungsweise erwartet werden können. |
Der Empfehlungsgrad ergibt sich nur durch die Ausdrucksweise soll/sollte/kann |
|
Starker Konsens |
> 95 % der Stimmberechtigten |
- |
|
Konsens |
75 bis 95 % der Stimmberechtigten |
- |
|
Mehrheitliche Zustimmung |
50 bis 75 % der Stimmberechtigten |
- |
|
Dissens |
< 50 % der Stimmberechtigten |
- |
AWMF = Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. EK = Expertenkonsens.
Grundsätzlich lehnt sich der Empfehlungsgrad bei der AWMF-Leitlinie an den Grad der Evidenz an. Ein hoher Evidenzgrad soll auch zu einer starken Empfehlung führen. Zur Wahl des Empfehlungsgrads wurden darüber hinaus zusätzliche Kriterien eingeführt, die eventuell zu einer Auf- oder Abstufung führen können: Konsistenz der Studienergebnisse, klinische Relevanz der Endpunkte und Effektstärken, das Nutzen-Risiko-Verhältnis, ethische, rechtliche, ökonomische Erwägungen, Patientenpräferenzen sowie Anwendbarkeit und Umsetzbarkeit. Beim Expertenkonsens wird die Stärke des Konsenses unterschieden.
Die Leitlinie der SIO verwendet eine modifizierte Form der Empfehlungsgrade der United States Preventive Services Task Force (USPSTF), einem unabhängigen Expertengremium in den USA, das vom Gesundheitsministerium unterstützt wird. Bei einem Vergleich mit den Originalempfehlungen der USPSTF zeigt sich, dass die Modifikation darin besteht, dass in der Leitlinie ein zusätzlicher Empfehlungsgrad H eingeführt wird, für Maßnahmen, die mehr schaden als nützen. Diese Maßnahmen sind ursprünglich in der D‑Empfehlung miterfasst. Als weitere Kriterien zur Klassifizierung werden die Unterscheidung zwischen klinischer und statistischer Signifikanz genannt, sowie das Abwerten von kleinen Studien mit weniger als 100 Teilnehmenden.
Tabelle 25: Empfehlungsgrade der SIO-Leitlinie 2017267
|
Empfehlungsgrad |
Beschreibung |
|
A |
Empfiehlt die Maßnahme anzubieten. Es besteht hohe Sicherheit, dass es einen beträchtlichen Nettonutzen gibt. |
|
B |
Empfiehlt die Maßnahme anzubieten. Es besteht hohe Sicherheit, dass es einen moderaten Nettonutzen gibt oder die Sicherheit ist moderat, dass es einen moderaten bis beträchtlichen Nettonutzen gibt. |
|
C |
Empfiehlt die Maßnahme nur ausgewählten Patienten basierend auf ärztlichem Urteil und Patientenpräferenzen anzubieten. Es besteht mindestens moderate Sicherheit, dass der Nutzen klein ist. |
|
D |
Empfiehlt die Maßnahme nicht anzuwenden. Es besteht moderate oder hohe Sicherheit, dass die Maßnahme keinen Nutzen bringt. |
|
H |
Empfiehlt die Maßnahme nicht anzuwenden. Es besteht moderate oder hohe Sicherheit, dass der Schaden den Nutzen überwiegt. |
|
I Die Evidenz ist nicht beweiskräftig. |
|
SIO = Society for Integrative Oncology.
AWMF-Leitlinie
In der AWMF-Leitlinie ist als „propagierter Einsatz“ die „Antitumorale Wirkung, Rezidivprävention, Verbesserung der Verträglichkeit der Chemotherapie“ genannt. Als Nebenwirkungen werden genannt: Allergien und ein bei in vitro Studien aufgetretener fördernder Effekt des Tumorwachstums. Zu Interaktionen mit anderen Therapien kann keine Aussage getroffen werden.
Das konsensbasierte Statement lautet: „Eine Misteltherapie verlängert das Überleben von Patientinnen mit Mammakarzinom nicht, eine Verbesserung der Lebensqualität ist nach derzeitiger Datenlage fraglich.“9 Zwar gäbe es Hinweise auf eine Steigerung der Lebensqualität durch die Misteltherapie, aber die Qualität der zugrundeliegenden Studien sei zu gering.
Greenlee et al.
In der Leitlinie von Greenlee et al. (2017)268 sind die Ziele der klinischen Anwendung der Misteltherapie die Steigerung der Lebensqualität und der körperlichen Funktionalität. Empfohlen wird, – basierend auf einem Expertenkonsens mit Evidenzgrad C – die Gabe von Mistelextrakten in Erwägung zu ziehen, um auf kurze Sicht die Lebensqualität zu erhöhen. Langzeiteffekte, Interaktionen und die Toxizität wurden nur in der vorhergehenden Version der Leitlinie von Greenlee et al.268 adressiert. Es wurde der Hinweis gegeben, dass bei hohen Dosen von Mistel reversible Lebertoxizität aufgetreten wäre. Die Evidenz, die hierfür herangezogen wurde, war jedoch sehr beschränkt: Eine Phase-I-Studie269, in der ein gentechnisch hergestelltes Mistellektin I (rViscumin) verwendet wurde, das in der gegenwärtigen Misteltherapie nicht verwendet wird. In der Diskussion weisen Greenlee et al. darauf hin, dass vor allem die nicht ausreichende Evidenz zu Interaktionen und Langzeiteffekten dazu geführt hat, dass die Empfehlung von Grad B (ausreichend Evidenz um die Intervention zu unterstützen) auf Grad C (nicht ausreichend Evidenz für Entscheidung für oder gegen Intervention, aber Empfehlung kann auf anderen Gründen basieren) heruntergestuft wird. Die aktualisierte Fassung von 2017268 beinhaltet keine Informationen mehr zu Langzeiteffekten oder zur Toxizität der Misteltherapie.
Aktuell (Dezember 2020) gibt es in Deutschland bereits eine neue Fassung (4.3) der interdisziplinären S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms36, in der aber sowohl die Evidenzgrundlage als auch die Empfehlungen zur begleitenden Misteltherapie unverändert aus Fassung (4.0) von 2017 übernommen wurden.
Im November 2020 ist eine vorläufige Konsultationsfassung der „S3-Leitlinie Komplementärmedizin in der Behandlung von onkologischen PatientInnen“50 für das öffentliche Stellungnahmeverfahren veröffentlicht worden. Die Inhalte dieser Leitlinie sind noch nicht endgültig beschlossen und sie konnte hier in den Ergebnisteil nicht mehr eingeschlossen werden. Sie wird jedoch in der Diskussion berücksichtigt.
-
5.1.2 Systematisches Literaturreview zu klinischen Studien zur medizinischen Wirksamkeit und Sicherheit
Insgesamt werden drei randomisierte Studien mit insgesamt 719 Teilnehmenden in die Bewertung der medizinischen Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Patientinnen mit Brustkrebs zusätzlich zur Standardtherapie einbezogen139–141, 143. Nur zur Bewertung der Wirksamkeit zur Zielgröße krankheitsfreies Überleben wurden zwei weitere Publikationen zu einer der Studien zur Nachbeobachtung nach fünf Jahren eingeschlossen.142, 144 Für die Bewertung der Sicherheit der Misteltherapie werden zusätzlich die Behandlungsarme, die begleitende Misteltherapie erhalten haben, aus vier Beobachtungstudien129, 131, 145–149 mit 1.232 Teilnehmerinnen zur deskriptiven Darstellung der UAW der Misteltherapie eingeschlossen, insgesamt also 1.951 Patientinnen.
In den folgenden Kapiteln werden zunächst die Ergebnisse der eingeschlossenen Studien zur Bewertung der medizinischen Wirksamkeit berichtet, danach die Ergebnisse zur Sicherheit. Für alle eingeschlossenen Studien werden neben den Ergebnissen folgende Studiencharakteristika berichtet: die Fragestellung und das Studiendesign (5.1.2.1.1 beziehungsweise 5.1.2.2.1), die Studienpopulation mit Ein- und Ausschlusskriterien (5.1.2.1.2 beziehungsweise 5.1.2.2.2), die Intervention und Vergleichsintervention (5.1.2.1.3 beziehungsweise 5.1.2.2.3) und die primären und sekundären
Zielgrößen (5.1.2.1.4 beziehungsweise 5.1.2.2.4). Für die RCT wird das Verzerrungspotenzial der Publikationen anhand des Risk of Bias Tools (RoB) der Cochrane Collaboration bewertet. Die RoB-Tabellen beinhalten sowohl die Zielgrößen für die Wirksamkeit als auch für die Sicherheit (5.1.2.1.5). Für die einarmigen Beobachtungsstudien zur Bewertung der Sicherheit der Misteltherapie werden Loss-to-follow-up und Hinweise auf selektives Berichten beschrieben (5.1.2.2.5).
5 1.2.1 Eingeschlossene Primärstudien zur medizinischen Wirksamkeit
Zur Bewertung der medizinischen Wirksamkeit wurden nur RCT eingeschlossen. Von den drei eingeschlossenen Studien weisen die beiden Studien von Semiglazov starke Ähnlichkeit auf, da die erste Studie (Semiglazov et al. (2004)139) eine Pilot- und Dosisfindungsstudie zur zweiten Studie (Semiglazov et al. (2006)140) ist. Die Ergebnisse der dreiarmigen Studie von Tröger wurden in vier Publikationen veröffentlicht: der Iscador®-Arm im Vergleich zur Kontrollgruppe in Tröger et al. (2009 und 2012)141, 142 und der Helixor® A‑Arm im Vergleich zur Kontrollgruppe in Tröger et al. (2014 und 2016)143, 144.
Tabelle 26: Studiendesign der eingeschlossenen Studien zur Bewertung der medizinischen Wirksamkeit
|
Studie, Jahr |
Rekrutierung: Land (Anzahl Studienzentren), Zeitraum |
Studientyp |
Verblindung |
Anzahl randomisiert |
Follow-up-Dauer |
|
Semiglazov (2004) |
Russland, Bulgarien, Ukraine (9); n. b. |
RCT, 4‑armig |
Ärzte und Patientinnen |
272 |
15 Wochen |
|
Semiglazov |
Russland, Bulgarien, |
RCT, |
Ärzte und |
352 |
16 – 24 Wochen |
|
(2006) |
Ukraine (6); n. b. |
2‑armig |
Patientinnen |
+ 2 Monate |
|
|
Tröger (2009), (2014) (2012) (2016) |
Serbien (1); 12.2005–02.2007 |
RCT, 3‑armig |
Keine |
95 |
18 Wochen und 5 Jahre |
n. b. = nicht beschrieben. RCT = Randomisierte kontrollierte Studie, engl.: randomised controlled trial.
In der Studie von Semiglazov et al. (2004)139 wird untersucht, ob PS76A2, ein wässriger standardisierter Mistellektinextrakt, einen Einfluss auf die Lebensqualität von Patientinnen mit Brustkrebs während der Chemotherapie nach dem CMF-Schema hat. Die Studie ist eine vierarmige randomisierte, placebokontrollierte, doppelblinde Studie zur Dosisfindung. Die Studienarme bestehen aus drei verschiedenen Interventionsgruppen und einer Kontrollgruppe. Das Placebo war in Aussehen, Geruch und Verpackung nicht von dem Verum zu unterscheiden. In neun verschiedenen Studienzentren in Russland, Bulgarien und in der Ukraine wurden Patientinnen mit Brustkrebs rekrutiert. Der Rekrutierungszeitraum ist nicht beschrieben. Die Rekrutierung der Teilnehmenden musste vor dem ersten Zyklus der Chemotherapie abgeschlossen sein. 272 Patientinnen mit Brustkrebs wurden randomisiert auf die vier Studienarme verteilt. Die Beobachtungsdauer (Follow-up-Zeit) beträgt 15 Wochen – zwölf Wochen während der Chemotherapie und bis zum ersten Tag der dritten Woche nach der Chemotherapie. Sponsorin der Studie ist die damalige Herstellerin des Lektinol®-Mistelextrakts, die MADAUS GmbH aus Köln, Deutschland.
Die zweite Studie von Semiglazov et al.140, deren Ergebnisse 2006 veröffentlicht wurden, untersucht den Einfluss des Mistelgesamtextrakts PS76A2, in der laut Vorstudie klinisch effektiven Dosis, auf die Lebensqualität von Patientinnen mit Brustkrebs während der Chemotherapie. Ziel der Studie ist, die Ergebnisse aus der ersten Studie zu bestätigen. Die Studie ist eine zweiarmige, randomisierte, placebokontrollierte, doppelblinde Studie. Das Placebo war in Aussehen, Geruch und Verpackung nicht von dem Verum zu unterscheiden. Für die Studie wurde in sechs Studienzentren in Russland, Bulgarien und in der Ukraine rekrutiert. Der Rekrutierungszeitraum ist nicht beschrieben, allein dass die Rekrutierung vor dem ersten Chemotherapiezyklus beendet sein musste. 352 Patientinnen mit Brustkrebs wurden randomisiert auf die zwei Studienarme verteilt. Die Interventions- und Beobachtungsphase dauert zwischen 16 und 24 Wochen während der Chemotherapie, abhängig davon, wie viele Zyklen der Chemotherapie der Patientin verabreicht wurden (zwischen vier und sechs Zyklen in einem Abstand von 28 Tagen). Nach Abschluss der Chemotherapie wird die Misteltherapie für weitere zwei Monate fortgesetzt. Auch diese Studie ist, wie die Pilotstudie von 2004, durch die MADAUS GmbH in Köln finanziert, der Herstellerin der Studienmedikation.
Die Studie von Tröger et al. (2009 und 2014)141, 143 untersucht den Einfluss einer begleitenden Misteltherapie, zusätzlich zur Chemotherapie, auf die Lebensqualität und die Häufigkeit von Neutropenie bei Patientinnen mit Brustkrebs. Die dreiarmige Studie ist ein RCT, das jedoch nicht placebo-kontrolliert und somit nicht verblindet ist. Die Patienten im ersten Arm erhielten Iscador®, die im zweiten Arm Helixor® A, und der dritte Arm stellte die Kontrollgruppe ohne Mistelextrakt dar. Über die beiden aktiven Behandlungsarme im Vergleich zur Kontrollgruppe wird getrennt in zwei Publikationen berichtet. Die Rekrutierung wurde im Studienzentrum in Belgrad, Serbien, durchgeführt. Alle Patientinnen, die zwischen Dezember 2005 und Februar 2007 am Institut für Onkologie und Radiologie am nationalen Krebsforschungszentrum in Serbien behandelt wurden, wurden auf Eignung für die Studie überprüft. 95 Patientinnen wurden randomisiert auf die drei Studienarme verteilt. Die Beobachtungsdauer liegt bei 18 Wochen und setzt sich zusammen aus 15 Wochen während der Chemotherapie und einer siebten Erhebung drei Wochen nach dem letzten Chemotherapiezyklus. Der Iscador®-Arm der Studie wurde finanziell unterstützt von der Gesellschaft für Krebsforschung (Arlesheim, Schweiz), einem Verein, der sich unter anderem mit der Entwicklung von Mistelpräparaten zur Krebsbehandlung befasst. Sponsor für den Helixor® A‑Arm war die Helixor® Heilmittel GmbH & Co. KG (Rosenfeld, Deutschland).
Die Publikationen von Tröger et al. (2012 und 2016)142, 144 sind Folgepublikationen der Studie von Tröger et al. (2009 und 2014)141, 143, die das krankheitsfreie Überleben nach fünf Jahren Nachbeobachtung nach Randomisierung aus jeweils einem der aktiven Studienarme im Vergleich zur Kontrollgruppe berichten.
Die statistische Analyse ist bei allen drei Studien eine Intention-to-treat-Analyse.
|
Tabelle 27: Studien zur medizinischen Wirksamkeit: Statistische Analyse |
|
|
Studie, Jahr |
Statistische Analyse |
|
Semiglazov (2004) |
Intention-to-treat und zusätzlich eine Kovarianzanalyse mit Baseline-Messung als Kovariate, da zu Beginn der Studie trotz Randomisierung eine Ungleichverteilung der Teilnehmenden bezüglich der GLQ-8-Summe vorliegt |
|
Semiglazov (2006) |
Intention-to-treat |
|
Tröger (2009), (2014) |
Intention-to-treat |
|
Tröger (2012), (2016) |
Intention-to-treat |
Intention to treat: Zuordnung auch der Studienabbrecher und Patienten, die die Behandlungsgruppen gewechselt haben wie zum Zeitpunkt der Randomisierung.
Per protocol: Nur Personen, die so behandelt wurden wie im Protokoll vorgesehen, werden entsprechend der randomisierten Gruppe in die Auswertung eingeschlossen.
GLQ‑8 = Global Life Quality.
In Tabelle 28 werden die Ein- und Ausschlusskriterien der RCT zur Bewertung der Wirksamkeit der Misteltherapie, untergliedert nach den einzelnen Studien, genannt. Die Ein- und Ausschlusskriterien für Semiglazov et al. (2004) und Semiglazov et al. (2006) sind identisch, da sich die Zielpopulation von der Dosisfindungsstudie zur Hauptstudie nicht geändert hat. Die Studienpopulationen der beiden Studien sind unabhängig voneinander und überschneiden sich nicht.
|
Studie, Jahr |
Ein- und Ausschlusskriterien |
|
Semiglazov (2004) |
Einschlusskriterien:
Ausschlusskriterien:
|
|
Semiglazov (2006) |
Identisch zu Semiglazov (2004) |
|
Tröger (2009), (2014), (2012), (2016) |
Einschlusskriterien:
Ausschlusskriterien:
< 100.000/mm3 im Serum; Gabe von Immunstimulantien oder Immunsuppressiva (außer gegen Übelkeit und Erbrechen)
|
CAF = Cyclophosphamid, Adriamycin und 5‑Fluorouracil. CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil. KPI = Karnofsky Performance Index. TNM = T: Tumor, N: Nodus, M: Metastasen. SGOT = Serum-Glutamat-Oxalacetat-Transaminase. SGPT = Serum-Glutamat-Pyruvat-Transaminase.
Die Einschlusskriterien der Studien sind vergleichbar. Das Alter der gewünschten Zielpopulation beginnt bei 18 Jahren. Semiglazov et al.139, 140 haben als Altersobergrenze 55 Jahre vorgesehen und setzen mindestens sieben Jahre Schulbildung voraus. Außerdem muss die Patientin in der Lage sein, den Fragebogen selbstständig auszufüllen. Tröger et al. beschränken das Alter nach oben nicht, jedoch müssen die Probandinnen mindestens einen KPI von 60 % erreichen. Ein KPI von 60 % entspricht der Beschreibung: „Benötigt gelegentlich fremde Hilfe, kann die meisten persönlichen Angelegenheiten selbst erledigen“.20
Eine Operation und die Indikation für eine Chemotherapie nach dem geforderten Therapieschema ‑CMF bei Semiglazov et al.139, 140 und CAF bei Tröger et al.141, 143 (CAF = Cyclophosphamid,
Adriamycin und 5‑Fluorouracil, CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil) – sind für alle Studien Einschlusskriterium.
Alle drei Studien schließen Patientinnen mit Metastasen und beeinträchtigenden Vorerkrankungen, Schwangerschaft und Stillzeit oder Alkohol- oder Drogenkonsum aus und fokussieren auf die Tumorklassifikationen T1 bis T3, d. h. ein invasiver Tumor muss vorliegen. Des Weiteren müssen vor Studienbeginn eine Operation erfolgt und eine Chemotherapie geplant sein. Patientinnen, die eine Hormontherapie oder Bestrahlung erhalten, werden ausgeschlossen.
Für alle drei Studien sind eine operative Entfernung des Tumors und eine Indikation zur Chemotherapie Voraussetzungen für die Studienteilnahme und eine zusätzliche Bestrahlung oder Hormontherapie ein Ausschlussgrund. Die Standardtherapie ist im RCT-Setting vordefiniert und jeweils für alle Studienarme dieselbe. In Tabelle 29 sind sämtliche Interventionsformen im Rahmen der Studie mit Nennung der Wirkstoffe in der jeweils verwendeten Dosis beschrieben.
Tabelle 29: Intervention und Vergleichsintervention der Studien
|
Studie, Jahr |
Standardtherapie |
Intervention/Form der Misteltherapie |
Vergleichstherapie |
Zusätzliche Therapie |
|
Semiglazov (2004) |
Operation + adjuvante CMF-Chemotherapie i. v. C: 500 mg/m2, M: 40 mg/m2, 5‑FU: 600 mg/m2; 4 Zyklen |
Lektinol® 0,5 ml, 10, 30 oder 70 ng ML pro ml, 2 x pro Woche s. c., am 1. und 4. Tag des Zyklus über 15 Wochen |
Placebo 2 x pro Woche |
Antiemetische Therapie 10 mg Dexamethason i. v. und 10 mg Metoclopramid per os |
|
Semiglazov (2006) |
Operation + adjuvante CMF-Chemotherapie i. v. C: 600 mg/m2, M: 40 mg/m2, 5‑FU: 600 mg/m2; 4 bis 6 Zyklen |
Lektinol® 0,5ml, 30 ng ML pro ml, 2 x pro Woche s. c., am 1. und 4. Tag des Zyklus über 15 Wochen parallel zur Chemotherapie und zusätzlich 2 Monate nach der Chemotherapie |
Placebo 2 x pro Woche |
Antiemetische Therapie 10 mg Dexamethason i. v. und 10 mg Metoclopramid per os |
|
Tröger (2009), (2014), (2012), (2016) |
Operation + CAF Chemotherapie i. v. C: 500 mg/m2, A: 50 mg/m2, 5‑FU: 500 mg/m2; 6 Zyklen |
Iscador® Aufdosierungsphase: 3 x pro Woche: 2x 0,01 mg, 2 x 0,1 mg, 11 x 1 mg, 8 x 2 mg; Erhaltungsphase: 5 mg 3 x pro Woche; Helixor® A Aufdosierungsphase: 3 x 1 mg, 3 x 5 mg, 3 x 10 mg, 3 x 20 mg, 3 x 30 mg; Erhaltungsdosis: 50 mg 3 x pro Woche* |
Nur Standardtherapie |
Antiemetische Therapie Ondansetronchlorid 8 mg, Dexamethason 8 mg und Ranitidin 50 mg |
|
Tröger (2012), (2016) |
Zusätzliche Therapie nach der Interventionsphase von 18 Wochen Strahlentherapie Hormontherapie Trastuzumab Docetaxel |
A = Adriamycin, Wirkstoff Doxorubicin. C = Cyclophosphamid. CAF = Cyclophosphamid, Adriamycin und 5‑Fluorouracil.
CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil. i. v. = Intravenös. M = Methotrexat. ML = Mistellektin. per os = Durch den Mund. s. c. = Subkutan. 5‑FU = 5‑Fluorouracil.
mg/m2: Milligramm des Wirkstoffs pro Quadratmeter Körperoberfläche.
* abweichend zu Tröger et al. (2014) wird in Tröger (2016) als maximale Dosis für Helixor® 100 mg 3 x wöchentlich angegeben.
Im folgenden Abschnitt werden die Interventionen der Studien für jede Studie einzeln in derselben Reihenfolge berichtet: Operation, Chemotherapie, antiemetische Therapie und Misteltherapie.
In der Studie von Semiglazov et al. (2004)139 ist bei allen Patientinnen vor der Chemotherapie eine Operation erfolgt, jedoch wurde bei manchen Patientinnen nicht die gesamte Brustdrüse entfernt, sondern nur eine Teilentfernung der Brustdrüse durchgeführt, um die Brust zu erhalten. Unterschieden wird in der Publikation zwischen vollständiger oder einfacher Mastektomie (als einer Gruppe) und der partiellen Mastektomie als zweiter Gruppe. Eine vollständige oder einfache Mastektomie erhielten: 65 Patientinnen (92,9 %) der Kontrollgruppe, 60 Patientinnen (89,6 %) der Gruppe mit niedriger Dosis, 59 Patientinnen (88,1 %) der Gruppe mit mittlerer Dosis und 75 Patientinnen (83,8 %) der Gruppe mit hoher Dosis. Eine partielle Mastektomie ist deutlich seltener durchgeführt worden: bei fünf Patientinnen (7,1 %) der Kontrollgruppe, sieben Patientinnen (10,4 %) der Niedrigdosisgruppe, acht Patientinnen (11,9 %) der Gruppe mit mittlerer Dosis und elf Personen (16,2 %) aus der Hochdosisgruppe. Die Studienintervention startet erst nach der Operation.
Alle Teilnehmerinnen der Studie erhalten als adjuvante Standardtherapie eine Chemotherapie nach dem CMF-Schema, bestehend aus vier Zyklen in einem Vier-Wochen-Intervall. Die Wirkstoffe der CMF-Chemotherapie sind: 500 mg/m2 Cyclophosphamid, 40 mg/m2 Methotrexat und 600 mg/m2 5‑Fluorouracil. Die Wirkstoffe werden den Patientinnen am ersten und achten Tag des Zyklus intravenös injiziert. Die Chemotherapie ist nach zwölf Wochen beendet. Im Anschluss folgen drei Wochen, in denen die Patientinnen nur noch die Misteltherapie beziehungsweise das Placebo erhalten. Zusätzlich wird den Patientinnen eine antiemetische Therapie verabreicht, um die Verträglichkeit der Zytostatika zu verbessern indem Übelkeit und Erbrechen verringert werden. Die Patientinnen erhalten dafür 10 mg Dexamethason intravenös und vier Dosen mit je 10 mg Metoclopramid, oral, am Tag der Chemotherapie.
Die drei Interventionsarme mit Misteltherapie erhalten jeweils unterschiedliche Konzentrationen desselben Mistelextrakts „Lektinol®“, ein auf Mistellektin standardisierter Mistelextrakt. Der vierte Studienarm, die Kontrollgruppe, erhält ein Placebo, das in Geruch, Aussehen und Verpackung nicht vom Mistelpräparat zu unterscheiden ist und identisch angewendet wird. Über einen Zeitraum von 15 aufeinanderfolgenden Wochen werden den Teilnehmerinnen zweimal pro Woche 0,5 ml der Studienmedikation subkutan verabreicht. Die Gabe der Mistelextrakte dauert drei Wochen länger als die Chemotherapie, die nach zwölf Wochen (vier Zyklen) beendet ist. Die Vergleichstherapie besteht aus der Standardtherapie und der Gabe eines Placebos, das in Aussehen, Geruch und Verpackung nicht von dem Verum, dem wässrigen Mistelextrakt, unterschieden werden konnte.
Auch bei Semiglazov et al. (2006)140 wurden alle Patientinnen operiert, jedoch wird wie in Semiglazov et al. (2004) nicht bei allen Patientinnen vergleichbar viel Gewebe entfernt. Eine radikale oder einfache Mastektomie haben 145 Patientinnen (82,4 %) aus der Interventions- und 143 Patientinnen (81,3 %) der Kontrollgruppe erhalten. 31 Personen (17,6 %) aus der Lektinol®-Gruppe und 33 Patientinnen (18,8 %) aus der Kontrollgruppe wird nur ein Teil der Brustdrüse entnommen.
Die adjuvante Standardtherapie ist eine Chemotherapie nach dem CMF-Schema, bestehend aus 600 mg/m2 Cyclophosphamid, 40 mg/m2 Methotrexat und 600 mg/m2 5‑Fluorouracil, das den Patientinnen am ersten und achten Tag des Zyklus intravenös injiziert wird. Die Patientinnen erhalten zwischen vier und sechs Zyklen der Chemotherapie. Ein Zyklus hat 28 Tage. Somit dauerte die Chemotherapie zwischen 16 und 24 Wochen. Patientinnen erhalten am Tag der Chemotherapie als antiemetische Therapie 10 mg Dexamethason intravenös und viermal am Tag 10 mg Metoclopramid oral.
Das verwendete Mistelpräparat ist Lektinol®. In Semiglazov et al. (2006)140 wird eine Interventions- mit einer Kontrollgruppe verglichen. Die verwendete Dosis ist 30 ng Mistellektin pro ml, weil diese in der Studie von Semiglazov (2004)139 die beste Wirksamkeit und Verträglichkeit zeigte. Das Placebo hat ein identisches Erscheinungsbild in Farbe, Geruch und Verpackung, sodass dieses nicht vom Mistelpräparat zu unterscheiden ist. 0,5 ml der Mistelextrakte beziehungsweise des Placebos werden zweimal pro Woche, immer am ersten und am vierten Tag der Woche, gegeben. Falls der Tag mit der Chemotherapie zusammentrifft wird der Mistelextrakt vor der Chemotherapie injiziert. Die Gabe der Mistelextrakte erfolgt über 16 beziehungsweise 24 aufeinanderfolgenden Wochen, abhängig davon ob vier oder sechs Zyklen Chemotherapie gegeben werden. Die Mistelextrakte beziehungsweise das Placebo werden auch während der zwei Zyklen nach der Chemotherapie verabreicht. Für den HTA-Bericht wird die Beobachtungsphase von zwei Monaten nach der Chemotherapie, in der nur eine Misteltherapie verabreicht wird, nur für die Bewertung der unerwünschten Wirkungen der Misteltherapie verwendet, nicht jedoch für die Bewertung der Lebensqualität, weil die primäre Zielgröße der Studie die Veränderung von der Baseline-Erhebung bis zum Zeitpunkt nach 15 Wochen ist.
Für die Studie von Tröger et al. (2009 und 2014)141, 143 wurden nur Patientinnen rekrutiert, die bereits operiert waren und im Anschluss eine adjuvante Chemotherapie mit sechs Zyklen nach dem CAF-Schema verordnet bekommen haben. Die verwendeten Zytostatika sind: Cyclophosphamid (500 mg/m2), Adriamycin (50 mg/m2) und 5‑Fluorouracil (500 mg/m2). Ein Zyklus dauert drei Wochen. Zusätzlich bekommen alle Patientinnen vor jedem CAF-Zyklus eine antiemetische Therapie am Tag der Chemotherapie. Sie besteht aus 8 mg Ondansetronchlorid, 8 mg Dexamethason und 50 mg Ranitidin, jeweils als Einzeldosis verabreicht. Weitere Therapien sind nicht erlaubt. Außer einer ausgeschiedenen Patientin aus der Kontrollgruppe haben alle Teilnehmerinnen die geplanten sechs Zyklen der CAF-Chemotherapie erhalten.
Die dreiarmige Studie von Tröger (2009, 2012, 2014 und 2016) vergleicht die beiden Mistelextrakte Iscador® und Helixor® mit einer Kontrollgruppe. Parallel zur Chemotherapie wurden die Mistelextrakte über 18 Wochen von den Patientinnen dreimal pro Woche selbst injiziert. Die Dosis der Mistelextrakte wird nach Herstellerempfehlungen schrittweise aufdosiert bis die Erhaltungsdosis erreicht ist. Die Dosen in der Aufdosierungsphase sind für Iscador®: 2 x 0,01 mg, 2 x 0,1 mg, 11 x 1 mg, 8 x 2 mg. Danach wird die Erhaltungsdosis von 5 mg 3 x pro Woche gehalten. Die Konzentration für Helixor® ist in der Aufdosierungsphase: 3 x 1 mg, 3 x 5 mg, 3 x 10 mg, 3 x 20 mg, 3 x 30 mg. Die Erhaltungsdosis beträgt 50 mg. Wenn dosisabhängige Entzündungen an der Injektionsstelle auftraten und 5 cm Durchmesser überstiegen, wurde die Dosis reduziert oder die Misteltherapie unterbrochen, bis die Reaktionen wieder abgeklungen waren.
Die Studienmedikationen mit den Mistelextrakten in Kochsalzlösung in unterschiedlichen Konzentrationen, wurden von der WELEDA® AG beziehungsweise von der Helixor® Heilmittel GmbH & Co. KG hergestellt. Die Patientinnen erhielten zu Beginn der Studie Schulungen, wie sie sich die Mistelextrakte selbst injizieren können. Die Kontrollgruppe erhielt nur die Standardtherapie, kein Placebo.
Nach den 18 Wochen der Interventionszeit und dem Ende der Zielgrößenerhebung zu Lebensqualität und UAW erhielten die Patientinnen in den drei Studienarmen zum Teil weitere Therapien, die das krankheitsfreie Überleben beeinflussen können: Strahlentherapie, antihormonelle Therapie mit Tamoxifen, Therapie mit Trastuzumab oder Docetaxel.
In Tabelle 30 ist eine vollständige Liste der primären und sekundären Zielgrößen, wie in den Studien zur Bewertung der medizinischen Wirksamkeit angegeben. Zielgrößen, die im Rahmen des HTA-Berichts für die Bewertung der medizinischen Wirksamkeit und Sicherheit relevant sind, werden in Tabelle 31 noch separat zusammengefasst.
Tabelle 30: Primäre und sekundäre Zielgrößen der Studien
|
Studie und Jahr |
Zielgrößen |
|
Semiglazov (2004) |
Primäre Zielgrößen:
Sekundäre Zielgrößen:
|
|
Semiglazov (2006) |
Primäre Zielgrößen: Lebensqualität: Veränderung von 3 FACT-G-Subskalen (physisches, emotionales und funktionelles Wohlbefinden) Sekundäre Zielgrößen:
|
|
Tröger (2009), (2014) |
Primäre Zielgrößen:
Sekundäre Zielgrößen (nicht als Zielgrößen definiert):
|
|
Tröger (2012), (2016) |
Post-hoc-Analyse Krankheitsfreies Überleben nach 5 Jahren
|
EORTC = European Organisation for Research and Treatment of Cancer. FACT‑G = Functional Assessment of Cancer Therapy – General. GLQ‑8 = Global Life Quality.
Die Messung der Lebensqualität der Patientinnen mit Brustkrebs stellt bei allen drei Studien mindestens eine der primären Zielgrößen dar. Eine Reihe an zusätzlichen sekundären Zielgrößen wird von Semiglazov et al. (2004 und 2006)139, 140 erhoben, um die Wirkung und Verträglichkeit der Misteltherapie zusätzlich über Labortests zu hämatologischen und immunologischen Parametern zu beschreiben. Tröger et al.141, 143 berichten als Zielgrößen nur den Lebensqualitätsfragebogen EORTC-QLQ-C30 und Neutropenie, schreiben jedoch im Text zur Bewertung der Sicherheit, dass sie die Patientinnen zu UAW befragen und bei jedem Besuch Labortests erheben und die Ergebnisse analysieren. In der Follow-up Erhebung nach fünf Jahren142, 144 wird das krankheitsfreie Überleben analysiert. Die Patientinnen kommen einmal jährlich zur Nachsorgeuntersuchung, in der das Auftreten von Rezidiven oder Metastasen kontrolliert wird. Sobald eines der beiden Ereignisse aufgetreten ist, scheiden die Patientinnen aus der Studie aus.
In Tabelle 31 sind die im Methodenteil für die Bewertung der medizinischen Wirksamkeit definierten Zielgrößen der Studien in einer Übersichtstabelle zusammengefasst. Zudem sind die Messinstrumente genannt, die in den Studien zur Lebensqualitätsmessung verwendet werden. Für Zielgrößen, die mit einem „x“ bewertet werden, sind Ergebnisse für den HTA-Bericht verwertbar berichtet. Die Ergebnisse werden im Abschnitt 5.1.2.1.8 ausführlich dargestellt.
Tabelle 31: Auflistung der relevanten Endpunkte nach Studien
|
Semiglazov (2004) |
Semiglazov (2006) |
Tröger (2009), (2014) |
Tröger (2012), (2016) |
|
|
Primäre Zielgrößen |
||||
|
Unerwünschte Nebenwirkungen der Standardtherapie (Fatigue, Übelkeit, Schmerzen) |
x |
x |
x |
|
|
HRQOL |
x |
x |
x |
- |
|
EORTC-QLQ-C-30 (Mit Unterskalen) |
* |
- |
x |
- |
|
FACT‑G Score |
- |
x |
- |
- |
|
GLQ‑8 Bewertungsskala |
x |
x |
- |
- |
|
Spitzer-Analogskala |
x |
x |
- |
- |
|
Sekundäre Zielgrößen |
||||
|
Gesamtüberleben |
- |
- |
- |
- |
|
Progressionsfreies Überleben |
- |
- |
- |
x |
x Daten werden berichtet und sind verwertbar.
* Ergebnisse werden in Textform berichtet, sind aber nicht für die Bewertung der Wirksamkeit verwertbar.
- Es werden keine Daten berichtet.
EORTC = European Organisation for Research and Treatment of Cancer. FACT‑G = Functional Assessment of Cancer Therapy – General. GLQ‑8 = Global Life Quality.
In den eingeschlossenen Studien zur Bewertung der medizinischen Wirksamkeit werden nicht alle der in den Forschungsfragen des HTA in Kapitel 2.1 adressierten Zielgrößen untersucht, jedoch konnten Ergebnisse zur HRQOL, zu den UAW der Standardtherapie und zum progressionsfreien Überleben berichtet werden. Vier verschiedene Instrumente zur Messung der Lebensqualität werden verwendet. Der FACT-G-Score wird nur in Semiglazov et al. (2006)140 abgefragt. Die GLQ-8-Bewertungsskala und die Spitzer-Analogskala werden beide sowohl in Semiglazov et al. (2004)139 als auch in Semiglazov et al. (2006)140 als Messinstrument für die Lebensqualität verwendet. Der EORTC-QLQ-C30-Fragebogen ist sowohl in der Studie von Tröger et al. (2009 und 2014)141, 143 als auch bei Semiglazov et al. (2004)139 als Zielgröße aufgeführt, jedoch werden die Ergebnisse nur für die drei Studienarme der Tröger-Studie verwertbar berichtet.
Die Messung der Zielgrößen zur Lebensqualität mit dem Zeitpunkt der Erhebung ist in allen Studien klar beschrieben. In der Publikation von Semiglazov et al. (2004)139 wird berichtet, dass die im Original englischsprachigen Skalen (GLQ‑8 und Spitzer-Analogskala) vor der Verwendung in die bulgarische und russische Sprache übersetzt wurden. Um sicher zu stellen, dass die Patientinnen die Fragestellungen richtig verstehen, standen Onkologen zur Verfügung, die beide Sprachen fließend beherrschen. Der Erhebungsprozess der Daten zur Lebensqualität erfolgt nach vorab strikt festgelegtem Ablauf. Die Patientinnen füllen die Skalen zu sechs verschiedenen Zeitpunkten im Studienzentrum aus. Erhebungszeitpunkte sind: zu Beginn jedes CMF-Zyklus vor der Gabe der Chemotherapie (insgesamt vier Messungen), zwei Wochen nach dem vierten Zyklus und drei Wochen nach dem vierten Zyklus. Die berichteten Zielgrößen in GLQ‑8 und Spitzer-Analogskala berichten die Veränderung der Mittelwerte von der Anfangsmessung zu den Werten in Woche 14 beziehungsweise Woche 15. Zwei Messungen finden statt nachdem die Chemotherapie bereits zwei beziehungsweise drei Wochen abgeschlossen ist. Bei Semiglazov et al. (2006)140 werden die Lebensqualitätsfragebögen vor der Chemotherapie, am ersten Tag jedes Zyklus, und am 15. und 21. Tag des vierten Zyklus gemessen (entspricht 92 beziehungsweise 99 Tagen ab Beginn der Chemotherapie). Die Tage entsprechen jeweils dem ersten Tag in Woche 15 und 16. An diesen beiden Tagen werden die Daten für den Wert des Studienendpunkts erhoben. Der Vergleichswert nach 15 Wochen ist der Durchschnitt aus den beiden Messungen. Die Follow-up-Phase wird im HTA nicht beachtet.
Tröger et al. (2009 und 2014)141, 143 verwenden den EORTC-QLQ-C30 in der offiziellen serbischen Übersetzung und erheben diesen bei sieben Arztbesuchen der Patientin, vor jedem CAF-Zyklus und drei Wochen nach dem letzten Zyklus. Für jeden ausgefüllten Bewertungsbogen wird der Mittelwert, getrennt nach Studienarm, für die Veränderung zum Baseline-Wert berechnet und mit den anderen Gruppen beziehungsweise Studienarmen verglichen.
Die Messinstrumente für die Zielgrößen zur Lebensqualität und wie diese zu interpretieren sind, ist in Tabelle 32 genauer beschrieben. Die Definition und Operationalisierung der Messinstrumente zur Erhebung der Lebensqualität bezieht sich auf die Verwendung in den eingeschlossenen Studien.
Tabelle 32: Definition und Operationalisierung der Zielgrößen (Reihenfolge alphabetisch)
|
Zielgröße |
Definition und Operationalisierung |
|
EORTC-QLQ-C-30-Skala270–273 |
Die Skala ist ein mehrdimensionaler Index zum aktuellen Gesundheitszustand, der von der Patientin selbst ausgefüllt wird. Der Fragebogen besteht aus 30 Fragen mit insgesamt fünf Funktionsskalen: körperliche Funktion (5 Items), Rollenfunktion (2 Items), kognitive Funktion (2 Items), emotionale Funktion (4 Items) und soziale Funktion (2 Items), globaler Gesundheitsstatus beziehungsweise Lebenszufriedenheit und neun Symptomwerten in zusätzlichen Skalen: Symptomskalen zu Fatigue (3 Items), Übelkeit und Erbrechen (2 Items) sowie Schmerz (2 Items) und sechs Einzelitems. Die Skalen beziehungsweise Items werden auf die Wertebereiche von 0 bis 100 transformiert. Höhere Werte bei Funktions-Scores entsprechen einem höheren Funktionsniveau und sind besser als niedrige Werte. Bei Symptom-Scores entsprechen höhere Werte einer größeren Symptomausprägung und sind schlechter als niedrige Werte. Es gibt auch einen Gesamt-Score, bei dem die Werte von 13 Subskalen addiert werden. Die Fragen zur Gesamtlebensqualität und zu finanziellen Belastungen sind nicht im Gesamt-Score integriert. Symptomskalen müssen vor dem Addieren umgedreht werden, damit die Richtung des Effekts vergleichbar ist mit dem der Funktionsskalen. Zur Beurteilung klinisch relevanter Unterschiede für Patientinnen mit Brustkrebs werden von den Entwicklern des Fragebogens Referenzwerte zur Verfügung gestellt, unterschieden nach Altersgruppe und Schweregrad der Erkrankung.271 King et al. (1996) beschreiben für jede einzelne Frage im EORTC-QLQ-C30-Fragebogen Punktwerte, ab denen ein Unterschied als kleiner oder großer klinisch relevanter Effekt interpretiert werden kann.272 Eine Studie von Osoba et al. (1998) empfehlen Punktwerte für einen klinisch relevanten Unterschied kleinen Ausmaßes ab einem Unterschied von fünf bis zehn Punkten, für einen moderaten Unterschied zehn bis 20 Punkte und für einen großen Unterschied über 20 Punkte.273 |
|
FACT-G-Score274–276 |
Der FACT-G-Fragebogen ist ein Selbstbeurteilungsverfahren, d. h. der Fragebogen wird von der Patientin selbst ausgefüllt. Bezugszeitraum sind die vergangenen sieben Tage. Es gibt je nach Lokation des Tumors in verschiedenen Fassungen. Das „G“ steht für „general“. Der FACT-G-Score ist die allgemeine Fassung des FACT-Fragebogens, den es auch in tumorspezifischen Fassungen gibt, mit vier Kategorien: körperliches Wohlbefinden (6 Items), Funktionsfähigkeit (7 Items), Verhältnis zu Freunden, Bekannten und Familie (6 Items) und seelisches Wohlbefinden (6 Items). Jedes Element kann fünf verschiedene Ausprägungen annehmen: 0, 1, 2, 3 und 4. Die Punkte werden für den Zielwert, dem FACT‑G Score, addiert. Spannweite für die Gesamtpunktzahl ist somit bei 25 Fragen mit jeweils maximal vier Punkten pro Frage von 0 (schlechtestes) bis 100 (bestes Ergebnis). |
|
GLQ‑8277, 278 |
Der GLQ-8-Fragebogen ist ein Instrument, um unerwünschte Effekte einer Krebserkrankung und ‑therapie zu erheben. Der GLQ-8-Score ist die Summe aus acht linearen Analogskalen (LASA)*. Die Fragen beinhalten folgende acht Bereiche: 1. Angstzustände oder Depression, 2. Unwohlsein (Übelkeit oder Schwindel), 3. Taubheit oder Kribbeln, 4. Haarausfall, 5. Müdigkeit, 6. Appetit oder Geschmackssinn, 7. Sexualleben, und 8. die Überzeugung, eine Behandlung zu bekommen. Bei der Standard-LASA wird jeder Punkt auf einer Skala von 0 bis 2 bewertet und anschließend aufsummiert. Ergebnis ist ein Summen-Score zwischen 0 und 10. Semiglazov et al. verwenden eine adaptierte Fassung, die von 0 bis 100 geht. 0 entspricht dabei der höchsten Lebensqualität und 100 der niedrigsten Lebensqualität. Ein positiver Effekt der Misteltherapie hätte eine Abnahme des Scores zur Folge. Die acht linearen Analogskalen werden von der Patientin selbst ausgefüllt. Je niedriger der Summen-Score ist, desto besser. |
|
Spitzer- Analogskala278, 279 |
Die Spitzer-Analogskala ist eine einzelne LASA-Skala zur allgemeinen Lebensqualität. Die Spitzer-Analogskala wird im Englischen auch als „Uniscale“ bezeichnet und ist kein Teil des Spitzer-Index, sondern ein eigenständiges validiertes Instrument zur Erhebung des aktuellen Gesundheitszustands. Der Spitzer-Index ist ein krebsspezifisches Messinstrument für die Lebensqualität mit fünf LASA-Skalen zu den Bereichen Aktivität, Alltagsleben, Gesundheit, Unterstützung und Erwartung an das weitere Leben, die zu einem Index aufsummiert werden.280 Die visuelle Analogskala kann Ausprägungen von 0 bis 100 annehmen und wird von der Patientin ausgefüllt, indem die Stelle markiert wird, die den aktuellen Gesundheitszustand abbildet. Der Abstand der Markierung vom linken Rand wird in Millimetern gemessen und stellt die Zielgröße des Instruments dar. Der Extremwert 0 beschreibt den bestmöglichen und 100 den schlechtesten vorstellbaren Gesundheitszustand. Eine niedrige Punktzahl entspricht einer guten Lebensqualität und eine hohe Punktzahl einer schlechten Lebensqualität der Patientin. |
EORTC-QLQ-C-30 = European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire ‑brustkrebsspezifische Version). FACT‑G = Functional Assessment of Cancer Therapy – General. GLQ = Global Life Quality. LASA: = Linear analogue self-assessment.
Die Bewertung des Verzerrungspotenzials, auf Englisch „risk of bias“ (ROB), erfolgt auf Studienebene und bezogen auf die jeweiligen Zielgrößen. Es wird unterschieden zwischen subjektiven und objektiven Zielgrößen. Zu den subjektiven Zielgrößen gehören alle Fragebögen zur Erhebung der Lebensqualität und von Patientinnen oder Behandelnden bewertete Nebenwirkungen der Chemo- oder Misteltherapie. Entscheidend für die Einschätzung von Endpunkten, die von Patientinnen selbst berichtet werden (Fragebogenerhebungen oder Befragung), sind Informationen über den Prozess der Datenerhebung, die in den Publikationen großteils berichtet werden. Objektive Zielgrößen der Studien sind beispielsweise Lokalreaktionen, die anhand der Größe der Ausdehnung bewertet werden, oder Labortestergebnisse, die anhand vorab definierter Grenzwerte analysiert und bewertet werden.
In Tabelle 33 ist eine Übersicht zur Bewertung des Verzerrungspotenzials über das ROB-Tool der Cochrane Collaboration. Die ausführlichen Tabellen mit Begründungen für die Bewertung sind im Anhang zu finden (siehe Tabelle 112, Tabelle 113, Tabelle 114 und Tabelle 115).
Tabelle 33: Risiko für Bias in den zur Bewertung der medizinischen Wirksamkeit eingeschlossenen Studien
|
Generierung der Randomisierungssequenz (Selection-Bias) |
Verdeckte Gruppenzuteilung (Selection-Bias) |
Verblindung von Teilnehmenden n und Studienpersonal subjektive Endpunkte (Performance-Bias) |
Verblindung von Teilnehmenden und Studienpersonal objektive Endpunkte (Performance-Bias) |
Verblindung der Endpunkterhebung subjektive Endpunkte (Detection-Bias) |
Verblindung der Endpunkterheb objektive Endpunkte (Detection-Bias) |
Unvollständige Daten zu Endpunkten (Attrition-Bias) |
Selektives Berichten von Endpunkten (Reporting-Bias) |
Andere Ursachen für Bias |
|
|
Semiglazov (2004) |
+ |
7 |
7 |
4 |
7 |
4 |
4 |
7 |
4 |
|
Semiglazov (2006) |
+ |
7 |
7 |
4 |
7 |
4 |
*4* |
7 |
4 |
|
Tröger (2009) (2012) |
4 |
+ |
7 |
7 |
7 |
4 |
|||
|
Tröger (2014) |
4 |
4 |
7 |
7 |
1 |
7 |
4 |
||
|
Tröger (2016) |
+ |
+ |
■f |
7 |
4 |
7 |
4- |
Hohes Risiko
Unklares Risiko
Geringes Risiko
Die Generierung der Randomisierungssequenz erfolgte in allen Studien über eine computerbasierte Randomisierung und ist in allen Publikationen berichtet. Eine verdeckte Gruppenzuteilung ist nur in den Publikationen von Tröger et al. (2009 und 2014)141, 143 berichtet, Semiglazov et al. (2004 und 2006)139, 140 berichten nichts dazu und erhalten deswegen die Bewertung „unklares Risiko“.
Die Verblindung von Teilnehmern und Studienpersonal erfolgt in beiden Studien von Semiglazov et al. (2004 und 2006)139, 140 über die Gabe eines Placebos. Das Placebo ist in Farbe, Geruch und Aussehen nicht von dem Mistelpräparat zu unterscheiden. Da jedoch bei Mistelinjektionen häufig Lokalreaktionen auftreten, ist ein Durchbrechen der Verblindung wahrscheinlich. Für subjektive Endpunkte ist das Risiko für eine Verzerrung deshalb mit unklar bewertet, für objektive Endpunkte, in der Regel ärztlich erhobene in ihrem Umfang vorher definierte Lokalreaktionen oder Laborparameter wird ein geringes Verzerrungspotenzial angenommen. Bei Tröger et al. (2009 und 2014)141, 143 hingegen erhält die Kontrollgruppe kein Placebo und es besteht keine Verblindung. Der Einfluss auf den Behandlungsprozess bei subjektiven Endpunkten erscheint wahrscheinlich, was einem hohen Risiko für eine Verzerrung entspricht. Bei objektiven Zielgrößen wie dem krankheitsfreien Überleben ist der Einfluss fraglich.
Zur Verblindung bei der Endpunkterhebung gibt es in keiner der Publikationen Informationen. Für die Publikationen von Semiglazov et al. (2004 und 2006)139, 140 bedeutet die Doppelverblindung der Gruppen mittels Placebo für subjektive Endpunkte automatisch auch eine verblindete Endpunkterhebung, aber da eine Aufdeckung der Verblindung nicht unwahrscheinlich ist, besteht daher für die subjektiven Endpunkte ein unklares Risiko für eine Verzerrung der Ergebnisse. Bei objektiven Endpunkten erscheint das Risiko für eine Verzerrung gering. Bei Tröger et al. ergibt sich auch hier durch die fehlende Verblindung bei subjektiven Endpunkten – besonders für die Fragebögen zur Lebensqualität – ein hohes Verzerrungspotenzial. Die Auswirkung der fehlenden Verblindung auf objektive Endpunkte wie dem krankheitsfreien Überleben wird als unklar bewertet.
In den drei Studien ist der Loss-to-follow-up relativ gering (siehe Zahlen zum Patientinnenfluss in Tabelle 34). Die beiden Studien von Semiglazov et al. (2004 und 2006)139, 140 zeigen einen sehr geringen Loss-to-follow-up zwischen 1,5 und 6,8 % nach 15 Wochen. Die Studie von Tröger et al. hat zwei Follow-up-Zeitpunkte, nach 18 Wochen und nach fünf Jahren. Während im Iscador®-Studienarm und in der Kontrollgruppe keine oder sehr geringe Verluste nach 18 Wochen (0 beziehungsweise 3,3 %) und auch nach fünf Jahren (6,7 beziehungsweise 6,5 %) auftraten, schieden im Helixor®-Studienarm mit 14,7 beziehungsweise 17,6 % deutlich mehr Patientinnen aus.143, 144 Von den fünf Studienabbrechern nach 18 Wochen beziehungsweise sechs nach fünf Jahren besteht nur für eine Person mit einer allergischen Reaktion auf die Misteltherapie, ein Zusammenhang mit der Intervention, die anderen haben ihre Einverständniserklärung zurückgezogen. Allerdings wird in der Publikation von Tröger et al. (2009)141, in der Daten zur HRQOL analysiert wurden, berichtet, dass die ausgefallenen Personen ersetzt worden wären. Nähere Angaben wurden nicht gemacht. Dies könnte das Intention-to-treat-Prinzip infrage stellen, deshalb weisen wir den Ergebnissen des Helixor®-Studienarms im Vergleich zur Kontrollgruppe nach 18 Wochen ein unklares Verzerrungspotenzial zu. Alle anderen Studien hier ein geringes Verzerrungsrisiko auf.
Zum Punkt „selektives Berichten von Endpunkten“ kann bei keiner Publikation eine Einschätzung abgegeben werden, weil keine Protokolle zu den Studien veröffentlicht sind. Somit erhalten alle Publikationen die Bewertung „Unklares Verzerrungsrisiko“.
In den Publikationen werden keine weiteren Hinweise auf Faktoren gefunden, die das Verzerrungspotenzial beeinflussen.
Der Patientinnenfluss beschreibt die jeweiligen Gruppengrößen der Studienarme während des Studienverlaufs und stellt dar, wie viele Patientinnen aus welchen Gründen ausgeschlossen wurden. Die Anzahl der Gruppen und der Teilnehmerinnen unterscheidet sich in den drei Studien deutlich. In Tabelle 34 sind die jeweiligen Teilnehmerzahlen je Gruppe im Detail berichtet.
|
Studie, Jahr |
Anzahl Gruppen |
Anzahl randomisiert |
Anzahl ausgewertet (%) |
Anzahl ausgeschlossen (%) |
|
Semiglazov (2004) |
4: Niedrige Dosis, Mittlere Dosis, Hohe Dosis, Placebo |
272; Niedrige Dosis: 67 Mittlere Dosis: 67 Hohe Dosis: 68 Placebo: 70 |
261 Niedrige Dosis: 66 (98,5) Mittlere Dosis: 65 (97,0) Hohe Dosis: 64 (94,1) Placebo: 66 (94,3) |
11 Niedrige Dosis: 1 (1,5) Mittlere Dosis: 2 (3,0) Hohe Dosis: 4 (5,9) Placebo: 4 (5,7) |
|
Semiglazov (2006) |
2: Lektinol® (30 ng (ML)/ml), Placebo |
352; Lektinol®: 176 Placebo: 176 |
337 nach Z4; Lektinol®: 169 (96,0)* Placebo: 168 (95,5)* 331 Lektinol®: 167 (94,9)* Placebo: 164 (93,2)* |
15 nach Z4: Lektinol®: 7 (4,0) Kontrollgr.: 8 (4,5) 21 Lektinol®: 9 (5,1) Kontrollgr.:12 (6,8) |
|
Tröger (2009), (2014) |
3: Iscador®, Helixor® A, Kontrollgr. |
95; Iscador®: 30 Helixor® A: 34 Kontrollgr.: 31 |
Iscador®: Nach 18 Wochen 30 (100) Nach fünf Jahren 28 (93,3) Helixor® A: Nach 18 Wochen 29 (85,3) Nach fünf Jahren 28 (82,4) Kontrollgr.: Nach 18 Wochen 30 (96,7) Nach fünf Jahren 29 (93,5) |
Iscador®: Nach 18 Wochen 0 (0) Nach fünf Jahren 2 (6,7) Helixor® A: Nach 18 Wochen 5 (14,7) Nach fünf Jahren 6 (17,6) Kontrollgr.: Nach 18 Wochen 1 (3,2) Nach fünf Jahren 2 (6,5) |
Kontrollgr. = Kontrollgruppe. ML = Mistellektin.
Niedrige Dosis: 10 ng(ML)/ml; Mittlere Dosis: 30 ng(ML)/ml; Hohe Dosis: 70 ng(ML)/ml.
T1: Studienstart und Zeitpunkt vor der ersten Gabe von ML.
*Die Angabe der Anzahl der Patientinnen, die wirklich in die Analyse eingingen sind nicht ganz klar. Zum einen bilden die 337 Patientinnen, die mindestens vier Chemotherapiezyklen absolviert haben das sogenannte „final analysis set“, dies entspricht auch der Anzahl der analysierten Patientinnen, die in den Ergebnistabellen angegeben sind. Zum anderen wird angegeben, dass sechs weitere Patientinnen „lost to follow up“ waren.
Da es sich bei der Studie von Semiglazov et al. (2004)139 um eine Dosisfindungsstudie handelt, gibt es verschiedene Interventionsgruppen, die jeweils eine unterschiedliche Konzentration desselben Mistelextraktes Lektinol® erhalten. Die drei Gruppen sind: 10 ng(ML)/ml, auch bezeichnet als „niedrige Dosis“, 30 ng(ML)/ml, auch „mittlere Dosis“ genannt, und die hohe Dosis mit 70 ng(ML)/ml. Die Kontrollgruppe dient als Kontrolle für alle drei Interventionsgruppen. Die 272 Patientinnen der Pilotstudie werden randomisiert auf vier Gruppen verteilt. Die Teilnehmerinnen wurden zu Beginn der Studien randomisiert auf die jeweiligen Studienarme verteilt. Die Gruppen bestehen aus 67 bis 70 Teilnehmerinnen. Es scheiden insgesamt elf Patientinnen im Lauf der Studie aus – eine aus der niedrigen Dosis, zwei aus der mittleren Dosis, vier aus der hohen Dosis und vier aus der Placebogruppe. In der Publikation ist nicht beschrieben, aus welchem Grund Patientinnen aus welcher Gruppe ausgeschieden sind, jedoch schreiben die Autoren, dass keiner der Gründe für das Ausscheiden aus der Studie in Zusammenhang mit der Misteltherapie steht. Von den elf ausgeschlossenen Patientinnen wurde bei vier die Misteltherapie aufgrund von Nebenwirkungen abgebrochen, bei vier war es der eigene Wunsch der Patientin, die Studie zu beenden, und bei drei Patientinnen wurden sonstige Gründe angegeben.
Bei Semiglazov et al. (2006)140 bestehen die beiden Studienarme zu Beginn der Studie jeweils aus 176 Patientinnen. Alle der 352 Patientinnen haben mindestens eine Dosis der Studienmedikation erhalten und wurden in die Auswertung zur Sicherheit einbezogen. Für die Bewertung der Wirksamkeit wurden nur die Patientinnen einbezogen, für die eine vollständige Dokumentation für die Analyse vorgelegen
hat. Das war der Fall für 337 Patientinnen – 169 (96 %) bei der Interventionsgruppe und 168 (97,2 %) in der Placebogruppe. Die 15 Patientinnen, für die nicht mindestens vier CMF-Zyklen dokumentiert waren, wurden nicht in die Bewertung der Wirksamkeit eingeschlossen. Keine der 337 Patientinnen hat die Chemotherapie während der ersten vier Chemotherapiezyklen abgebrochen. Da die für die Messung der Lebensqualität relevanten Erhebungen während dieses Zeitraums stattgefunden haben, beeinflussen Ausfälle während der Nachbeobachtungsphase das Ergebnis nicht. Für die Vollständigkeit werden die Gründe für das Ausscheiden der sechs Patientinnen genannt: Zwei Patientinnen aus der Mistelgruppe und eine Patientin aus der Kontrollgruppe haben sich selbst für den Studienabbruch entschieden, eine Patientin aus der Placebogruppe erlitt eine schwere Nebenwirkung und zwei weitere Patientinnen aus der Placebogruppe sind weggezogen.
In der Studie von Tröger et al. (2009, 2014, 2012, 2016)141–144 wurden die 95 Patientinnen auf drei Gruppen randomisiert: Iscador® 30, Helixor® 34, nur Standardtherapie: 31. In der Iscador®-Gruppe bricht nach 18 Wochen keine Patientin ab. Für den Follow-up für die Zielgröße krankheitsfreies Überleben nach fünf Jahren werden zwei Patientinnen (6,7 %) ausgeschlossen, weil hier bereits vor der Chemotherapie zu Beginn der Studie das Vorhandensein von Metastasen unbekannt war. Das Neuauftreten einer Metastase ist ein Ereignis, das das Ende des krankheitsfreien Überlebens definiert, deshalb muss der Status bekannt sein. Die Abbruchquote für den Helixor®-Arm nach 18 Wochen liegt mit fünf Abbrüchen deutlich höher, bei 14,7 %. Vier der fünf Patientinnen haben die Einwilligung für die Studienteilnahme zurückgezogen, eine, weil die Anreise zum Studienzentrum zu aufwendig war. Eine Patientin entwickelte eine allergische Reaktion (Rhinokonjunktivitis), mit hoher Wahrscheinlichkeit aufgrund der Misteltherapie. Es wird angegeben, dass diese fünf Patientinnen ersetzt wurden in der Analyse zu den Zielgrößen HRQOL, UAW der Chemotherapie (Neutropenie), damit in jeder Gruppe mindestens 30 Teilnehmerinnen sind. Wie der Ersatz durchgeführt wurde, wurde nicht beschrieben. In der Follow-up-Analyse zum krankheitsfreien Überleben nach fünf Jahren wurden hingegen nur die ursprünglich randomisierten Patientinnen analysiert. Zu den fünf ausgeschiedenen Patientinnen nach 18 Wochen kam eine sechste Patientin nach fünf Jahren. Sie zog ebenfalls ihre Einwilligung zurück. Demnach wurden von 28 von 34 Patientinnen, also 82,4 % die Daten zum krankheitsfreien Überleben analysiert. In der Publikation von Tröger et al. (2016)144 wird im CONSORT-Flussdiagramm angegeben, dass nur für 29 Patientinnen, also ohne Ersatz die Lebensqualität und Neutropenie nach 18 Wochen analysiert worden wäre. Aus den Abbildungen der Ergebnisse in Tröger et al. (2014)143 geht jedoch hervor, dass 32 Patientinnen der Helixor®-Gruppe ausgewertet wurden. Aus der Kontrollgruppe scheidet für die Analyse nach 18 Wochen eine Patientin aus, weil die Chemotherapie aufgrund einer Herzerkrankung abgebrochen werden musste. Eine weitere Patientin zog die Einwilligung bis zum Follow-up nach fünf Jahren zurück. Es wurden hier also 96,8 beziehungsweise 93,5 % ausgewertet.
Die Verteilung von Tumorgraden, Tumorklassifikation und Lymphknotenstatus in Interventions- und Kontrollgruppen der Studien sind in Tabelle 35 in dem Detailgrad abgebildet wie sie in der Publikation berichtet werden. Weitere Ausführungen zur TNM-Klassifikation, mit detaillierteren Beschreibungen der Abkürzungen und Stadien, sind im Hintergrundteil in Abschnitt 1.2.3 erklärt.
|
Studie, Jahr |
Alter in Jahren Mittelwert (SD) |
Tumorklassifikation Anzahl(%) |
Befallene Lymphknoten |
Tumorgrad Anzahl(%) |
|
Semiglazov (2004) |
Niedrige Dosis: 45,5 (5,3) Mittlere Dosis: 44,6 (5,7) Hohe Dosis: 45,5 (5,5) KG: 43,5 (6,1) |
n. b. |
Niedrige Dosis: N0: 28 (41,8) N+: 39 (58,2) Mittlere Dosis: N0: 26 (38,8) N+: 41 (61,2) Hohe Dosis: N0: 25 (36,8) N+: 43 (63,2) KG: N0: 32 (45,7) N+: 38 (54,3) |
Niedrige Dosis: G1: 2 (3,0) G2: 32 (47,8) G3: 19 (28,4) G4: 3 (4,5) G9: 11 (16,4) Mittlere Dosis: G1: 3 (4,5) G2: 32 (47,8) G3: 13 (19,4) G4: 5 (7,5) G9: 14 (20,9) Hohe Dosis: G1: 1 (1,5) G2: 35 (51,5) G3: 15 (22,1) G4: 4 (5,9) G9: 13 (19,1) Kontrollgr.: G1: 3 (4,3) G2: 33 (47,1) G3: 13 (18,6) G4: 5 (7,1) G9: 16 (22,9) |
|
Semiglazov |
Lektinol®: 46,4 (5,9) |
Lektinol®: |
Lektinol®: |
Lektinol®: |
|
(2006) |
G: 45,9 (6,0) |
T1: 38 (21,6) T2: 128 (72,7) T3: 10 (5,7) KG: T1: 53 (30,1) T2: 116 (65,9) T3: 7 (4,0) |
N0: 109 (61,9) N+: 67 (38,1) KG: N0: 118 (67,0) N+: 58 (33,0) |
G1: 12 (7,6) G2: 82 (52,2) G3: 47 (29,9) G4: 16 (10,2) G9: 19 (10,8) KG: G1: 10 (6,4) G2: 77 (49,4) G3: 48 (30,8) G4: 21 (13,5) G9: 20 (11,4) |
|
Tröger (2009), |
Iscador®: 48,4 (7,5) |
Iscador®: |
Iscador®: |
Iscador®: |
|
(2014)* |
Helixor® A: 50,4 (6,9) |
T1: 7 (23,3) |
N0: 10 (33,3) |
G1: 1 (3,3) |
|
KG: 50,8 (8,0) |
T2: 21 (70) |
N1: 19 (63,3) |
G2: 24 (80,0) |
|
|
T3: 1 (3,3) |
N2: 1 (3,3) |
G3: 5 (16,5) |
||
|
Tx: 1 (3,3) |
Helixor® A: |
Helixor® A: |
||
|
Helixor® A: |
N0: 16 (47,1) |
G1: 3 (8,8) |
||
|
T1: 9 (26,5) |
N1: 16 (47,1) |
G2: 28 (82,4) |
||
|
T2: 24 (70,6) |
N2: 2 (5,9) |
G3: 3 (8,8) |
||
|
T3: 1 (2,9) |
KG: |
KG.: |
||
|
Tx: 0 (0) |
N0: 16 (51,6) |
G1: 1 (3,2) |
||
|
KG: |
N1: 14 (45,2) |
G2: 24 (77,4) |
||
|
T1: 9 (29,0) |
N2: 1 (3,2) |
G3: 6 (19,4) |
||
|
T2: 19 (61,3) |
||||
|
T3: 2 (6,5) |
||||
|
Tx: 1 (3,2) |
||||
|
KG = Kontrollgruppe. Ng(ML) = Nanogramm Mistellektin. Niedrige Dosis |
10 ng(ML)/ml. |
Mittlere Dosis: 30 ng(ML)/ml. Hohe |
||
Dosis: 70 ng(ML)/ml. n. b.: Nicht beschrieben. SD = Standardabweichung.
Abkürzungen Tumorstadien: T1: Tumor bis 2 cm (bei Tröger sind Tis, T1mic und T1 zusammengefasst); T2: Tumor > 2 cm bis 5 cm; T3: Tumor > 5 cm; Tx: Primärtumor nicht beurteilbar.
Abkürzungen befallene Lymphknoten: N0: Keine Lymphknotenmetastasen; N1: Metastasen in beweglichen ipsilateralen Lymphknoten in der Achselhöhle, > 0,2 cm; N2: Metastasen an ipsilateralen Lymphknoten in der Achselhöhle, untereinander oder in andere Strukturen fixiert oder in klinisch erkennbaren ipsilateralen Lymphknoten entlang der Arteria mammaria interna; N3: Metastase(n) an ipsilateralen infraklavikulären Lymphknoten; Anmerkung: Semiglazov 2004 und 2006 berichten N1 bis N3 als „N+“; Abkürzungen Tumorgrade: G1: gut differenziert; G2: mäßig differenziert; G3: schlecht differenziert;
G4: undifferenziertes bösartiges Gewebe; G9: Differenzierungsgrad nicht beurteilbar.
*Die Werte der analysierten Patientinnen nach fünf Jahren (Tröger et al. 2012 und 2014) unterschieden sich unwesentlich und werden deshalb hier nicht präsentiert.
Bei Semiglazov et al. (2004)139 ist die Kontrollgruppe mit durchschnittlich 43,5 Jahren circa ein bis zwei Jahre jünger als die Interventionsgruppen mit 45,5, 44,6 und 45,5 Jahren. In der Studie von Semiglazov et al. (2006)140 ist das durchschnittliche Alter etwa vergleichbar mit 46,4 Jahren in der Interventions-versus 45,9 Jahren in der Kontrollgruppe. Bei Tröger141, 143 sind die drei Gruppen im Durchschnitt ähnlich alt, alle drei Gruppen liegen zwischen 48,4 und 50,8 Jahren. Insgesamt sind die Gruppen in allen drei Studien vergleichbar in Bezug auf das Alter.
Bei Semiglazov et al. (2004)139 ist die Tumorklassifikation nicht beschrieben. Bei Semiglazov et al. (2004)139 ist die Tumorklassifikation im Schnitt für die Mistelgruppe höher (d.h. schlechter) als für die Kontrollgruppe. Der Anteil an T1 liegt bei der Kontroll- bei 30,1 % versus 21,6 % in der Mistelgruppe. Bei T2 hat den höchsten Anteil die Mistelgruppe, jedoch ist der Tumor hier schon deutlich größer. In der Studie von Tröger et al.141, 143 ist die Tumorklassifikation am niedrigsten in der Helixor®-Gruppe mit circa 97 % der Patientinnen mit T1 oder T2. In der Iscador®-Gruppe liegen noch circa 93 % in diesem Bereich und bei der Kontrollgruppe circa 91 %. Dafür hat die Kontrollgruppe den höchsten Anteil an T1 mit 29 %. Der Befall von Lymphknoten ist bei Semiglazov et al. (2004)139 am höchsten in den Gruppen mit der mittleren Dosis ML (61,2 %) und der hohen Dosis ML (63,2 %). Den niedrigsten Anteil mit Metastasen befallener Lymphknoten haben die Patientinnen in der Kontrollgruppe (54,3 %). Der Unterschied zwischen der mittleren Dosis und der Kontrollgruppe ist mit 8,9 %punkten deutlich. Auch in den Gruppen der Studie von Semiglazov et al. (2006)140 ist der Anteil der befallenen Lymphknoten in der Kontrollgruppe niedriger (33,0 %) als in der Mistelgruppe (38,1 %).
Bei Tröger et al. (2009 und 2014)141, 143 unterscheiden sich die Gruppen deutlich in Bezug auf die befallenen Lymphknoten (N1 und N2) mit 66,6 % bei Iscador®, 52,9 % bei Helixor® und 48,4 % für die Kontrollgruppe.
In der Studie von Semiglazov et al. (2004)139 ist in der mittleren Dosis sowohl der Anteil der gutdifferenzierten als auch der undifferenzierten bösartigen Tumore am höchsten. Eine moderate Differenzierung liegt bei drei Gruppen bei 47,1 bis 47,8 %, nur in der Gruppe mit der hohen Dosis Mistellektin liegt der Anteil mit 51,5 % etwas höher. Der Unterschied bei den schlecht differenzierten Tumoren ist am größten, bei 18,6 bis 28,4 %.
Bezüglich des Tumorstatus sind die beiden Arme in der Studie Semiglazov et al. (2006)140 in etwa vergleichbar, jedoch zeigt sich eine Tendenz, dass in der Lektinol®-Gruppe der Anteil der Patientinnen
in der gut und moderat differenzierten Gruppe 1 bis 3 % höher ist und die Kontrollgruppe bei den schlecht differenzierten und undifferenziert bösartigen Tumoren einen um 1 bis 3 % höheren Anteil hat. In der Studie von Tröger et al.141, 143 ist der Tumor bei einer bis drei Patientinnen (3 bis 9 %) gut differenziert. Zwischen 24 und 28 Patientinnen (circa 80 % der jeweiligen Gruppe) haben die Patientinnen eine mäßig gute Differenzierung des Tumorgewebes zum umliegenden Gewebe. Der Anteil von Patientinnen aus der Helixor® A‑Gruppe ist bei G1 und G2 etwas höher als in der Iscador®-und in der Kontrollgruppe. Schlecht differenziert ist der Tumor bei 8,8 % in der Helixor® A- und 19,4 % in der Kontrollgruppe. Insgesamt ist der Tumorstatus in der Kontrollgruppe etwas schlechter als in der Iscador®-Gruppe und deutlich schlechter als in der Helixor® A‑Gruppe.
Insgesamt sind die Arme in den Studien sowie die Studien untereinander hinsichtlich des Tumorgrads vergleichbar. Es besteht jeweils die Tendenz, dass die Patientinnen in der Kontrollgruppe weiter fortgeschrittene Tumore aufweisen als die Interventionsgruppe, insbesondere bei Helixor® in Tröger et al. (2009 und 2014)143 und in der Lektinol®-Gruppe bei Semiglazov et al. (2006)140.
In diesem Abschnitt werden die Ergebnisse zu den in Tabelle 12 spezifizierten primären und sekundären Zielgrößen nacheinander berichtet in der Reihenfolge wie dort aufgeführt. Nach der Darstellung der UAW der Standardtherapie beziehungsweise Chemotherapie folgen die Ergebnisse zur Lebensqualität, unterteilt nach den Erhebungsinstrumenten in alphabetischer Reihenfolge: EORTC-LQ-C30, FACT‑G, GLQ‑8 und Spitzer-Analogskala. Im Anschluss werden die Ergebnisse zum krankheitsfreien Überleben präsentiert. Keine der eingeschlossenen Studien untersuchte das Gesamtüberleben.
Zielgröße: UAW der Standardtherapie (Fatigue, Übelkeit, Schmerzen)
Die Zielgröße „Unerwünschte Nebenwirkungen der Standardtherapie“ wird über drei Ausprägungen gemessen: „Fatigue/Müdigkeit“, „Übelkeit“ und „Schmerzen“. Alle drei Studien139–141, 143 berichten Informationen zu den Ausprägungen, aber teilweise nur als ein Item des Lebensqualitätsmessinstruments. Im Gegensatz zur Bewertung der Lebensqualität werden bei den unerwünschten Nebenwirkungen die Scores für die jeweiligen Gruppen berichtet und nicht die Gruppendifferenz. Bei Semiglazov et al. (2004)139 können für „Fatigue/Müdigkeit“ und „Übelkeit“ nur die entsprechenden Items aus dem GLQ‑8 verwendet werden und zu Schmerzen wird in der Publikation nur in Textform berichtet. Semiglazov et al. (2006)140 berichten Nebenwirkungen der Standardtherapie auch zusätzlich zum FACT‑G. Für die Items „Übelkeit“ und „Schmerzen“, bestimmt nach den Vorgaben der Kodierrichtlinie „Medical Dictionary for Regulatory Activities“ (MedDRA), wurden Häufigkeiten und prozentuale Anteile berichtet. Über MedDRA kann jedoch kein Schweregrad abgebildet werden. Tröger et al. (2009 und 2014)141, 143 berichten zwar zahlreiche unerwünschte Ereignisse, zur Bewertung der drei gesuchten Ausprägungen „Fatigue“, „Übelkeit“ und „Schmerzen“ eignen sind jedoch nur die Angaben aus dem EORTC-QLQ-C30. Tabelle 36 stellt dar, wie die Nebenwirkungen erhoben wurden.
Tabelle 36: Erhebung der unerwünschten Nebenwirkungen der Standardtherapie
|
Fatigue/Müdigkeit |
Übelkeit |
Schmerzen |
|
|
Semiglazov (2004) |
Erhoben über GLQ‑8, Frage 5 |
Erhoben über GLQ‑8, Frage 2 |
Nur in Textform berichtet |
|
Semiglazov (2006) |
Frage 1 zum physischen Wohlbefinden im FACT‑G (Energielosigkeit) |
Frage 2 zum physischen Wohlbefinden im FACT‑G und erhoben über MedDRA |
Frage 4 zum physischen Wohlbefinden im FACT‑G und erhoben über MedDRA (nur Kopfweh) |
|
Tröger (2009, 2014) |
Erhoben über das Item „Müdigkeit“ im EORTC-QLQ-C30 |
Erhoben über das Item „Übelkeit und Erbrechen“ im EORTC-QLQ-C30 |
Erhoben über das Item „Schmerzen“ im EORTC-QLQ-C30 |
EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. FACT‑G = Functional Assessment of Cancer Therapy – General. GLQ = Global Life Quality. MedDRA = Medical Dictionary for Regulatory Activities.
Für die Bewertung der unerwünschten Wirkungen der Chemotherapie ist zu beachten, dass es immer eine Überschneidung mit der subjektiv wahrgenommenen Wirkung der Mistelpräparate oder des Placebos geben kann. Patientinnen in der Placebogruppe, die zwar keine kausal durch die Misteltherapie hervorgerufenen Nebenwirkungen haben können, können dennoch subjektiv Verbesserungen oder Einschränkungen durch die Injektionen wahrnehmen, die sie dem Präparat zuordnen. Da die Zielgrößen subjektiv erhoben werden und die Patientinnen in der Kontrollgruppe grundsätzlich zumindest zu Beginn der Studie aufgrund der Gabe des augenscheinlich identischen Präparats davon ausgehen, dass sie die Misteltherapie erhalten, ist die Effektgröße zur Veränderung der sicherheitsrelevanten Zielgrößen vor diesem Hintergrund zu bewerten.
In Tabelle 37 sind die relevanten Teilergebnisse zum GLQ‑8, FACT‑G und EORTC-QLQ-C30 zusammen mit narrativ berichteten Beschwerden zusammengefasst. Die Angaben entsprechen für die Lebensqualitätsmessinstrumente dem Mittelwert der Effektgröße des Scores mit Standardabweichung und p‑Wert und bei Nebenwirkungen, die in Textform oder über den MedDRA berichtet sind, wird die Anzahl und der prozentuale Anteil der Ausprägungen an allen Patientinnen der Studie genannt.
Tabelle 37: Ergebnisse zu unerwünschten Nebenwirkungen der Standardtherapie
|
Fatigue/Müdigkeit MW (SD)/ Differenz MW/p‑Wert |
Übelkeit MW (SD)/Differenz MW/p‑Wert |
Schmerzen MW (SD)/Differenz MW/p‑Wert |
Follow-up- Dauer |
|
|
Semiglazov (2004) |
GLQ‑8, Frage 5: ND: ‑2,1 mm (22,0) Differenz zur KG: 1,5 mm/n. b. MD: ‑13,3 mm (27,2) Differenz zur KG: ‑9,7 mm/p < 0,05; HD: ‑9,3 mm (23,7) Differenz zur KG: ‑5,7 mm/n. b. KG: -3,6 mm (24,8)/n. b. |
GLQ‑8, Frage 2: ND: +8,8 mm (27,4) Differenz zur KG: ‑0,3 mm/n. b. MD: +0,3 mm (27,0) Differenz zur KG: ‑8,8 mm/p < 0,01; HD: +7,0 mm (29,6) Differenz zur KG: -1,1 mm/n. b.; KG:+9,1 mm (23,7) |
Bei 2 (0,75 %) (Gruppenzuteilung n. b.): Muskelschmerzen und Kopfschmerzen; unklar ob aufgrund Mistel- oder Chemotherapie |
15 Wochen |
|
Semiglazov (2006) |
Frage 1 FACT‑G: Lektinol®: +0,47 (1,21); KG:-0,53 (1,08)/Differenz: +1,0 (n. b.)/ p < 0,0001 |
Frage 2 im FACT‑G: Lektinol®: ‑0,17 (1,16); KG: ‑0,64 (1,13) Differenz: +0,47 (n. b.)/ p = 0,0002 MedDRA (Übelkeit)* Anzahl (%): Lektinol®: 17 (9,7); KG: 17 (9,7) Differenz: 0 (n. b.)/p = 1,0000 |
Frage 4 FACT‑G: Lektinol®: +0,07 (0,80); KG: ‑0,02 (0,81)/Differenz: +0,09 (n. b.)/ p = 0,2676 MedDRA (Kopfschmerzen)* Anzahl (%): Lektinol®: 14 (8); KG: 10 (5,7) Differenz: 4/p = 0,3976 |
14 bis 24 Wochen während + acht Wochen nach Ende der _ Chemotherapie |
|
Tröger (2009, 2014) |
EORTC-QLQ-C30: Iscador®: +0,93 (n. b.) KG: +5,84 (n. b.) Differenz: ‑4,91 (-8,78; ‑1,05)/p = 0,009 |
EORTC-QLQ-C30: Iscador®: +7,02 (n. b.) KG: + 14,6 (n. b.) Differenz: ‑7,58 (-12,25; ‑2,91)/p = 0,001 |
EORTC-QLQ-C30: Iscador®: ‑9,81 (n. b.) KG: + 2,66 (n. b.) Differenz: ‑12,47 (-16,85; ‑8,08)/p < 0,001 |
18 Wochen |
|
Helixor® A: 3,67 (15) KG: 5 (10,5) Differenz: ‑1,33 (n. b.)/p- Wert n. s. |
Helixor® A: +7,23 (17,1) KG: +13 (15) / Differenz: ‑5,77 (n. b.)/p < 0,001 |
Helixor® A: ‑8,15 (17) KG: 2,66 (14,5) /Differenz: -10,81 (n. b.)/p < 0,001 |
* Die p‑Werte zum MedDRA wurden über einen Chi2-Test berechnet.
Effektgr. = Effektgröße. EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. FACT‑G = Functional Assessment of Cancer Therapy – General. GlQ = Global Life Quality. KG = Kontrollgruppe. MedDRA = Medical Dictionary for Regulatory Activities. MW = Mittelwert. n. b. = Nicht beschrieben. n. s. = Nicht signifikant (als Ersatz für einen p‑Wert, wenn dieser nicht genau berichtet ist). SD = Standardabweichung. ND = Niedrige Dosis: 10 ng(ML)/ml; MD = Mittlere Dosis: 30 ng(ML)/ml; HD = Hohe Dosis: (70 ng(ML)/ml); zum Vergleich: Dosis Semiglazov 2006: 30 ng(ML)/ml.
Drei Studien139–141, 143 mit 687 Patientinnen berichten Ergebnisse zur Fatigue/Müdigkeit. Bei Semiglazov et al. (2004)139 wurden die Ergebnisse im GLQ‑8 über das Item 5 „Müdigkeit“ erhoben. Die Ausprägung des Effekts ist die Veränderung des Werts von der Anfangsmessung zum Durchschnittswert der beiden Messungen in Woche 15 in Millimetern, getrennt nach Studienarm. Die zugrundeliegende Skala geht von null bis 100 mm, wobei die Abnahme des Werts eine Verbesserung bedeutet. In der Kontrollgruppe, die ausschließlich die Chemotherapie erhielt, lag die Veränderung bei ‑3,6 mm (SD: 24,8/p‑Wert n. b.; SD = Standardabweichung). Die Gruppe mit der niedrigen Dosis verbessert sich um ‑2,1 mm (SD: 22,0)/p‑Wert n. b.). Die Gruppe mit der mittleren Dosis Mistellektin erreicht die größte Verbesserung mit ‑13,3 mm (SD: 27,2/p < 0,05). Am zweithöchsten ist die Verbesserung in der Gruppe mit der hohen Dosis mit ‑9,3 mm (SD: 23,7/p‑Wert n. b.). Die Effektgröße, die Gruppendifferenz zwischen den Änderungen der Millimeterwerte einer Gruppe mit Misteltherapie und der Kontrollgruppe, beträgt für die niedrige Dosis 1,5 mm (p‑Wert n. b.), für die mittlere Dosis ‑9,7 mm (p < 0,05) und für die hohe Dosis ‑5,7 mm (p‑Wert n. b.).
Bei Semiglazov et al. (2006)140 ist die Müdigkeit während der Chemotherapie über die Frage 1 zum physischen Wohlbefinden des FACT‑G „I have a lack of energy“ beantwortet. Bezugszeitraum sind jeweils die vergangenen sieben Tage. Jede Patientin hat die Frage mit einer Punktzahl von null (schlechtestes Ergebnis) bis vier (bestes Ergebnis) beantwortet. Zielgröße ist die durchschnittliche Veränderung für das einzelne Item zwischen Anfangsmessung und dem Wert aus Woche 15, getrennt nach Studienarmen. Der Durchschnittswert je Gruppe hat sich in der Lektinol®-Gruppe um +0,47 (SD: 1,21) Punkte verbessert und in der Kontrollgruppe um ‑0,53 (SD: 1,08) Punkte verschlechtert. Die Gruppendifferenz liegt bei einem Punkt mit einem p‑Wert von p < 0,0001.
Für Tröger et al. (2009 und 2014)141, 143 ist die Effektgröße die Differenz der durchschnittlichen Veränderung des Werts von der Anfangsmessung verglichen mit den sechs Folgemessungen für das Item „Müdigkeit“ des EORTC-QLQ-C30. Eine Verringerung der Punktzahl entspricht einer Verbesserung, die ab fünf Punkten auch klinisch relevant ist. Für den Vergleich von Iscador® mit der Kontrollgruppe beträgt die Differenz für die Iscador®- +0,93 (SD n. b.) und für die Kontrollgruppe +5,84 (SD n. b.). Daraus ergibt sich als Effektgröße ein Unterschied von ‑4,91 (95%-KI: (-8,78; ‑1,05)/p = 0,009) zugunsten der Iscador®-Gruppe.
Für den Vergleich von Helixor® A zur Kontrollgruppe lag der Wert für Helixor® A bei +3,67 (SD 15) Punkten und für die Kontrollgruppe bei +5 (SD 10,5) Punkten. Daraus ergibt sich eine Differenz zugunsten der Helixor® A von ‑1,33 (95 %-KI: n. b./p‑Wert nicht signifikant) Punkten. Zur Übelkeit als UAW berichten auch drei Studien139–141, 143 mit 687 Patientinnen. Alle Patientinnen erhalten bereits eine antiemetische Therapie, die im Studienprotokoll für alle Gruppen vorgesehen ist. Die Wirkstoffe und Dosierungen der antiemetischen Therapie sind in Tabelle 29 beschrieben.
Bei Semiglazov et al. (2004)139 sind Ergebnisse zur Übelkeit in Frage zwei des GLQ‑8 erhoben „Feeling sick (nausea or vomiting)“. Die Interpretation des GLQ-8-Werts entspricht der Beschreibung zur Müdigkeit. In der Kontrollgruppe verschlechtert sich die Wahrnehmung der Übelkeit in der Kontrollgruppe mit +9.1 (23,7) am meisten, dicht gefolgt von der Gruppe mit der niedrigen Dosis +8,8 (SD: 27,4/p‑Wert n. b.). und der hohen Dosis +7,0 (SD: 29,6/p‑Wert n. b.). Die einzige Gruppe, in der sich die wahrgenommene Übelkeit kaum erhöht, ist die Gruppe mit der mittleren Dosis +0,3 (SD: 27,0/p‑Wert n. b.). Für die Effektgröße ergeben sich daraus für die niedrige Dosis ‑0,3 mm (p‑Wert n. b.), für die mittlere ‑8,8 mm (p < 0,01) und für die hohe ‑1,1 mm (p‑Wert n. b.).
Semiglazov et al. (2006)140 erheben die Stärke der wahrgenommenen Übelkeit über die zweite Frage in der Kategorie physisches Wohlbefinden „I have nausea“. In der Lektinol®-Gruppe verschlechterte sich der Wert von der Ausgangsmessung bis zur Messung in Woche 15 leicht, um ‑0,17 (SD: 1,16) Punkte. Die wahrgenommene Übelkeit verschlechterte sich bei der Kontrollgruppe etwas stärker, mit ‑0,64 (SD: 1,13) Punkten (Spannweite: 0 bis 4). Der Unterschied zwischen den beiden Gruppen liegt bei +0,43 Punkten mit p = 0,0002. Die Nebenwirkungen, die laut MedDRA zur Übelkeit gehören, hatten sowohl 17 (SD: 9,7) Patientinnen aus der Lektinol®- als auch 17 aus der Kontrollgruppe (p = 1,0000).
In der Studie von Tröger et al. (2009 und 2014)141, 143 ist die Effektgröße die Differenz der durchschnittlichen Veränderung des Werts von der Anfangsmessung verglichen mit den sechs Folgemessungen für das Item „Übelkeit und Erbrechen“ des EORTC-QLQ-C30. Für den Vergleich von Iscador® mit der Kontrollgruppe beträgt die Differenz für die Iscador®- +7,02 (SD n. b.) und für die Kontrollgruppe +14,6 (SD: n. b.). Daraus ergibt sich als Effektgröße ein Unterschied von zugunsten der Iscador®-Gruppe von ‑7,58 (-12,25; ‑2,91)/p = 0,001.
Für den Vergleich von Helixor® A zur Kontrollgruppe lag der Wert für Helixor® A bei +7,23 (SD 17,1) Punkten und für die Kontrollgruppe bei +13 (SD: 15) Punkten. Daraus ergibt sich eine Differenz zugunsten der Helixor® A von ‑5,77 (95 %-KI: n. b./p < 0,001) Punkten.
Drei Studien139–141, 143 mit 687 Patientinnen berichten Ergebnisse zu Schmerzen, die bei zwei Studien139, 140 nach Anzahl der Nennungen berichtet ist, und in zwei Studien sind Schmerzen über den Lebensqualitätsfragebogen erhoben140, 143, 281. Semiglazov et al. (2004)139 berichten nur für zwei Patientinnen (0,75 %) Schmerzen als unerwünschte Nebenwirkungen der Standardtherapie, deren Gruppenzugehörigkeit unklar ist, eine Patientin mit Muskel- und eine Patientin mit Kopfschmerzen. Es ist unklar, ob die Schmerzen auf die Misteltherapie zurückzuführen sein könnten.
Semiglazov et al. (2006)140 erhoben die Stärke der wahrgenommenen Schmerzen über Frage 4 in der Kategorie physisches Wohlbefinden „I have pain“ und zählten die Anzahl der Patientinnen, die an Kopfschmerzen litten, definiert nach MedDRA. In der Lektinol®-Gruppe verbesserten sich die wahrgenommenen Schmerzen bei einer Spannweite von null bis vier um +0,07 (SD: 0,80) Punkte. In der Kontrollgruppe verschlechterte sich der Punktwert leicht um ‑0,02 (SD: 0,81) Punkte. Die Gruppendifferenz für die Frage zu den Schmerzen liegt bei +0,9 Punkten mit einem p‑Wert von p = 0,2676. Kopfschmerzen hatten 14 (8 %) Patientinnen aus der Lektinol®- und zehn (5,7 %) Patientinnen aus der Kontrollgruppe (p = 0,3976).
In der Studie von Tröger et al. (2009 und 2014)141, 143 ist die Effektgröße die Differenz der durchschnittlichen Veränderung des Werts von der Anfangsmessung verglichen mit den sechs Folgemessungen für das Item „Schmerzen“ des EORTC-QLQ-C30. Für den Vergleich von Iscador® mit der Kontrollgruppe beträgt die Differenz für die Iscador®-Gruppe ‑9,81 (SD: n. b.) und für die Kontrollgruppe +2,66 (SD: n. b.). Daraus ergibt sich als Effektgröße ein Unterschied von ‑12,47 (95%-KI: (-16,85; ‑8,08)/p < 0,001) zugunsten der Iscador®-Gruppe.
Für den Vergleich von Helixor® A zur Kontrollgruppe lag der Wert für Helixor® A bei ‑8,15 (SD: 17) Punkten und für die Kontrollgruppe bei +2,66 (SD: 14,5) Punkten. Daraus ergibt sich eine Differenz zugunsten der Helixor® A von ‑10,81 (95 %-KI: n. b./p < 0,001) Punkten. Die Differenz ist klinisch relevant mittleren Ausmaßes.
Zielgröße: HRQOL- EORTC-QLQ-C30-Skala
Eine Studie (von Tröger et al.141, 143) mit 89 Patientinnen berichtet Ergebnisse zur Lebensqualitätsskala QLQ-C30 des EORTC. Die Effektgröße ist die Veränderung der Lebensqualität, gemessen mit der EORTC-QLQ-C30-Skala über einen Zeitraum von 18 Wochen. Die erste Erhebung fand kurz vor dem ersten Zyklus der Chemotherapie statt. Vor dem Start eines neuen Zyklus (zu Beginn des zweiten bis sechsten Zyklus) fand eine weitere Erhebung statt. Die siebte und letzte Erhebung wurde drei Wochen nach der letzten Chemotherapie durchgeführt. Die beiden Publikationen von Tröger et al. berichten die Veränderung zwischen dem Anfangs- und dem Mittelwert der sechs Befragungen (der zweiten bis siebten Erhebung) während beziehungsweise nach der Chemotherapie, sowohl für den Helixor® A‑Arm als auch für den Iscador®-Arm jeweils verglichen mit der Kontrollgruppe. Der Minimalwert für den EORTC-Score ist null und der Maximalwert 100. Die Ergebnisse sind für die einzelnen Items der fünf Funktionsskalen (körperliche Funktion, Rollenfunktion, kognitive Funktion, emotionale Funktion und soziale Funktion), die Gesamtlebensqualität, und neun Symptomskalen (Müdigkeit, Übelkeit und Erbrechen, Schmerzen, Kurzatmigkeit, Schlaflosigkeit, Appetitlosigkeit, Verstopfung, Durchfall und Finanzielle Sorgen) getrennt berichtet. Die 15 Ausprägungen des EORTC-QLQ-C30 in Tabelle 38 werden wie folgt interpretiert: für die Gesamtlebensqualität und die fünf Funktionsskalen bedeuten höhere Werte ein besseres Ergebnis; bei den neun Symptomskalen niedrigere Werte. Als klinischrelevanter Unterschied zwischen den Gruppen werden laut den Autoren143, die sich auf Osoba et al. (2005)282 berufen, folgende Einteilungen verwendet: fünf bis zehn Punkte bei einem kleinen Unterschied, elf bis 20 für einen mittleren Unterschied und über 20 Punkte für einen Unterschied mit großer klinischer Relevanz. Diese Einschätzung zu Werten für einen klinisch relevanten Unterschied ab fünf Punkten beschreiben auch King et al. (1996)272 und Osoba et al. (1998)273.
In Tabelle 38 sind die durchschnittlichen Änderungen der Mittelwerte zwischen Anfangsmessung und dem Durchschnitt aus der zweiten bis siebten Messung (d. h. der Durchschnitt aus sechs Messungen während der Chemotherapie) beschrieben, soweit diese in den Publikationen berichtet sind. Für Helixor® A und die zugehörige Kontrollgruppe bei Tröger (2014)143 wurden die Ergebnisse in der Publikation in Form von Boxplots dargestellt und der Zahlenwert für die jeweiligen Gruppenwerte konnte nur ungefähr abgelesen werden, die Differenz zwischen den Gruppen, war jedoch in Zahlenwerten zusätzlich angegeben. Da sich sowohl die Iscador®- als auch die Helixor® A‑Gruppe auf dieselbe Kontrollgruppe beziehen, werden die Zahlenwerte für die Mittelwertänderung der Kontrollgruppe aus der Publikation zu Iscador®141 übernommen. Mithilfe der berichteten Werte zur Gruppendifferenz, zwischen dem Durchschnitt der Mittelwerte der sechs Erhebungen in der Helixor® A- im Vergleich zur Kontrollgruppe, wurden die Werte für die Änderung des Mittelwerts in der Helixor® A‑Gruppe von den Autoren des HTA-Berichts berechnet. Die SD für die Änderungen der Mittelwerte und deren KI sind nicht angegeben. Überraschend ist die Inkonsistenz der Zahlenangaben zu den Teilnehmerinnen. Obwohl die Kontrollgruppe dieselbe ist für beide Interventionsarme, unterscheidet sich in den Publikationen die Anzahl ausgewerteter Fälle je Item. Die p‑Werte für die Effektgrößen zu Iscador® sind mit dem Mann-Whitney U‑Test berechnet, die p‑Werte für die Helixor® A‑Gruppe mit dem Dunnett-Test.
Tabelle 38: Ergebnisse zur gesundheitsbezogenen Lebensqualität gemessen mit EORTC-QLQ-C30
Zielgröße Zeit Interventionsgruppe Kontrollgruppe Effektgröße
|
MW Änderung1 |
SD |
N |
MW Änderung1 |
SD |
N |
Gruppendifferenz (95 %-KI)/p‑Wert |
|
|
Tröger (2009) – Iscador® gegenüber Kontrollgruppe |
|||||||
|
Gesamtlebensqualität |
18 Wo 2,77 |
n. b. |
30 |
-0,15 |
n. b. |
31 |
2,92 (-2,15; 7,98)/0,393 |
|
Körperliche Funktion |
18 Wo ‑0,52 |
n. b. |
30 |
-4,08 |
n. b. |
31 |
3,56 (0,61; 6,51)/ 0,014 |
|
Rollenfunktion |
18 Wo 12,88 |
n. b. |
30 |
-1,21 |
n. b. |
31 |
14,09 (9,02; 19,16)/< 0,001 |
|
Emotionale Funktion |
18 Wo 3,73 |
n. b. |
30 |
-2,62 |
n. b. |
31 |
6,35 (2,15; 10,54)/0,001 |
|
Kognitive Funktion |
18 Wo 1,81 |
n. b. |
30 |
-2,28 |
n. b. |
31 |
4,09 (-0,33; 8,53)/0,076 |
|
Soziale Funktion |
18 Wo 2,08 |
n. b. |
30 |
-5,66 |
n. b. |
31 |
7,74 (3,37; 12,12)/< 0,001 |
|
Müdigkeit |
18 Wo 0,93 |
n. b. |
30 |
5,84 |
n. b. |
31 |
-4,91 (-8,78; ‑1,05)/0,009 |
|
Übelkeit und Erbrechen |
18 Wo 7,02 |
n. b. |
30 |
14,6 |
n. b. |
31 |
-7,58 (-12,25; ‑2,91)/0,001 |
|
Schmerzen |
18 Wo ‑9,81 |
n. b. |
30 |
2,66 |
n. b. |
31 |
-12,47 (-16,85; ‑8,08)/< 0,001 |
|
Kurzatmigkeit |
18 Wo ‑2,32 |
n. b. |
30 |
1,38 |
n. b. |
31 |
-3,7 (-6,79; ‑0,60)/0,015 |
|
Schlaflosigkeit |
18 Wo ‑2,53 |
n. b. |
30 |
5,72 |
n. b. |
31 |
-8,25 (-13,42; ‑3,09)/0,001 |
|
Appetitlosigkeit |
18 Wo ‑1,35 |
n. b. |
30 |
5,3 |
n. b. |
31 |
-6,64 (-12,28; ‑1,01)/0,017 |
|
Verstopfung |
18 Wo 7,21 |
n. b. |
30 |
8,33 |
n. b. |
31 |
-1,12 (-6,53; 4,29)/1 |
|
Durchfall |
18 Wo 0,16 |
n. b. |
30 |
6,27 |
n. b. |
31 |
-6,11 (-9,47; ‑2,75)/< 0,001 |
|
Finanzielle Sorgen |
18 Wo 2,1 |
n. b. |
30 |
11,04 |
n. b. |
31 |
-8,94 (-14,21; ‑3,67)/ < 0,001 |
Tröger (2014) – Helixor® A gegenüber Kontrollgruppe (Werte geschätzt aus Boxplots)
|
Gesamtlebensqualität |
18 Wo |
0,1 |
16 |
31 |
-1,2 |
17 |
28 |
1,3 (n. b.)/n. s. |
|
Körperliche Funktion |
18 Wo |
-3 |
10 |
32 |
-4 |
11,5 |
29 |
1,0 (n. b.)/n. s. |
|
Rollenfunktion |
18 Wo |
8,5 |
20 |
32 |
-2 |
16,5 |
29 |
10,5 (n. b.)/< 0,001 |
|
Emotionale Funktion |
18 Wo |
4,8 |
12 |
32 |
-2,1 |
n. b. |
29 |
6,9 (n. b.)/< 0,001 |
|
Kognitive Funktion |
18 Wo |
3,3 |
13,5 |
32 |
-1,5 |
20 |
29 |
4,8 (n. b.)/< 0,01 |
|
Soziale Funktion |
18 Wo |
-0,1 |
14 |
32 |
-6,3 |
n. b. |
29 |
6,2 (n. b.)/< 0,05 |
|
Müdigkeit |
18 Wo |
3,67 |
15 |
32 |
5 |
10,5 |
29 |
-1,33 (n. b.)/n. s. |
|
Übelkeit und Erbrechen |
18 Wo |
7,23 |
17,1 |
32 |
13 |
15 |
29 |
-5,77 (n. b.)/< 0,001 |
|
Schmerzen |
18 Wo |
-8,15 |
17 |
32 |
2,66 |
14,5 |
29 |
-10,81 (n. b.)/< 0,001 |
|
Kurzatmigkeit |
18 Wo |
0,56 |
11 |
32 |
1 |
10 |
29 |
-0,44 (n. b.)/n. s. |
|
Schlaflosigkeit |
18 Wo |
0,39 |
17,5 |
32 |
6,4 |
17 |
29 |
-6,01 (n. b.)/< 0,05 |
|
Appetitlosigkeit |
18 Wo |
-3 |
11,1 |
32 |
5,3 |
17 |
29 |
-8,3 (n. b.)/< 0,001 |
|
Verstopfung |
18 Wo |
2,97 |
18 |
32 |
7 |
19 |
29 |
-4,03 (n. b.)/< 0,05 |
|
Durchfall |
18 Wo |
-0,5 |
7,2 |
32 |
6,55 |
14,2 |
29 |
-7,05 (n. b.)/< 0,001 |
|
Finanzielle Sorgen |
18 Wo |
13,29 |
19 |
32 |
11 |
18 |
29 |
2,29 (n. b.)/n. s. |
EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. KI = Konfidenzintervall. MW = Mittelwert. N = Anzahl Patientinnen. n. b. = Nicht beschrieben. n. s. = Nicht signifikant. SD = Standardabweichung. Wo = Wochen. ND: Niedrige Dosis (10 ng(ML)/ml). MD: Mittlere Dosis: 30 ng(ML)/ml. HD: Hohe Dosis (70 ng(ML)/ml); zum Vergleich: Dosis Semiglazov (2006): 30 ng(ML)/ml.
*Änderung des MW von der Baseline-Untersuchung zum MW der sechs Follow-up-Untersuchungen. Wenn kein Vorzeichen, dann ist die Änderung positiv.
**Die Angaben zu den Zielgrößen werden für die Helixor-Gruppe aus der Darstellung in Tröger et al. (2014) aus Boxplots abgelesen. Für den Vergleich von Helixor® A mit der Kontrollgruppe sind die p‑Werte (berechnet über den post-hoc-Dunnett-Test) nur in Kategorien berichtet: p < 0,001; p < 0,01; p < 0,05.
Der Gesamt-Score für die Lebensqualität nach 18 Wochen (sechs Zyklen) verbessert sich bei der Iscador®- im Vergleich zur Kontrollgruppe um 2,92 (95 %-KI: (-2,15; 7,98)/p = 0,393) Punkte. Bei der Helixor® A‑Gruppe verbessert sich der Gesamt-Score im Vergleich zur Kontrollgruppe um 1,3 (95 %-KI: n. b./n. s.).
Bezogen auf die einzelnen Items getrennt nach Gruppe verschlechterte sich die Lebensqualität in der Kontrollgruppe in allen 15 Items. Bei den Gruppen mit Misteltherapie verschlechterte sich bei den Funktionsskalen jeweils nur das Item „körperliche Funktion“ mit ‑0,52 (SD: n. b.) in der Iscador®-und ‑3 (SD: n. b.) in der Helixor® A‑Gruppe. Alle anderen Items verbesserten sich.
Die Veränderung der Effektgrößen, die sich aus dem Gruppenvergleich der durchschnittlichen Veränderungen von Anfangsmessung und dem Mittelwert der sechs Folgeerhebungen ergeben, werden unterschieden zwischen Ergebnissen mit einem klinisch relevanten Effekt mittleren Ausmaßes (Schwellenwert: zehn Punkte), Ergebnisse mit einem klinisch relevanten Effekt geringen Ausmaßes (Schwellenwert: fünf Punkte), und keinem klinisch relevanten Effekt (Schwellenwert: unter fünf Punkten). Eine Verbesserung mit mittlerer klinischer Relevanz liegt für beide Mistelpräparate in den Unterskalen „Rollenfunktion“ und „Schmerzen“ vor. Die Werte für die Gruppenunterschiede zwischen Iscador®- und der Kontrollgruppe sind für die Rollenfunktion +14,09 (95 %-KI: (9,02; 19,16)/p < 0,001) Punkte und für die Skala „Schmerzen“ ‑12,47 (95 %-KI: (-16,85; ‑8,08)/p < 0,001) Punkte. Die Helixor® A‑Gruppe erreicht im Durchschnitt für die „Rollenfunktion“ 10,5 (95 %-KI: n. b./p < 0,001) Punkte mehr als die Kontrollgruppe und die Werte in der Skala für Schmerzen nehmen um ‑10,81 (95 %-KI: n. b./p < 0,001) Punkte ab. Die Ergebnisse zu den beiden Mistelextrakten sind insgesamt vergleichbar.
Für die Iscador®-Gruppe zeigten zwölf der Unterskalen einen statistisch signifikanten Unterschied, davon neun klinisch relevant geringen Ausmaßes, was einer Änderung zwischen fünf und zehn Punkten entspricht. Eine klinisch relevante Verbesserung geringen Ausmaßes zeigt sich bei den Symptomskalen
für die fünf Unterskalen „Übelkeit und Erbrechen“ um ‑7,58 (95 %-KI: (-12,25; ‑2,91)/p = 0,001) Punkte, „Schlaflosigkeit“ ‑8,25 (95 %-KI: (-13,42; ‑3,09)/p = 0,001) Punkte, „Appetitlosigkeit“ ‑6,64 (95 %-KI: (-12,28; ‑1,01) /p = 0,017) Punkte, „Durchfall“ ‑6,11 (95 %-KI: (-9,47; ‑2,75) p < 0,001) Punkte und „Finanzielle Sorgen ‑8,94 (95 %-KI: (-14,21; ‑3,67)/p < 0,001) Punkte.
Für die Helixor® A‑Gruppe zeigten zehn der Unterskalen einen statistisch signifikanten Unterschied, acht davon sind in geringem Ausmaß klinisch relevant. Die vier Symptomskalen mit klinisch relevantem Unterschied kleinen Ausmaßes sind: Übelkeit und Erbrechen“ ‑5,77 (95 %-KI: n. b./p < 0,001), „Schlaflosigkeit“ ‑6,01 (95 %-KI: n. b./p < 0.05) Punkte, „Appetitlosigkeit“ ‑8,3 (95 %-KI: n. b./p < 0,001) Punkte und „Durchfall“ ‑7,05 (95 %-KI: n. b./p < 0,001) Punkte.
Einen klinisch relevanten Unterschied geringen Ausmaßes ergeben bei den Funktionsskalen die Unterskalen „emotionale Funktion“, mit +6,35 (95 %-KI: (2,15; 10,54)/0,001) Punkten bei Iscador® und +6,9 (n. b.)/p < 0,001) Punkten bei Helixor® A, als auch die „soziale Funktion“, mit +7,74 (95 %-KI: (3,37; 12,12) p < 0,001) Punkten bei Iscador® und +6,2 (95 %-KI: (n. b.)/p < 0.05) Punkten bei Helixor® A.
Für die Helixor® A‑Gruppe zeigt der post hoc Dunnett-Signifikanztest eine statistisch signifikante Verbesserung der Kategorien Rollenfunktion, Emotionale Funktion, Kognitive Funktion, Soziale Funktion, Übelkeit und Erbrechen, Schmerzen, Schlaflosigkeit, Appetitlosigkeit, Verstopfung und Durchfall gegenüber der Kontrollgruppe. Für die Iscador®-Gruppe schneiden die Mistelgruppen in allen Skalen bis auf die Unterskala „finanzielle Sorgen“ besser ab als die Kontrollgruppe. Die Unterschiede für die Gesamtlebensqualität, die kognitive Funktion und das Symptom „Verstopfung“ sind nicht statistisch signifikant.
In der Publikation von Semiglazov et al. (2004)139 wird der Fragebogen auch als sekundäre Zielgröße genannt, jedoch sind weder Effektgrößen noch KI zum Ergebnis berichtet. Es ist nur im Text erwähnt, dass für die Lebensqualitätsskala QLQ-C30 keine relevanten Unterschiede beobachtet werden. Daher bezieht sich Tabelle 38 nur auf die Ergebnisse von Tröger et al. (2009 und 2014)141, 143 mit 95 Teilnehmerinnen.
Zielgröße: HRQOL- FACT‑G
Nur eine Studie, Semiglazov et al. 2006140 (337 Teilnehmer), berichtet Ergebnisse zum FACT‑G Score (Functional Assessment of Cancer Therapy-General) beziehungsweise zu den drei Subskalen: körperliches Wohlbefinden (sieben Items mit fünf Ausprägungen: 0, 1, 2, 3 oder 4), emotionales Wohlbefinden (sechs Items) und funktionelles Wohlbefinden (sieben Items). Die Subskala „Verhältnis zu Freunden, Bekannten und Familie“ mit sechs Items wird nicht in die Datenerhebung einbezogen. Die Subskalen können zwischen 0 und 24 Punkten beim emotionalen Wohlbefinden und zwischen 0 und 28 beim körperlichen und funktionellen Wohlbefinden variieren, wobei 0 immer das schlechteste Ergebnis darstellt und 24 beziehungsweise 28 das beste Ergebnis. Der Gesamt-Score kann maximal 80 Punkte erreichen. Ein minimaler klinisch wichtiger Unterschied (MCID minimal clinically important difference), wird nicht angegeben. Die Punktwerte der einzelnen Items der validierten FACT-G-Skala werden je Subskala des Fragebogens zu einem Wert aufsummiert. Effektgröße ist der Gruppenunterschied für die Differenz zwischen der Baseline-Messung und dem Durchschnittswert aus den beiden Messungen zu Beginn und am Ende der 15. Woche – eine Erhebung zwei Wochen nach der vierten Dosis der Chemotherapie (15. Tag des vierten Zyklus) und die zweite Erhebung drei Wochen nach der vierten Dosis (21. Tag des vierten Zyklus). Der Zeitpunkt ist unabhängig davon ob die Patientin vier oder sechs Zyklen der Chemotherapie erhalten hat. In Tabelle 39 werden sowohl die Ergebnisse der nichtadjustierten Gruppenunterschiede (oben in der Tabelle) als auch die Ergebnisse der adjustierten Gruppenunterschiede (unten in der Tabelle) berichtet.
Tabelle 39: Ergebnisse zur HRQOL gemessen mit FACT‑G
|
Zielgröße |
Zeit |
Interventionsgruppe |
Kontrollgruppe |
Effektgröße |
||||
|
MW (Änderung) |
SD |
N |
MW (Änderung) |
SD |
N |
Gruppendifferenz (95 %-KI)p‑Wert (nach U‑Test) |
||
|
Nicht-adjustiert für Gruppenunterschiede |
||||||||
|
FACT‑G Gesamt |
15 Wo |
4,40 |
11,28 |
169 |
-5,11 |
11,77 |
168 |
+9,51 (n. b.)/<0,0001 |
|
Körperliches Wohlbefinden |
15 Wo |
2,03 |
5,07 |
169 |
-2,33 |
5,10 |
168 |
+4,36 (n. b.)/<0,0001 |
|
Emotionales Wohlbefinden |
15 Wo |
1,43 |
4,11 |
169 |
-1,17 |
4,36 |
168 |
+2,60 (n. b.)/<0,0001 |
|
Funktionelles Wohlbefinden |
15 Wo |
0,94 |
4,15 |
169 |
-1,61 |
4,66 |
168 |
+2,55 (n. b.)/<0,0001 |
|
Adjustiert für Gruppenunterschiede* |
||||||||
|
FACT‑G Gesamt |
15 Wo |
+3,4 |
n. b. |
169 |
-0,6 |
n. b. |
168 |
+4 (n. b.)/<0,0001 |
|
Körperliches Wohlbefinden |
15 Wo |
+ 1,7 |
n. b. |
169 |
+0,1 |
n. b. |
168 |
+ 1,5 (n. b.)/<0,001 |
|
Emotionales Wohlbefinden |
15 Wo |
+0,7 |
n. b. |
169 |
-0,3 |
n. b. |
168 |
+ 1 (n. b.)/<0,01 |
|
Funktionelles Wohlbefinden |
15 Wo |
+0,7 |
n. b. |
169 |
-0,7 |
n. b. |
168 |
+ 1,5 (n. b.)/<0,001 |
*Diese Angaben wurden aus Boxplot-Diagrammen abgelesen und können daher Ungenauigkeiten beinhalten. Die Standardfehler der MW betragen für alle MW-Änderungen circa zwischen 0,25 und 0,5 Punkte, können aber nicht genau abgelesen werden.
FACT‑G = Functional Assessment of Cancer Therapy – General. KI = Konfidenzintervall. MW = Mittelwert. N = Anzahl Patientinnen. SD = Standardabweichung. Wo = Woche.
Wie in Tabelle 39 dargestellt, sind die Werte der Effektgrößen im Vergleich der Interventions-gegenüber der Kontrollgruppe nach 15 Wochen für alle Skalen besser für die Interventionsgruppe. In der nichtadjustierten Analyse ist der FACT-G-Gesamt-Summenwert um +9,51 (p < 0,0001) Punkte höher beziehungsweise besser als in der Kontrollgruppe. Auch die drei einzelnen Subskalen haben jeweils eine statistisch signifikante Gruppendifferenz zugunsten der Interventionsgruppe: körperliches +4,36 (p < 0,0001) Punkte, emotionales +2,60 (p < 0,0001) Punkte und funktionelles Wohlbefinden +2,55 (p < 0,0001) Punkte.
Aufgrund der Heterogenität der Ausgangswerte wird eine ANCOVA-Analyse mit den Ausgangswerten als Kovariate zur Adjustierung durchgeführt, die die Ergebnisse der anderen Tests bestätigt. In der adjustierten konfirmatorischen Analyse ist der FACT-G-Gesamt-Summenwert, den wir aus Abbildung 1 der Publikation abgelesen haben, um +4 (p < 0,0001) Punkte höher als in der Kontrollgruppe. Auch in der adjustierten Analyse haben die drei Subskalen jeweils eine statistisch signifikante Gruppendifferenz zugunsten der Interventionsgruppe: körperliches +1,5 (p < 0,001) Punkte, emotionales +1 (p < 0,01) Punkte und funktionelles Wohlbefinden +1,5 (p < 0,001) Punkte.
Obwohl kein MCID definiert wurde, wird angegeben, dass der Unterschied für die Lebensqualität relevant sei. Der prozentuale Anteil der jeweiligen Effektgrößen an den adjustierten Werten für die Anfangsmessungen beträgt für den FACT‑G Gesamt-Summenwert 8,0 %, für das körperliche 7,4 %, für das emotionale 6,1 % und für das funktionelle Wohlbefinden 11,4 %.
Zielgröße: HRQOL – GLQ-8-Bewertungsskala
Zwei Studien, Semiglazov et al. (2004)139 und Semiglazov et al. (2006)140, berichten für 598 Patientinnen Ergebnisse zur GLQ-8-Bewertungsskala. Die Skala misst unerwünschte Effekte der Erkrankung oder Therapie und beinhaltet acht lineare Analogskalen zu den Bereichen Angstzustände oder Depression, Unwohlsein (Übelkeit oder Schwindel), Taubheit oder Kribbeln, Haarausfall, Müdigkeit, Appetit oder Geschmackssinn, Sexualleben, und die Überzeugung, eine Behandlung zu bekommen. Die Analogskalen sind 100 Millimeter lang und ergeben einen Score zwischen 0 und 100. Je niedriger der Summen-Score ist, desto besser der Gesundheitszustand. Berichtet wird die Veränderung in Millimetern.
Tabelle 40: Ergebnisse zu unerwünschten Effekten: GLQ-8-Bewertungsskala-Gesamt-Score
|
Dosis |
Zeit |
Interventionsgruppe |
Kontrollgruppe |
Effektgröße |
||||
|
MW (Änderung) |
SD |
N |
MW (Änderung) |
SD |
N |
Gruppendifferenz (KI)/p‑Wert |
||
|
Semiglazov (2004) |
||||||||
|
Niedrig |
15 Wo |
+16,6 mm |
142,5 |
66 |
+23,5 mm |
117,3 |
66 |
-6,9 mm (n. b.)/p = 0,7063 |
|
Mittel |
15 Wo |
-37,3 mm |
122,9 |
65 |
+23,5 mm |
117,3 |
66 |
-60,8 mm (n. b.)/p = 0,007 |
|
Hoch |
15 Wo |
-9,2 mm |
132,1 |
64 |
+23,5 mm |
117,3 |
66 |
-32,7 mm (n. b.)/p = 0,4003 |
|
Semiglazov (2006) |
||||||||
|
15 Wo |
-28,9 mm |
154,6 |
169 |
+94,8 mm |
141,1 |
168 |
-123,7 mm (n. b.)/p < 0,0001 |
|
GLQ = Global Life Quality. KI = Konfidenzintervall. MW = Mittelwert. N = Anzahl Patientinnen. n. b. = Nicht beschrieben. SD = Standardabweichung. Wo = Woche.
Niedrige Dosis: 10 ng(ML)/ml; Mittlere Dosis: 30 ng(ML)/ml; Hohe Dosis: 70 ng(ML)/ml; Dosis Semiglazov 2006: 30 ng(ML)/ml.
Im Median beträgt die Gruppendifferenz in den vier Studienarmen mit Misteltherapie ‑46,7 mm (Spannweite: ‑6,9 bis ‑123,7 mm). Für die Effektgröße GLQ-8-Gesamt-Score für die Gruppendifferenz der Mittelwertänderungen über den Zeitraum von 15 Wochen während der Chemotherapie (Tabelle 40) berichten Semiglazov et al. (2004)139 Verbesserungen für alle drei Dosisgruppen. Für die niedrige Dosis beträgt der Unterschied ‑6,9 mm (95 %-KI n. b./p = 0,7063), für die mittlere ‑60,8 mm (95 %-KI n. b./p = 0,007) und für die hohe ‑32,7 mm (95 %-KI n. b./p = 0,4003). Die konfirmatorische Analyse bei Semiglazov et al. (2004)139 testet eine Dosis-Wirkungsbeziehung mit dem O‘Brien’s Rang-SummenTest. Für den GLQ‑8 ergab sich ein statistisch signifikantes Ergebnis (p = 0,0035, einseitig) für die Verbesserung der Lebensqualität von der Baseline-Messung bis zum Zeitpunkt nach 15 Wochen (entspricht vier Zyklen) für die mittlere und hohe Dosis im Vergleich zur niedrigen Dosis verglichen mit der Kontrollgruppe. Auch der O‘Brien’s Rang-Summen-Test für den Vergleich von mittlerer und hoher Dosis mit der Placebogruppe ergibt ein statistisch signifikantes Ergebnis (p = 0,0017, einseitig). Der dritte Test, in dem nur die niedrige Dosis mit der Placebogruppe verglichen wurde, lieferte kein statistisch signifikantes Ergebnis (p = 0,3532, einseitig).
Die Studie von Semiglazov et al. (2004)139 zeigt, dass die mittlere Dosis des Mistelextrakts PS76A2 (15 ng ML/0,5 ml 2 x pro Woche) die HRQOL von Patientinnen mit Brustkrebs verbessert, indem unerwünschte Effekte vermindert werden. Alle acht Skalen sowie der Gesamt-Score zeigen einen Vorteil für die „mittlere Dosis“-Gruppe. Die Ergebnisse für die einzelnen Subskalen sind der Originalpublikation zu entnehmen. In diesem HTA-Bericht ist nur der GLQ-8-Gesamt-Score für diese Gruppe berichtet mit einer Effektgröße von ‑60,8 mm (95 %-KI n. b./p = 0,007) (siehe Tabelle 40). Denn nur für den GLQ-8-Gesamt-Score sind in einer exploratorischen Analyse auch für die Baseline-Ungleichheiten adjustierte Werte in einer Abbildung der Publikation berichtet. Durch die Adjustierung reduziert sich der Unterschied zwischen Kontrollgruppe und mittlerer Dosis auf circa 30 mm (p = 0,0121).
Ein klinisch relevanter Unterschied besteht laut den Autoren sowohl für die Gruppe mit der mittleren Dosis bei Semiglazov et al. (2004)139 als auch für die Lektinol®-Gruppe bei Semiglazov et al. (2006)140. Ein MCID, wird weder von den Autoren der Publikationen genannt, noch haben die Autoren des HTA-Berichts einen MCID in der Literatur gefunden. In der Studie von Semiglazov et al. 2004 beträgt die prozentuale Verbesserung gegenüber dem GLQ-8-Ausgangswert zu Beginn der Studie von 171,5 mm (40 %) in der nicht-adjustierten Analyse, 18 % in der adjustierten Analyse. Die klinische Relevanz der Änderung erscheint somit plausibel.
In der Folgestudie von Semiglazov et al. (2006)140 ist die Differenz der Mittelwertänderung des GLQ‑8 nach 15 Wochen in der Mistelgruppe mit Lektinol® (30 ng(ML)/ml) in der konfirmatorischen Analyse statistisch signifikant um ‑123,7 mm (95 %-KI n. b./p < 0,0001) niedriger als in der Placebogruppe. Auch aufgrund der höheren Fallzahl zeigen sieben der acht Subskalen in der nicht-adjustierten Analyse einen statistisch signifikanten Unterschied zwischen 5,2 und 24,9 mm (Median: 17,6 mm). Die Ergebnisse zum GLQ‑8 nach 15 Wochen werden in einer ANCOVA-Analyse zur Adjustierung der Baseline-Werte bestätigt. Die Differenz der Mittelwertänderung reduziert sich jedoch auf circa 40 mm (p < 0,05).
Zielgröße: HRQOL – Spitzer-Index
Der Spitzer-Analogskala wird in den beiden Studien von Semiglazov et al. (2004 und 2006)139, 140, mit insgesamt 598 Teilnehmerinnen, verwendet. Die Spitzer-Analogskala besteht aus einer linearen Analogskala, die von den Patientinnen selbst ausgefüllt wird (siehe auch Tabelle 32). Ausprägungen von null bis 100 sind möglich. Null entspricht dem bestmöglichen Gesundheitszustand und somit der höchsten Lebensqualität und 100 repräsentiert den schlechtesten vorstellbaren Gesundheitszustand und somit die niedrigste Lebensqualität. In Tabelle 41 ist die Effektgröße die Veränderung der Bewertung des eigenen Gesundheitszustands auf der Analogskala zwischen der Ausgangsuntersuchung und der Befragung nach 15 Wochen. Hat die Effektgröße ein positives Vorzeichen, zeigt dies eine Überlegenheit der Gruppe mit der Misteltherapie. Diese Differenz zwischen dem Mittelwert der Anfangsmessung und der Messung nach dem vierten Chemotherapiezyklus ist in Millimetern angegeben.
Bei Semiglazov et al. (2004)139 sind trotz Randomisierung bereits bei der Anfangsmessung Unterschiede zwischen den Studienarmen zu finden.
Tabelle 41: Ergebnistabelle Spitzer-Analogskala
|
Zielgröße |
Zeit Interventionsgruppe |
Kontrollgruppe |
Effektgröße |
||||
|
MW (Änderung) |
SD |
N |
MW (Änderung) |
SD |
N |
Gruppendifferenz (KI)/ p‑Wert |
|
|
Semiglazov (2004) |
|||||||
|
Niedrig |
15 Wo ‑3,7 mm |
29,9 |
66 |
-2,6 mm |
29,1 |
66 |
+1,1 mm (n. b.)/(n. b.) |
|
Mittel |
15 Wo ‑19,0 mm |
28,9 |
65 |
-2,6 mm |
29,1 |
66 |
+16,4 mm (6,3 mm; 26,6 mm)/p = 0,0016 |
|
Hoch |
15 Wo ‑4,1 mm |
30,0 |
64 |
-2,6 mm |
29,1 |
66 |
+1,5 mm (n. b.)/(n. b.) |
|
Semiglazov (2006) |
|||||||
|
15 Wo ‑12,2 mm |
30,7 |
169 |
+10,8 mm |
26,1 |
168 |
+23 mm (n. b.)/p < 0,0001 |
|
KI = Konfidenzintervall. MW = Mittelwert. N = Anzahl Patientinnen. n. b. = nicht berichtet (fehlende p‑Werte stehen mit hoher Wahrscheinlichkeit dafür, dass die Effektgröße nicht signifikant ist). SD = Standardabweichung. Wo = Woche.
Im Median beträgt die Gruppendifferenz in den vier Studienarmen mit Misteltherapie +17,9 mm (Spannweite: +1,1 bis +23 mm). Der Unterschied zwischen den Mittelwerten der Anfangsmessung und der Messung nach dem vierten Zyklus der Chemotherapie ist bei allen vier Studienarmen in der Studie von Semiglazov et al. (2004)139 negativ, was einer Verbesserung gegenüber der Messung zu Studienbeginn entspricht. Der absolute Unterschied der Mittelwerte der Interventionsgruppen zur Kontrollgruppe beträgt für die niedrige Dosis +1,1 mm (kein KI oder p‑Wert berichtet), für die mittlere Dosis +16,4 mm (95 %-KI: (6,3 mm; 26,6 mm)/p = 0,0016) und für die hohe Dosis +1,5 mm (kein KI oder p‑Wert berichtet). Der Ausgangswert war in der mittleren Gruppe mit 46,4 mm deutlich höher als in den anderen Studienarmen, mit 35,1 mm für die Patientinnen in der Kontrollgruppe, 39,5 mm für die Patientinnen in der Gruppe mit der niedrigen Dosis und 37,9 mm in der Gruppe mit der hohen Dosis.139 In der Publikation ist beschrieben, dass auch nach einer Adjustierung für Unterschiede in der Anfangsmessung die Gruppendifferenz nach vier Zyklen mit +5,5 mm (95 %-KI: n. b./p = 0,0021) zwischen der Gruppe mit der mittleren Dosis und der Placebogruppe statistisch signifikant ist.
Bei Semiglazov et al. (2006)140 beträgt die Gruppendifferenz der Änderung der Mittelwerte nach 15 Wochen +23 mm und ist statistisch signifikant (KI: n. b.; p < 0,0001). Auch für diesen Endpunkt ist kein MCID angegeben, die Autoren beider Studien bezeichnen diese Unterschiede als klinisch relevant.
Sekundäre Zielgrößen: Gesamtüberleben und progressionsfreies Überleben
Tröger et al. (2012 und 2016)142, 144 führten nach fünf Jahren eine Analyse des krankheitsfreien Überlebens in ihrer dreiarmigen Studie141, 143 durch. Alle Patientinnen erhielten eine jährliche Nachsorgeuntersuchung. Tröger et al. (2012)142 vergleichen das krankheitsfreie Überleben von Patientinnen, die begleitend zur Standardtherapie das Mistelpräparat Iscador® erhielten, mit der Kontrollgruppe. Tröger et al. (2016)144 vergleichen das Mistelpräparat Helixor® als begleitende Therapie mit der Kontrollgruppe. Berechnet wurde jeweils das krankheitsfreie Überleben, also die Zeit, in der bei den Patientinnen weder ein Rezidiv noch Metastasen auftraten, mittels der Kaplan-Meier-Methode über einen Zeitraum von fünf Jahren seit Randomisierung. Die statistische Unsicherheit wurde mittels des Log-Rank-Tests untersucht. In der Iscador®-Gruppe traten acht Ereignisse auf. Das krankheitsfreie Überleben nach fünf Jahren beträgt 21/29, also 72,4 %. In der Kontrollgruppe traten sechs Ereignisse auf, sodass das krankheitsfreie Überleben 22/28, also 78,6 % beträgt. Der Unterschied war nicht statistisch signifikant (p = 0,551). In der Helixor®-Gruppe traten neun Ereignisse auf, das krankheitsfreie Überleben beträgt 19/28, also 67,9 %. Der Unterschied zur Kontrollgruppe war nicht statistisch signifikant (p = 0,746).
In die Informationssynthese sicherheitsrelevanter Endpunkte werden zusätzlich zu den drei bereits beschriebenen RCT von Semiglazov und Tröger139–141, 143 vier nicht-randomisierte Studien eingeschlossen129, 131, 145–149. Einige der Tabellen verweisen daher auf die Tabellen des vorherigen Abschnitts zur Bewertung der medizinischen Wirksamkeit.
Für die Beurteilung der Sicherheit der Misteltherapie werden nur UAW einbezogen, die laut der jeweiligen Publikation eindeutig oder wahrscheinlich auf die Misteltherapie zurückzuführen sind. UAW der Standardtherapie oder Symptome der Erkrankung der jeweiligen Patientin sind den Ergebnissen der medizinischen Wirksamkeit zu entnehmen (siehe Abschnitt 5.1.2.1.8.). Für die nicht-randomisierten Studien werden Ergebnisse zu UAW bei den Kontrollgruppen im Folgenden nicht berichtet. Zum besseren Verständnis des Studiendesigns werden zum Teil jedoch auch die Kontrollgruppen beschrieben.
Die vier zusätzlich für die Bewertung der Sicherheit der Misteltherapie eingeschlossenen Studien sind im Gegensatz zu den drei bereits im vorhergehenden Abschnitt beschriebenen Studien nicht verblindet und nicht-randomisiert. Von den 2.484 Teilnehmerinnen der nicht-randomisierten Studien erhalten 1.232 Patientinnen eine Misteltherapie. Mit den 719 Patientinnen aus den RCT sind 1.951 Patientinnen in die Bewertung der Sicherheit der Misteltherapie eingeschlossen.
Tabelle 42: Studiendesign der nicht-randomisierten Studien zur Bewertung der Sicherheit
|
Studie, Jahr |
Rekrutierung: Land (Anzahl Studienzentren), Zeitraum |
Studientyp |
Anzahl Teilnehmende (mit Misteltherapie) |
FU-Dauer |
|
Bock (2004a), (2004b) |
Deutschland und Schweiz (16); 1988 bis 2000 |
Retrospektive Kohortenstudie |
1.442 (710) |
Mindestens 3 Jahre oder bis Tod |
|
Eisenbraun (2011) |
Deutschland (84); März 2004 bis Juni 2006 |
Einarmige prospektive Studie |
271 (270) |
Beginn der Chemotherapie bis 4 Wochen nach Ende |
|
Loewe-Mesch (2008), von Hagens (2005) |
Deutschland (1), Mai 1999 bis August 2001 |
Nicht-randomisierte kontrollierte Interventionsstudie |
82 (33) |
Beginn der Chemotherapie bis 2 Wochen nach Ende |
|
Schumacher (2002), (2003) |
Deutschland (27), 1988 bis 1997 |
Retrospektive Kohortenstudie |
689 (219) |
284,5 Tage (MW tatsächlicher FU) |
FU = Follow-up. MW = Mittelwert.
Die Studiencharakteristika der RCT, von Semiglazov et al. (2004 und 2006)139, 140 und Tröger et al. (2009 und 2014)141, 143, sind in Abschnitt 5.1.2.1.1 beschrieben.
Die Studie von Bock et al. (2004)145, 146 beschäftigt sich mit der Frage, ob der standardisierte Mistelextrakt Iscador® als komplementäre Therapie zusätzlich zur Standardtherapie in der Langzeittherapie nach der Operation von Patientinnen mit Brustkrebs ohne primäre Metastasen effektiv und sicher ist. Die Studie ist eine multizentrische, retrospektive Kohortenstudie mit zwei Armen – einer Gruppe mit Misteltherapie und einer Kontrollgruppe. Die 16 Studienzentren in Deutschland und der Schweiz bestehen aus neun Krankenhäusern oder Kliniken sowie sieben onkologischen Versorgungszentren. Für den Zeitraum zwischen 1988 und 2000 werden alle Krankenakten zu oben genannten Patientinnen beschafft, die nach der Operation dort behandelt wurden oder noch behandelt werden. 1.442 Patientinnen beziehungsweise deren Akten wurden in die Studie eingeschlossen. Die Nachbeobachtungsphase musste mindestens drei Jahre oder bis zum Tod der Patientin betragen. Ein Sponsor oder Interessenskonflikte sind in den Publikationen nicht angegeben.
Die Studie von Eisenbraun et al. (2011)147 untersucht die Lebensqualität von Patientinnen mit Brustkrebs während der Therapie mit dem Mistelextrakt abnobaVISCUM® Mali, der zusätzlich zur Chemotherapie verabreicht wurde. Die Studie ist eine einarmige prospektive Längsschnittstudie, die bei 84 Studienärzten aus Krankenhausambulanzen oder niedergelassenen Arztpraxen in ganz Deutschland durchgeführt wurde. Zwischen März 2004 und Juni 2006 konnten 271 Patientinnen mit Brustkrebs, ohne Fernmetastasen (UICC Stadien I bis III), für die nach dem aktuellen Stand der Medizin noch eine Chance auf Heilung besteht, für die Studie rekrutiert werden. Die Beobachtungsphase dauerte vom Beginn der Chemotherapie bis vier Wochen nach Ende des letzten Chemotherapiezyklus, im Schnitt 17,7 (SD: 7,1) Wochen. Sponsor und durchführende Instanz ist die Abnoba GmbH.
Die Studie von Loewe-Mesch et al. (2008)/von Hagens et al. (2005)131, 148 wurde geplant als Machbarkeitsstudie für eine randomisierte Therapievergleichsstudie zur begleitenden Misteltherapie mit Iscador M® zusätzlich zur Chemotherapie im Vergleich zur Chemotherapie allein bei Patientinnen mit Brustkrebs. Die Studie ist eine offene, zweiarmige, nicht-randomisierte kontrollierte Interventionsstudie, in der retrospektiv Patientenakten analysiert wurden. Rekrutiert wurde über die Durchsicht von Akten zu Patientinnen mit Brustkrebs, die zwischen Mai 1999 und August 2001 in der Universitätsfrauenklinik Heidelberg in Deutschland behandelt wurden. Es konnten 82 Patientenakten eingeschlossen werden. Voraussetzung war, dass die Patientinnen eine Operation mit anschließender Chemotherapie nach dem CMF- oder EC-Schema (siehe Tabelle 44) bekommen haben. Die Beobachtungs- und Datenerhebungsphase dauerte von Beginn der Chemotherapie bis zwei Wochen nach Beendigung des letzten Chemotherapiezyklus. Die Beobachtungsdauer betrug durchschnittlich zwischen elf und 13 Wochen. Sponsor der Studie ist das Institut Hiscia in Arlesheim in der Schweiz.
Die Studie von Schumacher et al. (2002 und 2003)129, 149 prüft die Wirksamkeit und Unbedenklichkeit einer komplementären Therapie mit dem lektinnormierten Mistelextrakt Eurixor® zusätzlich zur Standardtherapie. Die Studie ist eine multizentrische, retrospektive Kohortenstudie mit zwei Armen ‑einer Misteltherapie- und einer Kontrollgruppe. An der retrospektiven Datenerhebung beteiligten sich Fachärztinnen und Fachärzte, überwiegend Internistinnen und Internisten, Gynäkologinnen und Gynäkologen sowie Allgemeinmedizinerinnen und Allgemeinmediziner, in 27 Studienzentren in verschiedenen Bundesländern in Deutschland. Für den Zeitraum zwischen 1988 und 1997 wurden Krankenakten zu Patientinnen beschafft, die in den Zentren eine onkologische Standardtherapie mit Operation, Chemo- und/oder Radio- und/oder Hormontherapie erhalten haben. 689 Patientinnen wurden in die Studie eingeschlossen. Die Beobachtungsphase hat mit dem Beginn der Standardtherapie begonnen und betrug im Durchschnitt 284,5 Tage. Sponsor der Studie ist die Biosyn Arzneimittel GmbH, die Herstellerin des Eurixor®-Mistelextrakts.
Beschreibungen für die Studien von Semiglazov et al. (2004 und 2006)139, 140 und Tröger et al. (2009 und 2014)141, 143 finden sich in Abschnitt 5.1.2.1.1 und Tabelle 26.
Die statistische Analyse der Studien weist keine Besonderheiten auf.
Alle Studien, einschließlich der RCT, bestehen ausschließlich aus Patientinnen mit Brustkrebs. Eine Operation und eine Standardtherapie werden vorausgesetzt. Patientinnen, die bereits zu Beginn der Studie Metastasen haben, werden ausgeschlossen. Auch Zweittumore, sonstige beeinträchtigende Begleiterkrankungen und die Therapie mit einem anderen Mistelextrakt als dem in der Studie verwendeten Präparat sind in allen Studien Ausschlussgründe. Die studienspezifischen Ein- und Ausschlusskriterien können für die RCT der Tabelle 28 und für die nicht-randomisierten Studien Tabelle 43 entnommen werden.
Tabelle 43: Ein- und Ausschlusskriterien der nicht-randomisierten Studien zur Sicherheit
|
Studie, Jahr |
Ein- und Ausschlusskriterien |
|
Bock (2004a), (2004b) |
Einschlusskriterien:
Ausschlusskriterien:
|
|
Eisenbraun (2011) |
Einschlusskriterien:
Ausschlusskriterien:
|
|
Loewe-Mesch (2008), von Hagens (2005) |
Einschlusskriterien:
Ausschlusskriterien:
|
|
Schumacher (2002), (2003) |
Einschlusskriterien:
Ausschlusskriterien:
|
CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil. EC = Epirubicin und Cyclophosphamid. KPI = Karnofsky Performance Index. TNM = T: Tumor, N: Nodus, M: Metastasen. UICC = Union Internationale Contre le Cancer.
Alle eingeschlossenen Studien setzen als Einschlusskriterium fest, dass die Patientinnen eine Operation erhalten haben müssen, nach der eine Standardtherapie folgt. Die Standardtherapie beinhaltet alle Therapieformen, die laut aktuellen Behandlungsleitlinien zur standardisierten Behandlung gehören und bezieht sich daher auf die Patientinnen aller Studienarme. Dazu gehören neben der Operation auch Chemotherapie, Bestrahlung und Hormontherapie. Die Vergleichstherapie bei Bock et al.145, 146, Loewe-Mesch/von Hagens131, 148 und Schumacher et al.129, 149 sind Patientinnen mit jeweils nur der Standardtherapie. Eisenbraun et al.147 hat keine Vergleichsgruppe. Tabelle 44 beschreibt die Standardtherapie, die Misteltherapie und eine mögliche zusätzliche Therapie für die jeweilige Studienpopulation.
Tabelle 44: Intervention
|
Studie, Jahr |
Standardtherapie |
Form der Misteltherapie |
Zusätzliche Therapie |
|
Bock (2004a), (2004b) |
Operation und Chemotherapie; Bestrahlung; Hormontherapie; oder keine konventionelle Therapie |
Iscador® Zwei bis dreimal wöchentlich s. c. Injektion für drei Monate durchschnittliche kumulative Dosis von 4,367 mg |
Analgetika, Antiemetika, Physiotherapie oder Balneotherapie (Bäder), Nahrungsergänzung (Vitamine, Mineralstoffe, Spurenelemente) |
|
Eisenbraun (2011) |
Operation und adjuvante Chemotherapie nach folgenden Schemata: CMF, EC, AC, FEC oder FAC Je 4 oder 6 Zyklen |
AbnobaVISCUM® Mali Konzentration 90 ng Mistellektin 1 ml Ampulle s. c. 3‑mal pro Woche Anfängliche Dosis 0,02 mg für 2,5 Wochen; Erhöhung auf 0,2 mg für 5 Wochen; bei guter Verträglichkeit weitere Erhöhung auf 2 bis 20 mg |
Antihormonelle Therapie, Radiotherapie |
|
Loewe-Mesch (2008), von Hagens (2005) |
Operation und adjuvante Chemotherapie mit 3 Zyklen CMF oder 4 Zyklen EC |
Iscador® M 5 mg spezial; Konzentration 250 ng Gesamtlektin in 1 ml Ampulle zwei Wochen Einleitungsphase: 0,01–1 mg s. c.; Erhaltungsphase: 2‑mal wöchentlich 1Z Ampulle (2,5 mg) Injektion |
Glukokortikoide, Antiemetika, Antioxidantien |
|
Schumacher (2002), (2003) |
Operation und Chemo‑, Strahlen- und/oder Hormontherapie |
Eurixor®: 2 Ampullen pro Woche |
Analgetika, sonstige Therapie |
A = Adriamycin, Wirkstoff Doxorubicin. C = Cyclophosphamid. CMF = Cyclophosphamid, Methotrexat und 5‑Fluorouracil. E = Epirubicin. EC = Epirubicin und Cyclophosphamid. 5‑FU oder F = 5‑Fluorouracil. M = Methotrexat. ML = Mistellektin. n. b.= nicht beschrieben. s. c. = subkutan.
In der Studie von Bock et al. (2004a), (2004b)145, 146 erhielten alle Patientinnen eine Operation mit anschließender Standardtherapie. Mehrere Therapieformen parallel sind möglich. Eine Chemotherapie (nicht spezifiziert) erhielten 33 % der Iscador®- und 23 % der Kontrollgruppe, eine Bestrahlung 44 % der Iscador®- und 76 % der Kontrollgruppe sowie eine Hormontherapie (je 50 % in beiden Gruppen). Trotz des Einschlusskriteriums, dass für die Patientinnen eine Chemotherapie vorgesehen sein muss, haben 156 Patientinnen (22 %) gar keine konventionelle Therapie erhalten. Antiemetika werden bei 8,6 % der Mistel- und 4,9 % der Kontrollgruppe eingesetzt. Bei Analgetika liegt der Anteil zwischen 4,5 und 6 %. Zusätzlich angewandte Therapieformen waren Physio- oder Balneotherapie (Bäder) und Nahrungsergänzungsmittel (Vitamine, Mineralstoffe, Spurenelemente). Der Mistelextrakt Iscador® wurde über einen Zeitraum von drei Monaten zwei- bis dreimal wöchentlich subkutan injiziert. In der Publikation ist weder berichtet, von wem die Mistelextrakte injiziert wurden, noch wird eine Schulung für Patientinnen erwähnt.
94,3 % der Patientinnen in der Studie von Eisenbraun et al. (2011)147 wurden operiert, 4,8 % erhielten keine Operation und bei 1,9 % sind keine Informationen zu einer Operation bekannt. Alle Patientinnen erhalten eine Chemotherapie. Es gibt keine Einschränkungen zu Therapie-Schema oder zur ‑Dauer. Verwendet werden folgende Schemata verschiedener Kombinationen von Chemotherapeutika: CMF, EC, AC, FEC und FAC (siehe Legende Tabelle 44), die in vier bis sechs Zyklen verabreicht werden. Die Misteltherapie sollte mit einer Toleranzgrenze von einer Woche zeitgleich mit der Chemotherapie starten. Die Studienmedikation ist abnobaVISCUM® Mali in der Konzentration 90 ng Mistellektin auf 1 ml. AbnobaVISCUM® wird dreimal pro Woche injiziert. Die anfängliche Dosis war 0,02 mg für 2,5 Wochen. Die Dosis wurde für die folgenden fünf Wochen auf 0,2 mg erhöht. Bei guter Verträglichkeit wurde die Dosis weiter gesteigert auf 2 bis zu 20 mg. Während der Studie erhielten 53,3 % der Patientinnen zusätzlich eine Bestrahlung und 48,5 % eine antihormonelle Therapie.
In der Studie von Loewe-Mesch et al. (2008)148 und von Hagens et al. (2005)131 ist eine Operation Einschlusskriterium. Postoperativ erhalten alle Patientinnen drei Zyklen CMF oder vier Zyklen EC. Beginn der Misteltherapie war am zweiten bis vierten postoperativen Tag. Die Studienmedikation ist Iscador® M 5 mg spezial in der Konzentration 250 ng. Die zweiwöchige Einleitungsphase, in der eine verringerte Dosis von 0,01–1 mg verabreicht wurde, sollte vor Beginn der Chemotherapie abgeschlossen sein. In der Erhaltungsphase während der Chemotherapie injizierten sich die Patientinnen zweimal wöchentlich eine halbe Ampulle (2,5 mg) des Mistelextrakts selbst. Zusätzliche Therapieformen beschränken sich auf Glukokortikoide, Antiemetika und Antioxidantien.
In der Studie von Schumacher et al. (2002 und 2003)129, 149 erhalten alle Patientinnen eine Operation mit anschließender Standardtherapie in Form einer Chemo‑, Strahlen- oder Hormontherapie. Mehrere Therapieformen parallel sind möglich. In der Mistelgruppe erhalten 43,3 % eine Chemotherapie, 58,9 % eine Bestrahlung und 58,9 % eine Hormontherapie. In der Kontrollgruppe erhalten 26,8 % eine Chemotherapie, 50 % eine Bestrahlung und 60,6 % eine Hormontherapie. Die Misteltherapie bestand aus zwei Ampullen Eurixor® pro Woche. 77,2 % der Patientinnen haben diese Dosis auch eingehalten. Zusätzliche Therapie ist laut Protokoll zwar ausgeschlossen, jedoch haben etwa 3 % der Patientinnen Analgetika erhalten und 17 % der Eurixor®- und 10 % der Kontrollgruppe erhielten eine sonstige Therapie, die nicht weiter spezifiziert ist.
Die Standardtherapie und die Intervention mit Mistelextrakten beziehungsweise die Vergleichsintervention sind für die RCT von Semiglazov et al. (2004)139, Semiglazov et al. (2006)140 und Tröger (2009 und 2014)141, 143 in Abschnitt 5.1.2.1.3 beschrieben.
In Tabelle 45 sind die primären und sekundären Zielgrößen, wie in den Studien angegeben, berichtet.
Tabelle 45: Primäre und sekundäre Zielgrößen der Studien
|
Studie, Jahr |
Zielgrößen |
|
Bock (2004a), (2004b) |
Primäre Zielgrößen: Inzidenz UAW der konventionellen Therapie Sekundäre Zielgrößen: Symptome mit Bezug zur Erkrankung und Behandlung oder zum Überleben Sicherheit der Misteltherapie (nicht differenziert):
|
|
Eisenbraun (2011) |
Primäre Zielgrößen:
Sekundäre Zielgrößen:
|
|
Loewe-Mesch (2008), von |
Primäre Zielgrößen: |
|
Hagens (2005) |
UAW (nicht differenziert): |
|
Schumacher (2002), (2003) |
Primäre Zielgrößen: Veränderung des Symptomscores zwischen Start und Ende der postoperativen Behandlung Symptome, die in den Score einfließen und mit 0 (keine Symptome), 1 (milde Symptome) oder 2 (schwere Symptome) bewertet werden: Anzahl und Schweregrad UAW; typische krankheits- und therapiebezogene Anzeichen: Übelkeit, Erbrechen, Appetitlosigkeit, Magen-/Oberbauchbeschwerden, Kopfschmerzen, Gedächtnis-/Konzentrationsstörungen, Reizbarkeit, Belastungsdyspnoe, Schlafstörungen, Tumorschmerzen, Atemnot, Blutarmut, Hautirritationen, Infektionen |
|
Die primären und sekundären Zielgrößen für Semiglazov (2004 und 2006) sowie Tröger (2009 und 2014) sind bereits in Tabelle 30 beschrieben. |
|
|
EORTC = European Organisation for Research and Treatment of Cancer. QLQ = Quality of Life Questionnaire (deutsch: |
|
Fragebogen zur Lebensqualität). UAW = Unerwünschte Arzneimittelwirkung.
Tabelle 45 beinhaltet sämtliche Zielgrößen der Studien. Alle eingeschlossenen Studien berichten Ergebnisse zur Verträglichkeit oder UAW der Misteltherapie als Zielgröße der jeweiligen Studie oder beschreiben unerwünschte Wirkungen der Misteltherapie zusätzlich zu den Zielgrößen in einem separaten Absatz im Ergebnisteil. Meistens sind sicherheitsrelevante Aspekte als sekundäre Zielgröße definiert oder werden nur im Text des Ergebnisteils oder in der Diskussion der Publikation erwähnt.
Alle in die Informationssynthese dieses HTA-Berichts eingeschlossenen sicherheitsrelevanten Zielgrößen sind in Tabelle 46 zusammengefasst mit einer Erläuterung, wie die einzelnen Ergebnisse gemessen wurden und was von den Autoren jeweils unter UAW der Misteltherapie verstanden wird.
Tabelle 46: Operationalisierung der sicherheitsrelevanten Zielgrößen zur Misteltherapie je Studie
Studie, Jahr Operationalisierung
|
RCT |
|
|
Semiglazov (2004) |
Anzahl der Krankenhaustage, UAW, sicherheitsrelevante Labortests |
|
Semiglazov (2006) |
UAW (Reaktionen an der Einstichstelle), sicherheitsrelevante Labortests |
|
Tröger (2009), (2014) |
UAW (kodiert über MedDRA), lokale Reaktionen (Reaktionen unter 5 cm Durchmesser wurden nicht als lokale Reaktion gewertet), Körpertemperatur |
|
Nicht-randomisierte Studien |
|
|
Bock (2004a), (2004b) |
Inzidenz und Schweregrad der UAW |
|
Eisenbraun (2011) |
Verträglichkeit und Sicherheit (kodiert über MedDRA und Angaben zum Schweregrad) aus Sicht der behandelnden Person und der Patientin |
|
Loewe-Mesch (2008), von Hagens (2005) |
Modifikation der Misteldosis, UAW |
|
Schumacher (2002), (2003) |
Anzahl und Schweregrad der UAW der Misteltherapie, deren Dauer, Behandlung und Folge |
MedDRA = Medical Dictionary for Regulatory Activities, eine Skala, um Nebenwirkungen zu messen; Einteilung der Ausprägungen: 1 = sehr schlecht; 2 = moderat; 3 = gut; 4 = exzellent. RCT = Randomisierte kontrollierte Studie. UAW = Unerwünschte Arzneimittelwirkung.
Die Nebenwirkungen werden zur leichteren Vergleichbarkeit im vorliegenden HTA-Bericht in verschiedene Schweregrade eingeteilt: in leichte (Grad 1), mittlere (Grad 2), schwere (Grad 3) und sehr schwere Reaktionen (Grad 4). Die Definition der Schweregrade erfolgt nach der Common Terminology Criteria for Adverse Events v4.0 (CTCAE) ‑Skala283, einer allgemeinen, krankheitsübergreifenden Skala, die auf sämtliche Krankheitsbilder angewendet werden kann. In Tabelle 47 bilden die Definitionen zu den Graden 1 bis 5 die Ausgangsbasis für das Bewertungsschema. In der rechten Spalte „Definition und Operationalisierung“ ist dargestellt, welche Ausprägung der UAW der Misteltherapie welchem Grad entspricht. Die Operationalisierung ist angelehnt an die Publikationen von Bock et al. und Tröger et al.141, 143, 145, die ihre Ergebnisse bereits nach der CTCAE-Skala berichtet haben, jedoch nicht identisch.
Wenn die UAW nicht bereits nach CTCAE-Graden berichtet sind, werden die Nebenwirkungen von einer der Autorinnen zugeordnet (CS):
Tabelle 47: Definition der Zielgrößen zu UAW der Misteltherapie nach der CTCAE-Skala
|
Zielgröße |
Definition und Operationalisierung |
|
Leichte UAW (Grad 1) |
Asymptomatisch oder milde Symptome; nur klinische oder diagnostische Beobachtung, keine Behandlung erforderlich |
|
Moderate UAW (Grad 2) |
Minimale, lokale oder nicht-invasive Behandlung erforderlich; Einschränkung der altersgemäßen instrumentellen Aktivitäten des täglichen Lebens |
|
Leichte und moderate UAW (Grad 1–2): Lokalreaktionen |
Lokale Reaktionen an der Einstichstelle, Rötungen (< 5 cm Durchmesser), Rötungen (> 5 cm Durchmesser), Schwellungen, Juckreiz, leichte Schmerzen, Ödeme |
|
Leichte und moderate UAW (Grad 1–2): Allgemeinreaktionen |
Subjektiv: Abgeschlagenheit, Kopfschmerzen, Grippegefühl, Müdigkeit, Kopfdruck, Exanthem, Übelkeit, nicht spezifiziertes Unwohlsein objektiv: leichtes Fieber, Temperaturanstieg |
|
Schwere UAW (Grad 3) |
Schwerwiegende oder medizinisch signifikante, aber nicht unmittelbar lebensbedrohliche Nebenwirkungen; Krankenhausaufenthalt oder Verlängerung des Krankenhausaufenthalts erforderlich; körperlich behindernd; Einschränkung bei der eigenen Versorgung und bei Aktivitäten des täglichen Lebens |
|
Sehr schwere UAW (Grad 4) |
Lebensbedrohliche Konsequenzen, sofortige medizinische Intervention erforderlich |
|
Tod durch UAW (Grad 5) |
Tod hängt direkt mit der Nebenwirkung der Misteltherapie zusammen |
CTCAE = Common Terminology Criteria of Adverse Events. UAW = Unerwünschte Arzneimittelwirkung.
Die Bewertung, ob ein kausaler Zusammenhang zwischen der Misteltherapie und der UAW besteht, basiert auf den Angaben der jeweiligen Studienärzte in der Veröffentlichung. Wenn in einer Publikation beschrieben ist, dass der Zusammenhang zwischen einer bestimmten UAW und der Misteltherapie unwahrscheinlich ist, wird diese Annahme übernommen.
Tabelle 48: Auflistung der relevanten Endpunkte nach Studien
|
Bock (2004a; 2004b) |
Eisenbraun (2011) |
Loewe-Mesch (2008), von Hagens(2005) |
Schumacher (2002, 2003) |
Semiglazov (2004) |
Semiglazov (2006) |
Tröger (2009, 2014) |
|
|
Unerwünschte Nebenwirkungen der begleitenden Misteltherapie |
x |
x |
x |
x |
x |
x |
x |
|
Lokale Reaktionen |
x |
x |
x |
x |
x |
x |
x |
|
Systemische Reaktionen |
x |
x |
x |
- |
x |
x |
x |
|
Notwendige therapeutische Maßnahmen aufgrund von Nebenwirkungen |
- |
- |
- |
x |
x |
x |
x |
|
Studienabbrüche aufgrund der Misteltherapie |
x |
x |
x |
x |
x |
x |
x |
x Daten werden berichtet und sind verwertbar. – Es werden keine Daten berichtet.
Für die RCT beinhaltet die Bewertung des Verzerrungspotenzials in Abschnitt 5.1.2.1.5 bereits die Zielgrößen zur Sicherheit – als subjektive Zielgröße systemische Reaktionen und als objektive Zielgrößen lokale Reaktionen und Laborparameter. Da aus den vier zusätzlich eingeschlossenen Studien nur UAW der Misteltherapie extrahiert werden, die nur den jeweiligen Interventionsarm mit der Misteltherapie betreffen können, wird für diese zusätzlichen Studien das Verzerrungspotenzial nicht mit der Risk of Bias-Checkliste (Risk of Bias = RoB) bewertet, da sich die meisten Punkte der RoB-Checkliste auf den Gruppenvergleich beziehen. Loss-to-follow-up und selektives Berichten sind hingegen auch für einarmige Studien relevant. Zwei der Studien waren retrolektive Kohortenstu-dien129, 145, 146, 149. In der Studie von Bock et al. wurden alle Akten innerhalb eines bestimmten Zeitraums eingeschlossen, die den Einschlusskriterien entsprachen. Davon wurden insgesamt 10,3 % der Patientinnen aus verschiedenen Gründen wie fehlender Daten und Protokollverletzungen ausgeschlossen ohne weitere genaue quantitative Zuordnung. Wie genau der Ausgangsdatensatz in der Studie von Schumacher et al. zustande kam, ist unklar, ob es sich dabei beispielsweise um alle Daten innerhalb eines bestimmten Zeitraums in den verschiedenen Studienzentren handelt. Insofern kann man eine Verzerrung durch Selektion nicht ausschließen. Nach Ausschluss der Patientinnen, die eines der Ausschlusskriterien erfüllten, wurden die Daten der verbleibenden Patientinnen ausgewertet. Die beiden anderen Studien131, 147, 148 hatten ein prospektives Studiendesign. Es ist unklar, ob die Patientinnen in der Studie von Eisenbraun et al. konsekutiv rekrutiert wurden. Es wird nur berichtet, dass 271 Patientinnen, die den Einschlusskriterien entsprachen von März 2004 bis Juni 2006 rekrutiert wurden. Davon wurden die Daten von 270 Patientinnen analysiert. Es fehlen Angaben, wie viele der prinzipiell eligiblen Patientinnen nicht teilnehmen wollten. Insofern lassen sich mögliche Selektionseffekte nicht beurteilen. Nur in der Interventionsstudie von Loewe-Mesch et al.148 wird der Selektionsprozess der Studienpopulation in einem Flussdiagramm detailliert dargestellt. Nach Durchsicht der Patientinnenakten anhand der Ein- und Ausschlusskriterien verblieben 521 Patientinnen, wovon 35 % nicht teilnehmen wollten und weitere 35 % aus nicht näher spezifizierten anderen Gründen nicht teilnahmen. Die verbliebenen 154 Patientinnen wurden nach eigenem Wunsch der Interventionsoder der Kontrollgruppe zugeteilt, davon wurden insgesamt 47 % nachträglich wegen Nicht-Erfüllung der Einschlusskriterien ausgeschlossen. Von den verbleibenden Patientinnen konnten 8,3 % nicht analysiert werden. In dieser Studie ist ebenfalls mit Verzerrung durch (Selbst-) selektion der Patientinnen zu rechnen.
Da kein veröffentlichtes Studienprotokoll zu den retrospektiven Studien verfügbar ist, können die Angaben in den Publikationen nicht abgeglichen werden und das Risiko für eine Verzerrung durch selektives Berichten ist unklar.
Die Gruppengrößen der Studienarme und die Anzahl der ausgewerteten und ausgeschlossenen Teilnehmerinnen – mit Ausschlussgründen – wurde für die RCT bereits in Abschnitt 5.1.2.1.6 berichtet. Der Patientinnenfluss für die zusätzlichen nicht-randomisierten Studien folgt in Tabelle 49. In die Informationssynthese zu UAW der Misteltherapie werden ausschließlich die ausgewerteten Patientinnen der Mistelgruppen der Studien eingeschlossen.
|
Studie, Jahr |
Anzahl Gruppen; Bezeichnung der Gruppen |
Anzahl eingeschlossen und auf Eignung überprüft |
Anzahl ausgewertet |
Anzahl ausgeschlossen |
|
Bock (2004a), (2004b) |
2; Iscador®; KG |
1.607; (Aufteilung nach Gruppe n. b.) |
1.442 Iscador®: 710 KG: 732 |
165 (bei der Durchsicht der Akten) (Gruppe n. b.) |
|
Eisenbraun (2011) |
1; AbnobaVISCUM® |
271 |
270 |
1 (ab Anfangserhebung) |
|
Loewe-Mesch (2008), von Hagens (2005) |
2; Iscador® M 5 mg spezial; KG |
82; Iscador®: 39 KG: 43 |
66 Iscador®: 33 KG: 33 |
16; Iscador®: 6 KG: 10 |
|
Schumacher (2002), (2003) |
2: Eurixor® und KG |
689 Eurixor®: 219 KG: 470 |
689 Eurixor®: 219 KG: 470 |
0 |
KG = Kontrollgruppe. n. b. = Nicht beschrieben.
Die Studie von Bock et al. (2004a und 2004b)145, 146 hat zwei Studienarme mit ungefähr gleich vielen Teilnehmern: 710 in der Iscador®- und 732 in der Kontrollgruppe. Zur Bewertung der Sicherheit der Misteltherapie werden nur die Ergebnisse für die Patientinnen aus der Iscador®-Gruppe verwendet. Bei der Durchsicht der Akten wurden 165 potenziell geeignete Patientinnen ausgeschlossen, weil die Dokumentation nicht vollständig genug war, um die Akte in die Analyse einzubeziehen. Die Einteilung in eine Interventions- und eine Kontrollgruppe hat erst nach der Durchsicht der Akten stattgefunden. Daher ist auch nicht berichtet, wie viele Akten mit beziehungsweise ohne Misteltherapie ausgeschlossen wurden. Bezüglich vorab definierter Informationen zur Studienplanung sowie den Ein- und Ausschlusskriterien verweisen die Autoren auf ein Studienprotokoll, in dem nach den Standards einer guten klinischen Praxis sämtliche Details zur Studie dokumentiert wurden. Die Autorinnen dieses HTA-Berichts haben jedoch keinen Zugang zu dem Protokoll, um die Aussagen zu überprüfen.
Die Studie von Eisenbraun et al. (2011)147 ist einarmig und beschreibt ausschließlich Patientinnen mit Brustkrebs, die eine Misteltherapie mit abnobaVISCUM® zusätzlich zur Standardtherapie erhalten. Eine Patientin wurde ausgeschlossen, weil sie ausschließlich für die Anfangsuntersuchung im Studienzentrum erschienen war und danach nicht mehr. Alle anderen 270 Teilnehmerinnen werden in die Bewertung der Sicherheit der Misteltherapie eingeschlossen.
Die Studie mit den zwei Publikationen von Loewe-Mesch et al. (2008)148 und von Hagens et al. (2005)131 ist die einzige Interventionsstudie in Tabelle 49. Die Patientinnen wurden zu Beginn der Studie einer Gruppe nach deren eigenem Wunsch zugeteilt. Von den anfangs 39 in die Interventions- und den 43 in die Kontrollgruppe aufgenommenen Patientinnen schieden sechs aus der Iscador®- sowie zehn aus der Kontrollgruppe aus. Am Ende wurden je 33 Patientinnen pro Gruppe ausgewertet. Als Angabe für das Ausscheiden von fünf Teilnehmerinnen aus der Mistelgruppe wurde Loss-to-follow-up ohne Details angegeben. Die sechste ausgeschiedene Patientin entwickelte eine Allergie, die möglicherweise auf die Misteltherapie zurückzuführen ist. In der Kontrollgruppe war bei vier Patientinnen kein Follow-up möglich, zwei haben während der Studie mit einer Misteltherapie begonnen und bei weiteren vier Patientinnen wurde die Chemotherapie entweder geändert oder abgebrochen.
Bei Schumacher et al. (2002 und 2003)129, 149 entsprechen die eingeschlossenen Patientinnen den ausgewerteten Patientinnen. Die 219 Patientinnen aus der Eurixor®-Gruppe werden in die Analyse zu sicherheitsrelevanten Zielgrößen eingeschlossen.
Für die Studien zur Sicherheit wird der Tumorstatus in Tabelle 50 dargestellt. Unterschiede zwischen Mistel- und Kontrollgruppe sind für die Informationssynthese der UAW der Misteltherapie nicht relevant, weil hier nur die Ergebnisse der Mistelgruppe ausgewertet werden. Angaben zur Wirksamkeit der Misteltherapie aus diesen Studien gehen nicht in die Informationssynthese ein.
Tabelle 50: Charakteristika der Studienpopulation der nicht-randomisierten Studien zur Sicherheit
|
Studie, Jahr |
Alter in Jahren Mittelwert (SD) |
Befallene Lymphknoten Anzahl (%) |
Tumorklassifikation Anzahl (%) |
Tumorgrad Anzahl (%) |
UICC Anzahl (%) |
|
Bock (2004a), (2004b) |
Iscador®: 53 (n. b.) |
Iscador®: N+: 329 (46,3) |
Iscador®: T2–4: 436 (61,4) |
Iscador®: G3‑4: 256 (36,1) |
Iscador®: II-III: 518 (73,0) |
|
Eisenbraun (2011) |
AbnovaVISCUM®: 55,3 (10,1) |
n. b. |
T2–4: 184 (68,1) |
n. b. |
|
|
Loewe-Mesch (2008), von Hagens (2005) |
Iscador®: 47,5 (10,3) |
Iscador® N0: 18 (54,5) N1: 15 (45,5) |
Iscador® T1: 18 (54,5) T2: 15 (45,5) |
n. b. |
n. b. |
|
Schumacher (2002), (2003) |
Eurixor® Median: 60 (33–92) |
Eurixor® N+: 96 (43,8) |
n. b. |
Eurixor® G > 2: 46 (21,2) |
Eurixor®
|
Die Angaben zu Semiglazov (2004), Semiglazov (2006) und Tröger (2009 und 2014) sind in Tabelle 35 zu finden.
-
*Erklärungen zur Einteilung der Stadien nach UICC und TNM sind in Tabelle 1 dargestellt.
-
n. b =. Nicht berichtet. SD = Standardabweichung. TNM = T: Tumor, N: Nodus, M: Metastasen. UICC = Union Internationale Contre le Cancer (Stadien I bis IV; für die Definition der einzelnen Stadien siehe Tabelle 1).
Tumorstadien:
T1: Tumor bis 2 cm (bei Tröger sind Tis, T1mic und T1 zusammengefasst).
T2: Tumor > 2 cm bis 5 cm.
T3: Tumor > 5 cm.
T4: Tumor jede Größe mit Ausdehnung auf die Brustwand der Haut; befallene Lymphknoten (Kurzfassung): N0: Keine Lymphknotenmetastasen; N+: mindestens eine Lymphknotenmetastase, alle Lokalisationen.
Tumorgrade: G1: gut differenziert; G2: mäßig differenziert; G3: schlecht differenziert; G4: undifferenziertes bösartiges Gewebe; G9: Differenzierungsgrad nicht beurteilbar.
Weitere Ausführungen zur UICC- und TNM-Klassifikation mit detaillierteren Beschreibungen der Abkürzungen und Stadien sind im Hintergrundteil in Abschnitt 1.2.3 erklärt.
In der Studie von Bock et al. (2004)145, 146 sind die Teilnehmerinnen aus der Interventionsgruppe durchschnittlich 53 Jahre. Eine SD ist für das Alter nicht angegeben. Die tumorspezifischen Charakteristika sind in dieser Studie nur für Gruppen mit höherem Risiko berichtet, das heißt für die Patientinnen mit mindestens einem mit Metastasen befallenen Lymphknoten (46,3 %), der Anteil der Patientinnen mit einer Tumorgröße ab 2 cm (61,4 %) und welcher Anteil der Patientinnen bereits in die Gruppen G3 und G4 fällt (36,1 %). 44,9 % der Patientinnen haben einen schlecht differenzierten Tumor oder das bösartige Gewebe kann nicht mehr differenziert werden. Die Tumorklassifikation ist für die Patientinnen von Bock et al. die höchste im Vergleich zu den anderen Studien.
Die Patientinnen mit Brustkrebs in der Studie von Eisenbraun et al. (2011)147 sind im Schnitt 55,3 Jahre alt. Der durchschnittliche KPI liegt bei 84 Punkten. 68,1 % der Patientinnen haben ein Tumorstadium von T2 bis T4, das heißt, der Tumor ist bereits invasiv, aber dehnt sich nicht auf die Brustwand aus. In Stadium I nach UICC befinden sich 18,5 % der Patientinnen, in Stadium II 42,6 %, in Stadium III 10,4 % und in Stadium IV 4,4 %. Die UICC-Stadien sind in Tabelle 1 beschrieben.
In der Studie von Loewe-Mesch et al. (2008)148 und von Hagens et al. (2005)131 sind mit durchschnittlich 47,5 Jahren die jüngsten Patientinnen im Vergleich zu den anderen nicht-randomisierten Studien. Das Alter ist vergleichbar mit den Patientinnen der RCT. In dieser Studie sind die Patientinnen tendenziell in einem besseren Gesundheitszustand als bei Bock et al. (2004)145, 146 und Eisenbraun et al. (2011)147. Aus der Iscador®-Gruppe haben 45,5 % der Patientinnen einen befallenen Lymphknoten und die Ausdehnung des Tumors ist bei keiner der Patientinnen über 5 cm.
Die Teilnehmerinnen der Studie von Schumacher et al. (2002 und 2003)129, 149 sind in der Mistelgruppe im Median 60 Jahre, zwischen 33 und 92 Jahren. Der Mittelwert ist für das Alter nicht berichtet. 43,8 % der Patientinnen haben mindestens einen befallenen Lymphknoten. 46 (21,2 %) der Patientinnen haben bereits einen schlecht differenzierten Tumor oder ein undifferenziertes bösartiges Gewebe. Die Verteilung der Patientinnen nach UICC-Stadien zeigt, dass knapp ein Viertel der Patientinnen noch im Stadium I und über die Hälfte (54,2 %) im Stadium II sind. Stadium II heißt, dass die Patientinnen entweder bereits mindestens einen befallenen Lymphknoten haben oder der Tumor ist bereits über zwei Zentimeter. 19 % der Patientinnen befinden sich in Stadium IV, in dem bereits Fernmetastasen bestehen.
Die Studienpopulationen von Semiglazov et al. (2004 und 2006)139, 140 und Tröger et al. (2009 und 2014)141, 143 sind in Abschnitt 5.1.2.1.2 beschrieben.
5.1.2.2.8 Ergebnisse zu Effekten
Die Ergebnisse zu den UAW der Interventionsgruppen werden nach dem Schweregrad der UAW unterteilt. Da sich die Beschreibung der UAW zwischen den Studien unterscheidet, wurden die Ergebnisse zur Sicherheit der Misteltherapie zugunsten der Vergleichbarkeit der Studien unter Verwendung der Common Terminology Criteria of Adverse Events (CTCAE-Skala)283 vereinheitlicht. Zwei Studien141, 143, 145, 146 verwenden bereits in der Publikation die Einteilung nach der CTCAE-Skala. Die anderen Autoren129, 131, 139, 140, 147–149 beschreiben die Ausprägung der UAW als „mild“, „schwerwiegend’ oder „sehr schwer’, und werden von den Autorinnen dieses HTA-Berichts in die Schweregrade nach CTCAE eingeteilt. Da die leichten und mittleren UAW (entsprechen Grad 1 und Grad 2) nur auf Grundlage der deskriptiven Angaben in den Publikationen schwer voneinander abgrenzbar sind, werden diese in Tabelle 51 zu einer Kategorie zusammengefasst. Dafür werden UAW mit Grad 1 oder Grad 2 nach Lokalreaktionen und systemischen Reaktionen unterschieden. Die leichten und moderaten UAW sind meistens spezifisch für die Misteltherapie, deshalb können diese Zielgrößen spezifischer operationalisiert werden als die UAW von Grad 3 bis 5. Die Einstufung der UAW als leicht, moderat, schwer oder sehr schwer basiert, ebenso wie die Beurteilung des Zusammenhangs einer UAW mit dem verabreichten Mistelpräparat, auf der Einschätzung der Autoren der Publikationen.
Für jede der Studien sind im Anhang (in Tabelle 131) die sicherheitsrelevanten Ergebnisse mit Bezug zur Misteltherapie ausführlich beschrieben. Sämtliche Ausprägungen der UAW der Misteltherapie mit Unterscheidung nach systemischen und lokalen Reaktionen sind in Tabelle 51 zusammengefasst.
Die Nebenwirkungen der Misteltherapie wurden grundsätzlich bei jedem Besuch der Patientin erfasst131, 139–141, 143, 148, 281. Bei den retrospektiven Studien ist nicht berichtet, wie genau die Dokumentation in den Akten ist129, 145, 146, 149. Wenn eine UAW bei einer Person mehrfach auftritt, wird diese in fast allen Studien129, 131, 139, 140, 145–149 mit Ausnahme der Studie von Tröger et al. (2009 und 2014)141, 143 nur als eine UAW gezählt. Bei letzterer werden alle UAW-Ereignisse gezählt und auf die Anzahl der Mistelinjektionen und nicht auf die Anzahl der Patientinnen mit Misteltherapie bezogen. In dieser Studie werden UAW auch anders als in den anderen Studien über Interviews mit Patientinnen und Ergebnisse der Laboranalysen bei jedem Besuch erhoben.
Aufgrund des unterschiedlich berichteten Detailgrads der UAW und deren Behandlung in den einzelnen Publikationen, können nicht alle UAW nach Schweregrad angegeben werden. Bei Eisenbraun147 und Schumacher129, 149 ist nicht klar, auf wie viele Patientinnen sich die UAW beziehen. Deshalb werden systemische Reaktionen – wie Kopfschmerzen, Abgeschlagenheit oder Schwindel – einzeln genannt.
Die Ergebnisse in den Tabellen (Tabelle 51 und Tabelle 52) beziehen sich ausschließlich auf die Interventionsarme, nicht auf die Kontrollen.
Tabelle 51: Zusammenfassung der Ergebnisse zu UAW der Misteltherapie
|
Anzahl Patienten Mistelgruppe |
Leichte oder moderate UAW (Grad 1 und 2) Anzahl (%) |
Schwere UAW (Grad 3) Anzahl (%) |
Sehr schwere UAW (Grad 4 und 5) Anzahl (%) |
||
|
Lokalreaktionen* Anzahl (%) |
Systemische Reaktionen Anzahl (%) |
||||
|
RCT |
|||||
|
Semiglazov (2004) |
202, davon: ND: 67 MD: 67 HD: 68 |
ND: 6 (9) MD: 12 (17,9) HD: 21 (32,4) |
4 (2,3), davon: ND: 3 (4,5); HD: 1(1,5)** |
0 (0) |
1 (0,5)** nekrotisierende Kolitis (wahrscheinlich nicht von der MT) |
|
Semiglazov (2006) |
176 |
31 (37,8) |
Rötung 1 (1,2); Allergische Reakt.: 1 (1,2) |
1 (1,2) akute Otitis (wahrscheinlich nicht von der MT) |
0 (0) |
|
Tröger (2009), (2014) |
59 |
IMS: 6 (0,49) der 1618 Injektionen HXA: 14 (0,9) der 1.527 Injektionen |
IMS: 0 (0); HXA: 1 (3,4) (Rhinokonjunktivitis), weitere, aber nicht |
HXA: 27 (1,8) der 1.527 Injektionen (Lokalreaktionen) |
0 (0) |
aufgrund MT: 2 (6,9)
Nicht-randomisierte Studien
|
Bock (2004a), (2004b) |
710 |
123 (17,3); davon 87 (12,3) Grad 1 |
6 (0,8) 0 (0) |
0 (0) |
|
Eisenbraun (2011) |
271 |
235 (86,7), davon 182 (77,5) < 5 cm |
89 (32,8) 0 (0) Abgeschlagenheit; 65 (24,1) Kopfschmerzen; 51 (18,9) Unwohlsein; 1 (0,4) Schwindel; 1 (0,4) Dermatitis |
1 (0,4) nekrotisierende Kolitis (wahrscheinlich nicht von der MT) |
|
Loewe-Mesch (2008), von Hagens (2005) |
33 |
21 (64) vor Chemotherapie; 31 (94) mit Chemotherapie |
n. b. in Zahlen 0 (0) |
0 (0) |
|
Schumacher (2002), (2003) |
219 |
10 (4,6) |
12 (5,5) 0 (0) Hautreaktionen (Rötung, Erythem oder Quaddel); 6 (2,7) sonstige, davon 2 (0,9) Juckreiz; 2 (0,9) Allergische Reaktion; 1 (0,5) Schmerzen; 1 (0,5 )Fieber |
0 (0) |
*Lokalreaktionen sind bei Tröger et al. (2009 und 2014) beschränkt auf Reaktionen an der Einstichstelle der Mistelinjektion. Sonstige Hautreaktionen sind systemische Reaktionen und werden wie die anderen systemischen Reaktionen als Anzahl der Patientinnen im Studienarm angegeben. Die Anzahl der lokalen Reaktionen wird bei Tröger anteilig an allen Injektionen, bei allen anderen Studien als Anteil von Patientinnen mit UAW berichtet.
**Hierbei handelt es sich um dieselbe Patientin siehe Text zur Studie. Der Schweregrad der UAW war in der Publikation nicht explizit angegeben. Aufgrund der Darstellung, „afterthe withdrawal ofthe study medication, the erythrema disappeared” haben wir den Vorfall UAW Grad 1 ‑2 zugeordnet.
HD = Hohe Dosis (70 ng(ML)/ml). HXA = Helixor® A. IMS = Iscador®. MT = Misteltherapie. ND = Niedrige Dosis (10 ng(ML)/ml). MD = Mittlere Dosis (30 ng(ML)/ml). n. b. = nicht beschrieben. RCT = Randomisierte kontrollierte Studie. UAW = Unerwünschte Arzneimittelwirkung.
Sechs Studien129, 131, 139, 140, 145–149 berichten die Lokalreaktionen bezogen auf die Anzahl der Patientinnen, eine Studie141, 143 berichtet die Lokalreaktionen als Anteil der Injektionen.
Zusammenfassend weisen sechs Studien129, 131, 139, 140, 145–149 mit acht Interventionsgruppen einen Median von 25,2 % Patienten (Spannweite: 4,6 bis 94 %) mit Lokalreaktionen geringen oder mittleren Grades auf, wobei Tröger et al. (2009 und 2014) aufgrund der unterschiedlichen Messung in die Zusammenfassung nicht einbezogen wurde, sondern separat berichtet wird. Zu sieben Studien129, 131, 139–141, 143, 145–149, inklusive Tröger et al. (2009 und 2014), wurden Zahlen zu leichten und mittleren systemischen Reaktionen in den Studienpopulationen berichtet, die im Median bei 1,95 % (Spannweite: 0 bis 8,2 %) liegen. Tröger et al. (2009 und 2014)141, 143, die den Anteil der Lokalreaktionen als Anteil an allen Injektionen gemessen haben, berichteten für leichte und mittlere Lokalreaktionen 0,49 % bei Iscador® und 0,9 % leichte und moderate beziehungsweise 1,8 % schwere Lokalreaktionen für Helixor® A. Der Anteil der leichten und moderaten systemischen Reaktionen, lag bei 0 beziehungsweise 3,4 %. Eine schwergradige Reaktion wurde in einer Studie140 bei einer Patientin dokumentiert (Otitis). Die Otitis wurde als wahrscheinlich nicht auf die Misteltherapie zurückzuführen, klassifiziert. Die 27 schwerwiegenden Lokalreaktionen von Tröger et al. in der Helixor® A‑Gruppe sind wieder getrennt berichtet, da es sich bei den 1,8 % um einen Anteil an allen Injektionen handelt. Nur in zwei Studien139, 147 traten sehr schwergradige UAW auf, die jedoch wahrscheinlich nicht der Misteltherapie zugerechnet werden können. In fünf Studien wurden quantitative Angaben zur Behandlung der UAW gemacht. Eine Spontanheilung erfolgte im Median bei 76,3 % (Spannweite von 12 bis 100 %). Der Anteil der Studienabbrecher aufgrund der UAW der Misteltherapie lag in sieben Studien im Median bei 1,3 % mit einer Spannweite von 0 bis 6,3 %.
Im Anschluss werden die Ergebnisse zu UAW der Misteltherapie im Einzelnen berichtet.
Semiglazov et al. (2004)139 und Semiglazov et al. (2006)140 sind die einzigen placebokontrollierten Studien und berichten einen Vergleich zwischen lokalen Reaktionen bei Mistelextrakten im Vergleich zum Placebo, jedoch wird die Placebogruppe für die weiteren Ausführungen zur Bewertung der Sicherheit nicht beachtet. Mehrfache lokale Reaktionen wurden nur einmal pro Patientin gezählt. Die Autoren der Publikationen kommen zu dem Schluss, dass nur die lokalen Reaktionen auf die Misteltherapie zurückzuführen sind und sämtliche anderen UAW mit der Chemotherapie in Zusammenhang stehen oder eine unklare Ursache haben.
In der Studie von Semiglazov et al. (2004)139 hatten 39 (20 %) der Patientinnen aus den Gruppen mit Misteltherapie (die Aufteilung nach Studienarmen ist Tabelle 51 zu entnehmen) mindestens eine lokale und vier (2,3 %) eine systemische Reaktion. Eine Patientin hatte sowohl eine unerwünschte systemische Nebenwirkung aufgrund der Misteltherapie als auch eine schwere Begleiterkrankung, an der sie später verstorben ist. Die Patientin aus der Hochdosisgruppe hatte ein Erythem entwickelt, das mit der Misteltherapie in Zusammenhang stehen könnte. Die Mistelinjektionen wurden daraufhin beendet und das Erythem verschwand. Einige Tage später erkrankte die Patientin an einer eitrigen nekrotisierenden Enterokolitis (entzündliche Darmerkrankung) mit einer febrilen Neutropenie, die als Nebenwirkung der Chemotherapie bekannt ist, und erlitt ein toxisches Schocksyndrom aufgrund der Infektion, was zum Tod der Patientin führte. Sowohl die leichte bis moderate UAW (Grad 1 bis 2) in der Hochdosisgruppe, als auch die sehr schwere UAW (Grad 4 und 5) (beide in Tabelle 51) sind auf diese Patientin zurückzuführen. Letztere wird jedoch nicht auf die Misteltherapie zurückgeführt.
In der Studienpopulation von Semiglazov et al. (2006)140 wurden insgesamt 288 UAW berichtet (dieser Wert wurde nicht getrennt für die Lektinol®-Gruppe berichtet). Bei 253 Nebenwirkungen wurde der Zusammenhang zu Mistelextrakten als unwahrscheinlich berichtet. 31 Patientinnen (17,6 %) der Lektinol®- beziehungsweise drei Patientinnen (1,7 %) in der Placebogruppe hatten eine lokale Reaktion an der Einstichstelle. Eine Patientin aus der Lektinol®-Gruppe wurde stationär aufgenommen wegen einer akuten Otitis, die als wahrscheinlich auf die Chemotherapie zurückzuführen, klassifiziert war.
Die Studie von Tröger et al. (2009 und 2014)141, 143 ist hier separat berichtet, da die Anzahl der lokalen Reaktionen, anders als bei den anderen Studien, anteilig an allen Injektionen gemessen wird. Die anderen eingeschlossenen Studien geben den prozentualen Anteil der von UAW betroffenen Patientinnen an, unabhängig von der Anzahl der Injektionen. Lokale Reaktionen werden zudem erst ab 5 cm Durchmesser als UAW gewertet. Als Begründung wird genannt, dass lokale Reaktionen bis 5 cm bei Mistelinjektionen zu erwarten seien.
Für die Iscador®-Gruppe wird von sechs lokalen Reaktionen bei 1.618 Injektionen (0,49 %) berichtet. Sonst gab es keine Nebenwirkungen. In der Helixor® A‑Gruppe berichteten 20 der 34 Patientinnen insgesamt 45 UAW. 42 davon waren Reaktionen an der Injektionsstelle. Das entspricht 2,7 % aller Helixor® A‑Injektionen. Von den 42 Lokalreaktionen war eine mild, 13 hatten ein moderates und 27 schweres Ausmaß. Die übrigen drei UAW in der Helixor®-Gruppe waren systemisch. Eine davon war eine Rhinokonjunktivitis auf einem Auge, woraufhin die Patientin die Einwilligung zur Studienteilnahme zurückgezogen hatte. Von den anderen beiden UAW wurde in der Publikation nur berichtet, dass kein Zusammenhang zur Misteltherapie bestünde.
Die nicht-randomisierten Studien berichten Folgendes zu den UAW der Misteltherapie:
In der Studie von Bock et al. (2004)145, 146 führen die Studienärzte sowohl systemische Reaktionen bei sechs Patientinnen (0,8 %), wie Schwäche, Hyperaktivität, Unwohlsein, Magen-Darm-Beschwerden und die Vergrößerung eines topischen Ekzems, als auch lokale Reaktionen bei 123 Patientinnen (17,3 %) auf die Misteltherapie zurück. Zu den lokalen Reaktionen zählen Verhärtungen, Erytheme, Entzündungen oder Ödeme. Alle Reaktionen wurden mit Schweregrad eins bis zwei bewertet: Grad eins trat bei 12,3 % aller Patientinnen mit Misteltherapie und Grad 2 bei 5 % aller Patientinnen mit Misteltherapie auf.
Bei Eisenbraun et al. (2011)147 hatten 235 Patientinnen (86,7 %) lokale Reaktionen. Von den behandelnden Ärzten wurden folgende systemische Reaktionen berichtet: 89 Fälle mit Abgeschlagenheit (33 %), bei 65 Kopfschmerzen (24,1 %), bei 51 Unwohlsein (18,9 %) und bei je einer Patientin trat Schwindel und Dermatitis auf. Alle systemischen Reaktionen waren mild (Grad 1)147. Ob bei den systemischen Nebenwirkungen, die vom behandelnden Fachpersonal erhoben wurden, Mehrfachnennungen möglich waren, ist nicht berichtet.
Loewe-Mesch et al. (2008) bemerken, dass die Anzahl der lokalen Reaktionen – vor allem in der Aufdosierungsphase – höher ist als erwartet. Bereits vor Beginn der Chemotherapie litten 64 % der Patientinnen an lokalen Reaktionen. Ab dem Beginn der Chemotherapie waren 94 % der Patientinnen betroffen.
In der Studie von Schumacher et al. (2002 und 2003)129, 149 kam es bei 28 von 219 Patientinnen (12,8 %) zu Nebenwirkungen, die mit der Misteltherapie in Zusammenhang stehen. Zehn der Reaktionen waren Lokalreaktionen mit leichter oder moderater Ausprägung (Grad 1 bis 2). Zwölf Patientinnen litten an einer Rötung, einem Erythem oder einer Quaddel, die als Hautreaktionen zusammengefasst wurden. Sechs Patientinnen hatten systemische Reaktionen mit leichter oder moderater Ausprägung (Grad 1 bis 2): zwei allergische Reaktionen, zwei Juckreiz, eine Schmerzen und eine Fieber.
Tabelle 52 zeigt die Behandlung der UAW und mögliche Studienabbrüche aufgrund der Misteltherapie. Studienabbrüche aufgrund schwerer UAW der Chemotherapie, für die in Tabelle 51 beschrieben ist, dass der Zusammenhang zur Misteltherapie unwahrscheinlich ist, sind in Tabelle 52 nicht erfasst.
Tabelle 52: Ergebnistabelle Behandlung der unerwünschten Arzneimittelwirkungen (UAW) der Misteltherapie (MT)
|
Behandlung der UAW Anzahl (%) |
Dosisanpassung Anzahl (%) |
Studienabbruch wegen UAW der MT Anzahl(%) |
|
|
RCT |
|||
|
Semiglazov (2004) |
Für alle lokalen Reaktionen Spontanheilung ohne Behandlung 39 (100) |
0 (0) |
2(3,1) (laut Autoren kein Zusammenhang zur MT) |
|
Semiglazov (2006) |
Für alle lokalen Reaktionen Spontanheilung ohne Behandlung 31 (100) |
0 (0) |
1 (1,2) (laut Autoren kein Zusammenhang zur MT) |
|
Tröger (2009), (2014) |
Bei lokalen Reaktionen > 5 cm kurzfristige Unterbrechung; lokale Maßnahmen (Salben) oder Dosisanpassung; Zahlen n. b. |
n. b. |
IMS: 0 (0) HXA: 1 (3,4) |
|
Nicht-randomisierte Studien |
|||
|
Bock (2004a), (2004b) |
Spontanheilung ohne Behandlung bei 87 (71) der leichten und mittleren Lokalreaktionen; sonst n. b. |
7 (1) (bei lokalen Reaktionen mit Grad 2) |
4 (0,7) |
|
Eisenbraun (2011) |
Spontanheilung bei 32 (76,3), nur 2 (4,1) hatten mehr als zwei Tage Symptome; sonst n. b. |
n. b. |
17 (6,3) |
|
Loewe-Mesch (2008), von Hagens (2005) |
Herabsetzen der Dosis 19 (58) oder kurzfristige Unterbrechung der Mistelinjektionen 10 (30) |
19 (58) |
0 |
|
Schumacher (2002), (2003) |
Abwarten, lokale Maßnahmen (Salben) oder Dosisanpassung: Zahlen n. b. |
n. b. |
3 (1,4); je 1 wegen: Juckreiz, Allergie und Schmerzen |
HXA = Helixor® A. IMS = Iscador®. MT = Misteltherapie. n. b. = Nicht beschrieben. RCT = Randomisierte kontrollierte Studie. UAW = Unerwünschte Arzneimittelwirkung.
In den fünf Studien131, 139, 140, 145–148, die quantitative Angaben zur Behandlung der UAW machten, erfolgte eine Spontanheilung im Median bei 76,3 % mit einer Spannweite von 12 bis 100 %.
In den RCT von Semiglazov et al. (2004 und 2006)139, 140 waren keine Behandlungen der UAW der Misteltherapie notwendig. Wie bereits berichtet, definieren Semiglazov et al., dass nur Lokalreaktionen auf die Misteltherapie zurückzuführen sind. Deswegen entsprechen die Zahlen in der Spalte „Behandlung der UAW‘ der Anzahl der Lokalreaktionen. Da es zu keinen Studienabbrüchen aufgrund der Misteltherapie gekommen ist und keine Interventionen aufgrund von UAW berichtet sind, interpretieren die Autorinnen dieses HTA-Berichts, dass alle Reaktionen mit Bezug zur Misteltherapie spontan wieder abheilten. Eine der beiden Studienabbrecherinnen von Semiglazov et al. (2004)139 in Tabelle 52 ist die Patientin, die eine Enterokolitis erlitt und anschließend an einem toxischen Schock verstarb. Für die andere Patientin, die abgebrochen hat, ist keine Begründung angegeben. In der Studie von Semiglazov et al. (2006)140 hat eine Patientin die Misteltherapie wegen einer allergischen Hautreaktion abgebrochen, die mit der Misteltherapie in Zusammenhang stehen könnte, aber nicht an der Injektionsstelle auftrat.
Tröger et al. (2009 und 2014)141, 143 zählen lokale Reaktionen unter 5 cm Durchmesser nicht als UAW und pausieren grundsätzlich die Aufdosierung der Misteltherapie, wenn es zu Reaktionen von mehr als 5 cm kommt und warten ab, bis die lokale Reaktion wieder abgeklungen ist. Salben oder Ähnliches wurden zur Versorgung der Lokalreaktionen verwendet, aber nicht berichtet wie häufig. Dosisverringerungen und kurzfristige Unterbrechungen sind eingeplant und haben stattgefunden, jedoch sind auch hierzu keine Zahlen berichtet.
In den vier nicht-randomisierten Studien unterschied sich die Behandlung der UAW nicht von den RCT. Sofern eine Behandlung erforderlich war, wurde entweder die Dosis der Mistelextrakte reduziert oder es wurde mit der Fortsetzung der Misteltherapie gewartet, bis die Lokalreaktion abgeklungen war.
Alle UAW der Studie von Bock et al. (2004)145, 146 verheilten spontan nach ein bis zwei Tagen, davon sieben nach einer Dosisanpassung der Mistelinjektionen. Vier Patientinnen (0,7 %) haben die Misteltherapie aufgrund der Nebenwirkungen abgebrochen.
Die systemischen Reaktionen bei Eisenbraun et al. (2011)147 dauerten im Schnitt ein bis zwei Tage bis sie verheilt waren. Länger als zwei Tage dauerten die Beschwerden nur bei 4,1 % der Patientinnen. Bei 17 Patientinnen (6,3 %) kam es zu einem Studienabbruch. Grund hierfür waren vor allem die regelmäßigen unangenehmen Injektionen. In einer Befragung gaben 8,5 % der Patientinnen an, Einschränkungen durch die Misteltherapie gehabt zu haben.
Loewe-Mesch et al. (2008) sahen einen Zusammenhang zwischen den sehr häufigen lokalen Reaktionen (bei 94 %) zum kurzen Abstand zwischen Operation und Start der Misteltherapie (zwei bis vier Tage) sowie zum Therapieplan der Studie, der in der Anfangsphase tägliche Injektionen vorsieht. Die vom Hersteller empfohlene Erhaltungsdosis von einer ganzen Ampulle hielten die durchführenden Ärzte bei einer kurzen Zeitspanne zwischen Beginn der Misteltherapie und Beginn der Chemotherapie für zu hoch und verwendeten daher die halbe Dosis. Bei 58 % der lokalen Reaktionen wurde die Dosis angepasst, bei 30 % wurde die Misteltherapie so lange unterbrochen bis die Reaktionen wieder abgeklungen waren. Systemische und schwere Nebenwirkungen traten nicht auf.
Die sechs lokalen Reaktionen in der Studie von Schumacher et al. (2002 und 2003)129, 149 wurden mit Salben behandelt oder heilten spontan nach drei bis vier Tagen. In manchen Fällen wurde die Dosis angepasst (Anzahl nicht berichtet). Die durchschnittliche Dauer, bis die Reaktionen wieder verschwunden waren, betrug 3,5 Tage. Drei Patientinnen brachen die Therapie wegen Juckreiz beziehungsweise Schmerz oder Allergie ab.
Beschreibung der Verträglichkeit insgesamt
Sechs Publikationen129, 131, 139, 140, 145–149 enthalten eine Bewertung der Autoren zur Verträglichkeit der Misteltherapie insgesamt. In Tabelle 53 sind die Aussagen aus den Publikationen zur Verträglichkeit zusammengefasst. Die Publikationen von Tröger et al. 2009 und 2014141, 143 beinhalten keine Aussagen zur Verträglichkeit, deshalb wurden Aussagen zur Sicherheit der Misteltherapie aus den Publikationen zusammengestellt.
|
Tabelle 53: Bewertung der Verträglichkeit der Misteltherapie |
||
|
Studie |
Perspektive |
Bewertung der Verträglichkeit der Misteltherapie mit Begründung |
|
RCT |
||
|
Semiglazov (2004) |
Studienärzte |
Verträglichkeit wird als gut bewertet; Begründung:
|
|
Semiglazov (2006) |
Studienärzte |
Verträglichkeit und Sicherheit wird als gut bewertet; Begründung:
|
|
Tröger (2009), (2014) |
HTA-Autoren |
Keine konkrete Bewertung der Verträglichkeit insgesamt, aber anhand der Zahlen zu den UAW der Misteltherapie wird die Einschätzung der Studienärzte als gut interpretiert; Begründung:
|
|
Nicht-randomisierte Studien |
||
|
Bock (2004a), (2004b) |
Studienärzte |
Wird als sicher bewertet; Begründung: Mistelextrakte wurden sehr gut toleriert bei 78,9 % der Patientinnen, es gab keine schweren oder lebensbedrohlichen UAW, auch keine schweren allergischen Reaktionen Inzidenz der systemischen Reaktionen ist vergleichbar mit anderen Publikationen (Gorter et al. 1999, Huber et al. 2001, van Wely 1999, Wetzel 2000) Die Sensitivitätsanalyse durch den Vergleich der Ergebnisse mit der ITT- und der PP-Population zeigt, dass die Ergebnisse zur Sicherheit nicht verzerrt sind |
|
Eisenbraun (2011) |
Studienärzte |
Die Verträglichkeit wird als gut oder sehr gut für 91 % der Patientinnen (keine weitere Begründung beschrieben) |
|
Patientinnen |
Wird von Patientinnen als wirksam und empfehlenswert bewertet, konkrete Aussagen zur Sicherheit sind nicht berichtet; Begründung:
Misteltherapie als gut oder exzellent
anderen Patientinnen empfehlen, 19,3 % würden die Misteltherapie vielleicht weiterempfehlen, 7 % nur bei besonderen Bedingungen und 4,8 % waren indifferent
|
|
|
Loewe-Mesch (2008), von Hagens (2005) |
Studienärzte |
Insgesamt gute Verträglichkeit bei einer reduzierten Dosis von 2,5 mg Begründung: Die Lokalreaktionen konnten auf tolerables Maß reduziert werden Kein Wunsch nach Therapieabbruch Weniger Allgemeinreaktionen in der Gruppe mit Misteltherapie als in der Kontrollgruppe |
|
Schumacher (2002), (2003) |
Studienärzte |
Gesamturteil der Ärztin oder des Arztes zur Wirksamkeit bei 69,8 % sehr gut, Begründung: Keine schweren oder lebensbedrohlichen UAW Mann-Whitney-Kennwert = 0,82 (0,78–0,86); p < 0,0001 |
|
Patientinnen |
94,5 % der Patientinnen bewerten die Verträglichkeit der Misteltherapie als sehr gut oder gut. |
|
HTA = Health Technology Assessment. ITT = Intention-to-treat. PP = Per protocol. RCT = Randomisierte kontrollierte Studie. UAW = Unerwünschte Arzneimittelwirkung.
Für einen Therapieabbruch (Zahlen sind in Tabelle 52 berichtet) lag der Median bei 1,3 % (Spannweite: 0 bis 6,3 %). Außer lokalen Reaktionen, die durch die Injektion der Mistelextrakte ausgelöst wurden, traten keine klinisch relevanten Unterschiede bei den UAW oder sicherheitsrelevanten Laborparametern zwischen Interventions- und Kontrollgruppe auf. 28 der lokalen Reaktionen waren Anlass für einen Studienabbruch, davon 25 mit Bezug zur Misteltherapie. Die Verträglichkeit der Misteltherapie ist
studienübergreifend insgesamt, sowohl von behandelnden Personen als auch von Patientinnen, als sehr gut oder gut bewertet worden (siehe Tabelle 131).
In Bock et al. (2004a und 2004b)145, 146 bewerten die behandelnden Ärzte die Sicherheit allgemein mit „sehr gut“ für 78,9 % der Patientinnen. Bei Eisenbraun et al. (2011)147 geben sowohl die behandelnden Personen als auch die Patientinnen eine Bewertung ab. 91,1 % der Patientinnen mit Misteltherapie bewerten die integrative Misteltherapie als gut oder sehr gut verträglich. Behandelnde sind der Meinung, dass die Misteltherapie für 88,2 % desselben Patientinnenkollektivs sehr gut verträglich war. Bei Loewe-Mesch et al. (2008)148 bewerteten die Autoren die Verträglichkeit und argumentierten, dass sie die Verträglichkeit insgesamt als gut bewerteten, weil lokale Reaktionen gut kontrolliert werden konnten und die Häufigkeit von Allgemeinreaktionen in der Mistel- geringer war als in der Kontrollgruppe. Bei Schumacher et al. (2002 und 2003)129, 149 bewerteten die Patientinnen selbst. 94,5 % der Patientinnen waren der Meinung, dass die Mistelextrakte „sehr gut“ oder „gut“ verträglich seien. Semiglazov et al. (2004)139 sahen die lokalen Reaktionen an der Einstichstelle als dosisabhängig und bewerteten diese bei der niedrigen und mittleren Dosis als leichte und moderate UAW und damit die Verträglichkeit als gut. Semiglazov et al. (2006)140 schätzten die Verträglichkeit der Mistelextrakte insgesamt als gut ein, aber betonten das Auftreten von lokalen Reaktionen bei 17,6 % der Patientinnen.
Gegenstand dieser Domäne sind die Kosten und Kosteneffektivität der integrativen Misteltherapie bei Patientinnen mit Brustkrebs. Die eingeschlossene Kostenstudie von Schöffski et al. (2009)152 wird narrativ beschrieben.
Die Darstellung der Ergebnisse orientiert sich an der „Dokumentationsstruktur für die standardisierte Berichterstattung von gesundheitsökonomischen Primärstudien und Synthesen von Primärstudien”, erstellt von der „German Scientific Working Group Technology Assessment for Health Care“ (siehe Tabelle 108 im Anhang).96 Da in der Kostenstudie keine Gesundheitseffekte untersucht und berichtet werden, entfällt dieser Punkt in der Darstellung.
Die Kostenanalyse aus gesellschaftlicher (volkswirtschaftlicher) Perspektive hat zum Ziel, mögliche Unterschiede und Veränderungen der entstehenden Nachsorgetherapiekosten zwischen den Patientinnen mit und ohne begleitende Misteltherapie zu identifizieren. Der Zeithorizont beträgt fünf Jahre. Der Fünf-Jahres-Nachsorgezeitraum beginnt ab dem Ende der adjuvanten Therapie.
Die dreiarmige Kostenanalyse vergleicht drei Gruppen mit Patientinnen mit Brustkrebs, von denen die erste im gesamten Nachsorgezeitraum eine Intervention mit dem Mistelpräparat Helixor® erhalten hat, die zweite Gruppe hat keine Mistelinjektionen erhalten und in der dritten Gruppe sind die sogenannten „Wechsler“. Die „Wechsler“ haben anfangs Helixor® erhalten, aber die Misteltherapie während des FünfJahres-Beobachtungszeitraums beendet und wurden ab dem Zeitpunkt, an dem sie abgebrochen hatten, wie die Kontrollgruppe behandelt.
Aus der volkswirtschaftlichen Perspektive wird über einen Fünf-Jahres-Horizont eine vergleichende Kostenanalyse durchgeführt, die auf den Ergebnissen einer Kohortenstudie basiert. Die zugrundeliegende multizentrische, retrospektive Kohortenstudie128 untersuchte die Wirksamkeit und Sicherheit der komplementären Misteltherapie bei Patientinnen mit Brustkrebs während der routinemäßigen Nachsorge in 53 zufällig ausgewählten Krankenhäusern und Arztpraxen. Es handelt sich dementsprechend um eine Kostenanalyse im Rahmen einer Primärstudie.
Insgesamt wurden die Akten von 761 Patientinnen mit primärem Brustkrebs durchgesehen, die zwischen dem 1. Januar 1990 und dem 31. Dezember 2000 in den Studienzentren behandelt wurden, und überprüft, ob die Anforderungen aus den Ein- und Ausschlusskriterien an die Studienpopulation erfüllt sind. 40 Patientinnen mussten ausgeschlossen werden. Die übrigen 741 Patientinnen konnten in die retrolektive Analyse eingeschlossen werden. 514 Patientinnen waren in der Kontrollgruppe und erhielten keine Mistelpräparate, 167 Patientinnen erhielten während der Nachsorge den Mistelextrakt Helixor® und eine dritte Gruppe mit 60 Patientinnen wechselte während der Nachsorge von der Interventions- in die Kontrollgruppe. Die Wechslergruppe wurde für die Bewertung der medizinischen Wirksamkeit aus‑, aber für die Kostenanalyse eingeschlossen.
Die Studienpopulation besteht aus Patientinnen mit der primären Diagnose Brustkrebs, die in den ausgewählten Studienzentren zwischen dem 1. Januar 1990 und dem 31. Dezember 2000 behandelt wurden und sowohl eine vollständige operative Entfernung des Tumorgewebes (R0-Resektion) als auch eine postoperative adjuvante Chemotherapie und/oder Bestrahlung erhalten haben. Das Erkrankungsstadium musste zum Zeitpunkt der Diagnose zwischen UICC-Level I und III b liegen, das heißt, es wurden ausschließlich Patientinnen ohne Fernmetastasen eingeschlossen. Ausführlichere Beschreibungen zur UICC-Klassifizierung sind in Tabelle 1 beschrieben. Nur Patientinnen, die auch während der adjuvanten Therapie rezidiv- beziehungsweise metastasenfrei geblieben sind und bei denen nach Abschluss der adjuvanten Therapie keine Evidenz mehr für eine Erkrankung – auch keine Sekundärerkrankung – vorliegt, konnten eingeschlossen werden.
Weitere Einschlusskriterien für die Kohortenstudie waren, dass die Dokumentationen der Histologie, der Operationsbefunde sowie der relevanten Behandlungs- und Verlaufsdaten der adjuvanten Therapie und Nachsorge für einen Zeitraum von mindestens sechs Monaten vorliegen. Wenn ein Mistelpräparat verwendet wurde, durfte dies ausschließlich Helixor® sein.
Patientinnen wurden aus der Analyse ausgeschlossen sobald mindestens eines der Einschlusskriterien nicht erfüllt war oder aus einem der weiteren fünf Ausschlussgründe:
-
1. Dokumentation der Histologie, adjuvanten Therapie und Nachsorge hatten Mängel
-
2. Zweittumor lag vor
-
3. Verwendung anderer Mistelprodukte als Helixor®
-
4. Rezidive oder Metastasen wurden während der adjuvanten Therapie oder vor Beginn der Helixor®-Therapie diagnostiziert
-
5. Die Patientin hat Zytokin-Infusionen erhalten
Da die Wechslergruppe in der Kohortenstudie128 nicht analysiert und berichtet wurde und die Publikation zur Kostenanalyse152 keine Charakteristika zur Studienpopulation beinhaltet, können nur Interventionsund Kontrollgruppe anhand der demografischen Charakteristika verglichen werden.
Bezogen auf Alter, Größe und Gewicht sind die Interventions- und Kontrollgruppe vergleichbar. Das Alter liegt bei durchschnittlich 55,11 Jahren (SD: 9,61) in der Mistel- und bei 54,63 Jahren (SD: 10,16) in der Kontrollgruppe. Die Patientinnen in der Mistelgruppe waren im Schnitt 167,75 cm (SD: 6,67) groß und 70,69 kg (SD: 9,5) schwer. Die Kontrollgruppe war mit 163,42 cm (SD: 6,7) etwas kleiner und mit 71,62 kg (SD: 13,92) etwas schwerer. Der Schweregrad der Erkrankung nach UICC-Level ist in der Mistelgruppe statistisch signifikant höher. Auch die Beobachtungsdauer ist in der Mistel- mit durchschnittlich 4,5 Jahren deutlich länger im Vergleich zu 3,0 Jahren bei der Kontrollgruppe. Für die Wechslergruppe ist die Beobachtungsdauer nicht bekannt. Die Gründe hierfür sind unklar. Weitere Ausführungen hierzu sind in Abschnitt 5.2.5 dargestellt.
In der der vergleichenden Kostenanalyse zugrundeliegenden Kohortenstudie128 ist die beobachtete Intervention eine Misteltherapie mit Helixor® M, A oder P (Herstellerin: Helixor® Heilmittel GmbH & Co. KG) während des Beobachtungszeitsraums. Der Beobachtungszeitraum der Studie beginnt erst mit dem Ende der adjuvanten Chemo- und/oder Bestrahlungstherapie.
Eine Operation mit anschließender adjuvanter Chemo- oder Bestrahlungstherapie vor Studienbeginn, sowie eine schulmedizinische Standardtherapie in der Nachsorgephase, z. B. mit einer Hormontherapie, erhalten alle Patientinnen. Die Wirkstoffe der verwendeten Standardtherapien waren unter anderem: Goserelinacetat, Leuprorelin, Tamoxifen, Toremifen, Formestan, Letrozol, Anastrozol, Exemestan, Medroxyprogesteronacetat und Megestrolacetat. In wenigen Fällen kam es während der Nachsorge zu einem Rückfall oder Metastasen: in der Mistelgruppe sechs Rückfälle und sechs Metastasen (jeweils 3,6 % von 167 Patientinnen) und in der Kontrollgruppe 15 Rückfälle (2,9 % von 514 Patientinnen) und 22 Metastasen (4,3 % von 524 Patientinnen). Wenn Patientinnen auch im Beobachtungszeitraum noch eine Operation, Bestrahlung oder Chemotherapie benötigten, haben sie diese erhalten. Fünf (3 %) aus der Mistelgruppe und 13 (2,5 %) aus der Kontrollgruppe erhielten eine Operation. Tabelle 55 fasst die verwendeten Therapieformen in der Beobachtungsphase zusammen.
Tabelle 54: Ereignisse und Therapieformen während der Nachsorgephase
|
Mistelgruppe |
Kontrollgruppe |
Wechsler |
|
|
Anzahl (% |
Anzahl (%) |
Anzahl (%) |
|
|
Rezidiv |
6 (3,6) |
15 (2,9) |
n. b. |
|
Metastasen |
6 (3,6) |
22 (4,3) |
n. b. |
|
Chemotherapie |
4 (2,4) |
14 (2.7) |
n. b. |
|
Bestrahlung |
5 (3,0) |
14 (2.7) |
n. b. |
|
Operation |
5 (3,0) |
13 (2,5) |
n. b. |
|
Hormontherapie |
120 (71,9) |
248 (48,2) |
n. b. |
n. b. = Nicht beschrieben.
Die Anteile der Gruppen, die eine Operation, Bestrahlung oder Chemotherapie erhalten haben, sind vergleichbar zwischen den Gruppen. Bei der Hormontherapie ist der Unterschied zwischen der Mistel-mit 71,9 % und der Kontrollgruppe mit 48,2 % deutlich.
Untersuchte Zielgröße der vergleichenden Kostenstudie ist die Veränderung des Ressourcenverbrauchs in Form von stationären und ambulanten Kosten sowie volkswirtschaftlichem Produktivitätsverlust. Die Erhebung der Daten erfolgte über Erfassungsbögen, in denen neben Informationen zur Therapie auch Angaben zur Arbeitsunfähigkeit dokumentiert wurden.
In die Berechnung der Fünf-Jahres-Gesamtkosten fließen folgende Bereiche ein: Helixor®-Therapie, Zusatzmedikation, Hormontherapie, psychoonkologische Behandlung, Chemotherapie, Strahlentherapie, Leistungen nach dem Einheitlichen Bewertungsmaßstab (EBM) der GKV, sonstige verordnete Leistungen, privat finanzierte Maßnahmen, der stationäre Aufenthalt und der volkswirtschaftliche Produktivitätsverlust.
Insbesondere für die Misteltherapie mit Helixor® ist detailliert beschrieben, wie sich die Kalkulation der Ressourcenverbräuche zusammensetzt. Häufigkeit und Kosten der Injektionen wurden in der Studie nicht direkt gemessen, sondern anhand bestimmter Angaben aus den Patientientinnenakten abgeschätzt. Der folgende Ansatz gilt für alle Therapiearten: „(Beginn (Applikationszeitraum)-Ende (Applikationszeitraum) – Pause) * Injektionsfrequenz“152. Die Zahlen für die Häufigkeit ergeben sich jeweils aus dem Applikationszeitraum laut Erfassungsbogen und der angenommenen Injektionsfrequenz, die sich aus den Empfehlungen aus der aktuellen Literatur ergeben. Generell basieren die Angaben zu Mindestverbräuchen je Therapieform, zum Beispiel Hormontherapie, auf dem Wirkstoff und den aus der Literatur ableitbaren Angaben zur Dosis und Verordnungshäufigkeit. Für jede Therapieform wurden auf Grundlage von Leitlinien oder sonstiger Therapieempfehlungen Standardtherapien für verschiedene Wirkstoffe definiert, die Informationen zur Dosis, Anzahl der Injektionen und Behandlungsdauer lieferten. Daraus wurde der Standard-Ressourcenverbrauch ermittelt, sofern dieser nicht genauer im Erfassungsbogen dokumentiert ist. Wenn dem Erfassungsbogen eine kürzere oder längere Anwendungsdauer entnommen werden konnte, wurde die tatsächliche Dosis gegenüber dem Standardverbrauch korrigiert. Unterbrechungen wurden abgezogen, sofern diese dokumentiert waren. Bei der Berechnung des Standardverbrauchs der Chemotherapie wird eine durchschnittliche Körperoberfläche von circa 1,8 m2 angenommen.
Informationen zu Pflegekosten und Kosten für stationär erbrachte Rehabilitationsleistungen wurden nicht erfasst und konnten laut den Autoren somit nur in einem sehr geringen Anteil in die Auswertung einfließen, jedoch ist nicht bekannt, in wie weit.128 Berichtet ist nur, dass für stationäre Leistungen die Kosten anhand tagesgleicher Pflegesätze berechnet wurden, da es noch keine diagnosebezogenen Fallgruppen (DRG-System) gab. Diese Pflegesätze wurden nicht näher beschrieben. Für Zeiten, in denen die Patientin arbeitsunfähig war, wurde anhand des Friktionskostenansatzes (beschränkt auf 90 Tage), ein volkswirtschaftlicher Produktivitätsverlust geschätzt. Für ambulante Leistungen (Zusatzmedikation, psychoonkologische Behandlung, EBM-Leistungsziffern, sonstige verordnete Leistungen und privat finanzierte Maßnahmen) wurden die Kosten ermittelt, jedoch ist nicht berichtet, auf welcher Grundlage. Insgesamt basieren die Mengengerüste hauptsächlich auf Annahmen und sind nicht für alle Kosten dargestellt.
Das Mengengerüst jeder Standardtherapie wurde monetär bewertet. Die Preise sind, soweit verfügbar, der Roten Liste 2005284 entnommen. Je nach Therapie und Vollständigkeit der Dokumentation werden die Preise taggenau – wie bei der Misteltherapie – oder nach der verfügbaren Packungsgröße berechnet. Sofern die genauen Daten für Beginn und Ende einer Therapie angegeben sind, wird taggenau verrechnet und wenn eine Dauer geschätzt wird, wird eine durchschnittliche Dauer angenommen. Der Preis für eine Standardtherapie wird auf Grundlage des definierten Mengengerüsts für die Verordnung und der gewählten Abrechnungsgrundlage (taggenau oder nach Packungsgröße) mit dem Preis aus der Roten Liste berechnet. Beispielhaft werden Berechnungsbeispiele für die Hormontherapie mit Tamoxifen, die Misteltherapie mit Helixor® und die Chemotherapie mit Paclitaxel im Detail beschrieben.
Die Misteltherapie wird taggenau verrechnet. Das heißt, es wurde unabhängig von der Packungsgröße nur der tatsächliche Verbrauch berechnet und nicht die gesamte Medikamentenpackung. Bei der Misteltherapie gibt es zwei verschiedene Preiskategorien, die abhängig sind von der Wirkstoffdosis. Bis zu einer Konzentration von 20 mg ergibt sich ein Marktpreis von 5,86 Euro je Ampulle (46,84 Euro, je Packung) laut Roter Liste 200537. Ab einer Konzentration von 100 mg beträgt der Preis je Ampulle 8,48 Euro.
Für Tamoxifen ist ebenfalls ein Beispiel angegeben, wie die Therapiekosten für eine Standardtherapie von vier Monaten geschätzt werden. Eine Packung mit 100 Tabletten (20 mg) für drei Monate kostet 53,44 Euro und eine weitere Ein-Monats-Packung zusätzliche 25,96 Euro. Addiert ergeben sich Gesamtkosten in Höhe von 79,40 Euro.152
Bei der Abschätzung der monetären Bewertung des Mengengerüsts des verwendeten Medikaments wird bei der Chemotherapie auch auf Informationen aus dem Arzneiverordnungs-Report zurückgegriffen, um den am häufigsten verwendeten Wirkstoff zu finden.
Alle verwendeten Preise sind in Euro angegeben. Die Inflation wurde nicht berücksichtigt.
Eine Diskontierung wurde nicht durchgeführt.
Gesundheitseffekte werden im Rahmen der Publikation von Schöffski und Emmert (2009)152 nicht bewertet, sondern ausschließlich Kosten.
Die ermittelten Kosten werden in Form der durchschnittlichen Gesamtkosten für fünf Jahre berechnet und getrennt nach Interventions- (4.504,32 Euro), Kontrollgruppe (9.995,88 Euro) und Wechslern, die zeitweise Mistelpräparate erhalten (6.843,91 Euro), berichtet.
Die Darstellung in Tabelle 54 ist aus der Publikation von Schöffski und Emmert übernommen.152 Die Pro-Kopf-Kosten für einen Fünf-Jahres-Beobachtungszeitraum werden unterteilt nach ambulanten und stationären Kosten, einmal mit volkswirtschaftlichen Kosten und einmal ohne.
Tabelle 55: Gesamte Fünf-Jahres-Kosten je Patientin für die Behandlung von Brustkrebs, mit und ohne Produktivitätsverlust, gemäß den Tabellen 5 und 6 aus der Publikation von Schöffski et al.152
|
Kosten pro Patient in Euro |
|||
|
Verumgruppe |
Kontrollgruppe |
Wechslergruppe |
|
|
Helixor®-Therapie |
1.157,92 |
0,00 |
739,85 |
|
Zusatzmedikation |
473,04 |
352,01 |
1.628,87 |
|
Hormontherapie |
1.216,46 |
777,34 |
941,11 |
|
Psychoonkologische Behandlung |
56,11 |
24,17 |
15,20 |
|
Chemotherapie |
131,44 |
257,34 |
246,68 |
|
Strahlentherapie |
84,92 |
71,93 |
50,00 |
|
Leistungen nach EBM |
107,30 |
14,22 |
76,67 |
|
Sonstige verordnete Leistungen |
0,00 |
12,54 |
2,07 |
|
Privat finanzierte Maßnahmen |
0,18 |
0,00 |
0,87 |
|
Inklusive Produktivitätsverlust |
|||
|
Ambulante Kosten (gesamt) |
3.227,37 |
1.509,55 |
3.701,32 |
|
Stationäre Kosten |
990,40 |
6.008,26 |
2.920,79 |
|
Volkswirtschaftlicher Produktivitätsverlust |
286,55 |
2.478,07 |
221,80 |
|
Gesamt |
4.504,32 |
9.995,88 |
6.843,91 |
|
Ohne Produktivitätsverlust |
|||
|
Ambulante Kosten |
3.227,37 |
1.509,55 |
3.701,32 |
|
Stationäre Kosten |
990,40 |
6.008,26 |
2.920, 79 |
|
Gesamt |
4.217,77 |
7.517,81 |
6.622,11 |
EBM = Einheitlicher Bewertungsmaßstab.
Eine Synthese von Kosten und Effekten ist nicht relevant für die vorliegende Studie, da keine Effekte bewertet wurden.
In der Studie152 sind keine Tests zur statistischen Unsicherheit in der Kostenanalyse berichtet128. Für Confounding wurde nicht kontrolliert. Weitere Ausführungen zur Wahrscheinlichkeit möglicher Zufallsoder systematischer Fehler sind in Abschnitt 5.2.9 berichtet.
Die Mengen- und Preisgerüste, die der Kostenanalyse zugrunde liegen, basieren auf einigen Annahmen. Nach Angaben der Autoren liegen dadurch einige Limitationen für die Kostenanalyse vor:
-
1. Vor der Nachsorge angefallene Kosten wurden nicht berücksichtigt.
-
2. Pharmaökonomische Gesichtspunkte wurden in den Erfassungsbögen teilweise nicht präzise genug erfasst. Ein Beispiel dazu: für psychoonkologische Behandlung wurde lediglich der gesamte Behandlungszeitraum dokumentiert, nicht die Häufigkeit beziehungsweise die Anzahl der Behandlungen.
-
3. Eine Diskontierung der Kostenströme war nicht möglich, da einige Ressourcenverbräuche (EBM-Leistungen, Arbeitsunfähigkeitstage etc.) lediglich als Gesamtgröße abgefragt wurden und eine Zuordnung zu bestimmten Jahren nicht möglich war.
-
4. Rehabilitationskosten wurden nur in sehr geringem Umfang in die Kostenanalyse einbezogen, vor allem deswegen, weil Rehabilitationskosten nicht explizit dokumentiert wurden und deswegen nicht vorliegen.
-
5. Die Erfassung der Ressourcenverbräuche mit zwei nicht-identischen Erfassungsbögen sorgte für viele fehlende Werte, die nach Möglichkeit über geschätzte Werte, zum Beispiel durch Mittelwerte, ergänzt wurden. Wenn keine Schätzung möglich war, blieben die Kosten unberücksichtigt.
-
6. Die Qualität der Daten ist beeinflusst durch einige unvollständige Datensätze. Um die Daten dennoch für die Analyse nutzbar zu machen, wurden möglichst plausible Annahmen gemacht, zum Beispiel Standardtherapien, oder Nicht-Berücksichtigung. Dadurch könnte der Datensatz systematisch verzerrt worden sein.
-
7. Aussagen zu lebenslang anfallenden Kosten nach einem Mammakarzinom sind durch diese Untersuchung nicht möglich, da der Beobachtungszeitraum nur fünf Jahre betrug. Die Kontrollgruppe wurde im Schnitt nur 3,5 Jahre nachbeobachtet.
-
8. Aussagen zu soziodemografischen Unterschieden zwischen den Gruppen sind nicht möglich, da diese nicht in der Erhebung berücksichtigt wurden.
In der kritischen Beurteilung der Ergebnisse durch die Autoren der Studie wird ergänzt, dass sich möglicherweise auch Ungenauigkeiten bei der Dokumentation nicht in allen Gruppen gleich ausgewirkt haben. Auch Confounding durch Gruppenunterschiede, die nicht gleichmäßig verteilt wurden, sei mit hoher Wahrscheinlichkeit ein Grund dafür, dass das Ergebnis so deutlich für die Misteltherapie ausfalle. Da in der Kohortenstudie keine Randomisierung stattgefunden hat und nicht für Confounder kontrolliert wurde, ist dieser Bias sehr wahrscheinlich. Zum Unterschied zwischen den Gruppen könnte auch eine unterschiedliche Einstellung gegenüber komplementärer Medizin beigetragen haben.
Die Generalisierbarkeit der Studienergebnisse beschreiben die Autoren der Studie nicht direkt, jedoch werden einige Limitationen genannt, die zum großen Anteil auf Mängel bei der Erfassung der Daten über die Erfassungsbögen zurückgehen. Der große Unterschied zugunsten der Mistelgruppe wurde auch von den Autoren der Studie nicht erwartet.152 Schöffski und Emmert (2009) vergleichen ihre Ergebnisse mit denen der AMOS-Studie285, bei der Krankheitskosten unter anthroposophischer Therapie bei chronischen Erkrankungen erfasst wurden. Ein Abgleich mit den Ergebnissen ähnlicher Studien durch die Autorinnen dieses HTA-Berichts war nicht möglich, da keine weitere Kostenanalyse zur Misteltherapie im deutschsprachigen Raum gefunden wurde.
Die geringere Häufigkeit von Krankenhausaufenthalten ist ausschlaggebend für die Differenz der Kosten zugunsten der Patientinnen mit Misteltherapie. Die Höhe des Unterschieds erscheint unplausibel: „Insgesamt erscheint die ermittelte Kostendifferenz zugunsten der Gruppe mit den Mistelpräparaten von der Höhe her gesehen kaum plausibel und wurde in dieser Höhe im Vorfeld auch nicht erwartet.“152 Aufgrund möglicher systematischer Verzerrungen durch das Studiendesign und der Qualität der Datenerhebung bleibt es unklar, ob der Unterschied der Misteltherapie zugeschrieben werden kann. Die Autoren der Studie sind vorsichtig bei den Schlussfolgerungen und beschränken sich auf die Aussage, dass vermutlich angenommen werden kann, dass die zusätzlichen Kosten für die Misteltherapie über geringere finanzielle Aufwendungen bei stationären und ambulanten Kosten für die Patientinnen kompensiert werden können.
Ähnliche Publikationen wurden nicht gefunden. In Zusammenhang mit der vorliegenden Kostenanalyse steht nur die zugrundeliegende Kohortenstudie von Beuth et al. (2008).128
Die Ergebnisse zur Bewertung des Verzerrungspotenzials nach der „Checkliste zur Bewertung der Qualität gesundheitsökonomischer Studien”, der German Scientific Working Group Technology Assessment for Health Care96, sind in Tabelle 109 zu finden. Von den 56 Fragen der Checkliste erwiesen sich 22 als irrelevant, überwiegend aufgrund dessen, dass Gesundheitseffekte in der Kostenanalyse nicht betrachtet werden. Jede der Fragen kann entweder mit 0, 1/2 oder 1 Punkt bewertet werden, nicht-relevante Fragen ausgenommen. Bei den verbleibenden 34 relevanten Fragen können maximal 34 Punkte erreicht werden. Für die Publikation von Schöffski et al.152 ergibt die Summe 15 von möglichen 34 Punkten (siehe Tabelle 109). In der folgenden Darstellung des Bewertungsergebnisses für die Qualität der Kostenanalyse werden die Ergebnisse der verschiedenen Teilbereiche der Checkliste beschrieben. Auf Fragen, die als nicht relevant für die Kostenanalyse eingestuft wurden, wird nicht eingegangen. Eine Übersicht über alle Bewertungsergebnisse ist in Tabelle 109 zusammengefasst.
Tabelle 56: Ergebnis zur Bewertung Qualität der Fragestellung und der Analysemethoden
Item, Nummer I1 I2 I3 I4 I5 I6 I7 I8 I9 I10
Bewertung_____________1________/ / 1________0 1/2 1________1/2 0 1
I1 Wurde die Fragestellung präzise formuliert?
I2 Wurde der medizinische und ökonomische Problemkontext ausreichend dargestellt?
I3 Wurden alle in die Studie einbezogenen Technologien hinreichend detailliert beschrieben?
I4 Wurden alle im Rahmen der Fragestellung relevanten Technologien verglichen?
I5 Wurde die Auswahl der Vergleichstechnologien schlüssig begründet?
I6 Wurde die Zielpopulation klar beschrieben?
I7 Wurde ein für die Fragestellung angemessener Zeithorizont für Kosten und Gesundheitseffekte gewählt und angegeben?
I8 Wurde der Typ der gesundheitsökonomischen Evaluation explizit genannt?
I9 Wurden sowohl Kosten als auch Gesundheitseffekte untersucht?
I10 Wurde die Perspektive der Untersuchung eindeutig gewählt und explizit genannt?
Fragestellung
Die Fragestellung der Studie ist klar beschrieben. Der medizinische und ökonomische Kontext hätte ausführlicher beschrieben werden können. Zahlen zur Prävalenz und Mortalität von Brustkrebs werden genannt, ebenso wie eine beispielhafte Aufzählung, welche Therapiearten in der Standardtherapie zum Einsatz kommen mit Operation, Chemo‑, Strahlen‑, Immun- und Hormontherapie. Beim ökonomischen Problemkontext fehlen Ausführungen zur Misteltherapie oder woraus sich Herausforderungen bei der Finanzierung von komplementären Verfahren ergeben, die im nicht-palliativen Setting verabreicht werden, da die Finanzierung laut Gesetz nur im palliativen Setting über die Krankenkassen sichergestellt ist.
Evaluationsrahmen
Bezogen auf die Beschreibung der Studienpopulation sind zwar die Mistel- und die Kontrollgruppe klar beschrieben, aber zur Wechslergruppe gibt es fast keine Informationen. Auch die Ein- und Ausschlusskriterien wurden ausführlich beschrieben, aber es wurde keine eindeutige Zielpopulation genannt. Warum die drei Gruppen so gewählt wurden, ist nicht begründet. Die Zielpopulation der Studie sind Patientinnen mit Brustkrebs während der Nachsorge, jedoch fehlt eine Beschreibung der Charakteristika der Patientinnen, um die Übertragbarkeit der Ergebnisse auf den deutschsprachigen Raum beurteilen zu können. Da Patientinnen mit Brustkrebs eine hohe Überlebenswahrscheinlichkeit haben, aber das Risiko eines Rezidivs gegeben ist, wäre grundsätzlich ein lebenslanger Horizont wünschenswert anstatt fünf Jahre. Wenn man keinen lebensverlängernden Effekt der Misteltherapie annimmt, sondern nur eine Lebensqualitätsverbesserung durch Abschwächung der Nebenwirkungen der Therapie, erscheinen fünf Jahre als ausreichend. Der Studientyp „vergleichende Kostenanalyse“ wurde ausschließlich in der Überschrift genannt, aber nicht im Methodenteil begründet. In der Kostenanalyse wurden keine Gesundheitseffekte berichtet und begründet, warum man sich auf eine Kostenanalyse beschränkt, sondern für sämtliche Informationen zur Methodik und den Ergebnissen der zugrundeliegenden Studie von Beuth et al.5 6 7 8 9 10 11 wurde auf die entsprechende Publikation verwiesen. Die volkswirtschaftliche Perspektive der Kostenanalyse ist eindeutig genannt worden.
5. An 9. A Analysemethoden
Adäquate statistische Tests oder Modelle zur Analyse der Daten wurden weder beschrieben noch verwendet. Die Kostendifferenz zwischen den Gruppen ist so ausgeprägt, dass statistische Unsicherheit in diesem Fall vermutlich kein Problem wäre. Jedoch ist eine Verzerrung durch Störgrößen sehr wahrscheinlich, wie die Autoren auch selbst bemerkt haben, trotzdem gibt es in der Studie keinerlei Störgrößenkontrolle. Dies ist der Hauptmangel der Studie (I11).
5.2.9.3 Kosten und Diskontierung
Tabelle 57: Ergebnis zur Bewertung Qualität der Kosten und Diskontierung
Item Nummer_________I22 I23 I24 I25 I26 I27 I28 I30 I31 I32 I34
Bewertung/ / / / 1 1 1 0 0 0 0
5.Er9.E Ergebnispräsentation und Behandlung von Unsicherheiten
Tabelle 58: Ergebnis zur Bewertung Qualität der Ergebnispräsentation und Behandlung von Unsicherheiten
Item, Nummer I36 I40 I41 I47
Bewertung 1ä 1ä 1 0
-
I36 Wurden absolute Gesundheitseffekte und absolute Kosten jeweils pro Kopf bestimmt und dargestellt?
-
I40 Wurden die relevanten Ergebnisse in disaggregierter Form dargestellt?
-
I41 Wurden populationsaggregierte Kosten und Gesundheitseffekte dargestellt?
-
I47 Wurden adäquate statistische Inferenzmethoden (statistische Tests, Konfidenzintervalle) für stochastische Daten eingesetzt und die Ergebnisse berichtet?
Ergebnispräsentation
Die absoluten Kosten, die eine Patientin mit Brustkrebs durchschnittlich pro Kopf in der Kostenanalyse verursacht hat, wurden in der Publikation dargestellt. Eine Unterscheidung wurde nur für die drei Gruppen (Verum‑, Kontroll- und Wechslergruppe) angegeben (siehe Tabelle 55). Wie sich die Kosten für die einzelnen Therapiearten zusammensetzen oder wie hoch der Anteil der Schätzungen je Gruppe ist, ist nicht beschrieben. Für eine einzelne Patientin ist nicht nachvollziehbar, wie hoch die tatsächlichen Kosten waren. Für die Preise wurde weder eine Spannweite noch eine SD berichtet. Die Kosten wurden populationsaggregiert dargestellt als Durchschnittswerte pro Person je Gruppe. Da für die einzelnen Gruppen die Anzahl der Patientinnen genannt ist, könnten auch die Gesamtkosten berechnet werden, die während der Beobachtungsdauer von den Patientinnen in der Studie aufgrund der Brustkrebserkrankung verursacht wurden.
Behandlung von Unsicherheiten
Für die Kostenanalyse sind weder statistische Tests noch KI berichtet.
5.2.9.5 Diskussion und Schlussfolgerungen
Tabelle 59: Ergebnis zur Bewertung Qualität der Diskussion und Schlussfolgerung
Item, Nummer______________I48 I49 I51 I52 I53 I54 I55 I56
Bewertung 1/2 0^ 0 0 0 1/2 1/2
-
I48 Wurde die Datenqualität kritisch beurteilt?
-
I49 Wurden Richtung und Größe des Einflusses unsicherer oder verzerrter Parameterschätzung auf das Ergebnis konsistent diskutiert?
-
I51 Wurden die wesentlichen Einschränkungen und Schwächen der Studie diskutiert?
-
I52 Wurden plausible Angaben zur Generalisierbarkeit der Ergebnisse gemacht?
-
I53 Wurden wichtige ethische und Verteilungsfragen diskutiert?
-
I54 Wurde das Ergebnis sinnvoll im Kontext mit unabhängigen Gesundheitsprogrammen diskutiert?
-
I55 Wurden in konsistenter Weise Schlussfolgerungen aus den berichteten Daten/Ergebnissen abgeleitet?
-
I56 Wurde eine auf Wissensstand und Studienergebnissen basierende Antwort auf die Fragestellung gegeben?
Hauptproblem bei der Studie ist die Verzerrung durch Störgrößen oder Mängel bei der Datenerhebung. Acht Punkte, die von den Autoren der Studie als wahrscheinliche Ursache für das sehr eindeutige Ergebnis zugunsten der Misteltherapie mit Helixor® genannt wurden, sind auch in den Limitationen der Studie in Abschnitt 5.2.7.1 genannt. Zu den möglichen Verzerrungspotenzialen gehören unter anderem der Beobachtungszeitraum, der erst nach der Akutversorgung begonnen hatte und die Datenerhebung, die über zwei verschiedene Erfassungsbögen erfolgte, mehrfach Lücken aufwies oder die gesuchten Größen nur ungenau erhoben hat. Kritisch angemerkt wurde auch die sehr zurückhaltende und schwer nachvollziehbare Einbeziehung von Rehabilitationskosten in die Kostenanalyse. Dieser Umstand ist der fehlenden Dokumentation entsprechender Informationen geschuldet. In der Diskussion fehlt eine Einschätzung der Autoren, wie wahrscheinlich ein Einfluss der einzelnen Verzerrungspotenziale und welches Ausmaß sie besitzen. Insbesondere die Auswirkung der zahlreichen Schätzungen und Annahmen hätte über Angaben von Zahlen transparenter dargestellt werden können. In der Diskussion hätte die Fraglichkeit der Ergebnisse aufgrund der sehr wahrscheinlichen Verzerrung durch Störgrößen noch deutlicher gemacht werden sollen.
Die Ergebnisse der qualitativen Inhaltsanalyse werden in Unterkapiteln zu den einzelnen Zielgrößen in Textform integriert. Zitate und Ankerbeispiele zu den qualitativen Studien230, 233, 236 sind jedoch dem Abschnitt 5.3.7.10 zu entnehmen.
Die Analyse und Synthese zu Patienten- und sozialen Aspekten basiert auf 15 Publikationen62, 65, 230–242. Jede Studie ist in den folgenden Kapiteln einzeln, jeweils getrennt nach Perspektive (Patientin, behandelnde Person) und Studientyp in folgender Reihenfolge beschrieben: quantitative Studien zur Patientinnenperspektive62, 150, 231, 232, 234, 237, 239–242, qualitative Studien zur Patientinnen-perspektive230, 233, 236, quantitative Studien zur Behandelndenperspektive65, 235, 238. Qualitative Studien zur Behandelndenperspektive wurden nicht gefunden. 13 der Publikationen 62,65,231–235,237–242 sind für die Erfassung der Häufigkeit der Inanspruchnahme der Misteltherapie durch Patientinnen mit Brustkrebs geeignet. Davon beinhalten fünf65, 234, 235, 237, 238 auch quantitativ berichtete Ergebnisse zu weiteren Zielgrößen für Patienten- und soziale Aspekte – zwei aus Patientinnen- und drei aus Behandelndenperspektive. Die drei qualitativen Studien230, 233, 236 werden in die qualitative Inhaltsanalyse einbezogen. Angehörige wurden in keiner der Publikationen direkt befragt.
Tabelle 60 bietet einen Gesamtüberblick über alle eingeschlossenen Studien. Mit „Anzahl der Teilnehmenden“ ist die Anzahl der Befragten gemeint. Diese kann sowohl die Anzahl der Patientinnen mit Brustkrebs als auch die Anzahl der ausgewerteten Personen des medizinischen Fachpersonals (primär Ärztinnen und Ärzte) sein. Die Anzahl bezieht sich ausschließlich auf den Teil der Studienpopulation, der für die Auswertung relevant ist. Es sind also keine Patientinnen mit anderen Krebsarten mitgezählt, jedoch sind auch Patientinnen ohne Misteltherapie enthalten. Nach den Einschlusskriterien können nur Studien einbezogen werden, in denen die Ergebnisse für Patientinnen mit Brustkrebs separat berichtet sind oder der Anteil der Patientinnen mit Brustkrebs an der gesamten Studienpopulation bei mindestens 80 % liegt (definiert in Abschnitt 3.3.1). Sofern der Anteil der Patientinnen mit Brustkrebs kleiner als 100 % der Studienpopulation ist, wird in Klammern der prozentuale Anteil der Patientinnen mit Brustkrebs an der Gesamt-Studienpopulation angegeben. Das trifft für Studien zu, bei denen auch Patientinnen und Patienten mit anderen Krebsarten befragt wurden231–233.
Tabelle 60: Studiencharakteristika der Studien zur Bewertung der Patienten- und sozialen Aspekte
|
Studie, Jahr |
Land (Anzahl Studienzentren), Zeitraum |
Studientyp |
Anzahl eingeschlossene Teilnehmenden (% der gesamten Studienpopulation) |
|
Patientinnenperspektive – quantitative Studien |
|||
|
Drozdoff (2018) |
Deutschland (1), September 2014 bis Dezember 2014 und Februar 2017 bis Mai 2017 |
Querschnittstudie |
362 (80,8) |
|
Fasching (2007) |
Deutschland (n. b., aber multizentrisch), Juni 2000 bis Februar 2002 |
Querschnittstudie und qualitative Studie |
796 (77,3) |
|
Fremd (2017) |
Deutschland (36), August 2014 bis November 2015 |
Querschnittstudie |
580 (100) |
|
Hübner (2014) |
Online (1; krebskompass.de), Juni 2011 bis Oktober 2011 |
Querschnittstudie |
80 (100) |
|
Moschen (2001) |
Österreich (1), n. b. |
Querschnittstudie |
117 (100) |
|
Schad (2018) |
Deutschland (1), Januar 2011 bis Juni 2016 |
Querschnittstudie |
741 (100) |
|
Schönekaes (2003) |
Deutschland (3), Januar 2002 bis April 2002 |
Querschnittstudie |
203 (100) |
|
Tautz (2012) |
Deutschland (3), n. b. (drei Monate) |
Querschnittstudie |
170 (+ 12 über Krankenakte) (100) |
|
Templeton (2013) |
Schweiz (1), Oktober 2008 bis September 2010 |
Querschnittstudie |
342 (100) |
|
Patientinnenperspektive – qualitative Studien |
|||
|
Brandenberger (2012) |
Schweiz (1), n. b. |
Qualitative Studie |
4 (100) |
|
Gschwendtner (2016) |
Deutschland (n. b.; flexibel) Oktober 2012 bis April 2013 |
Qualitative Studie |
30 (34) |
|
Konitzer (2001) |
Deutschland (1) n. b. |
Qualitative Studie |
9 (75) |
|
Studien aus der Perspektive des behandelnden Fachpersonals |
|||
|
Kalder (2001) |
Deutschland (3), 1998 bis 1999 |
Querschnittstudie |
348 (100) |
|
Klein (2017) |
Online (1), Juli 2014 bis September 2014 |
Querschnittstudie |
104 (100) |
|
Münstedt (2000) |
Deutschland (2), 1998 |
Querschnittstudie |
202 (100) |
|
n. b. = Nicht beschrieben. |
|||
Die eingeschlossenen quantitativen Studien sind ausschließlich Querschnittstudien aus dem deutschsprachigen Raum, in denen medizinisches Fachpersonal oder Patientinnen einmalig befragt und die Daten über Fragenbögen erhoben wurden. In den beiden qualitativen Studien wurden qualitative Interviews mit Patientinnen geführt. Bezüglich der Benennung der komplementären, unkonventionellen oder integrativen Behandlungsmethode halten sich die Autorinnen dieses HTA-Berichts beim Wiedergeben der Inhalte aus eingeschlossenen Publikationen an die Bezeichnung, die in der jeweiligen Publikation verwendet wird.
Patientinnenperspektive – quantitative Studien
Die Studie von Drozdoff et al. (2018)231 zielt darauf ab, Informationen zur Inanspruchnahme von verschiedenen pflanzlichen KAM-Verfahren zusätzlich zur Standardtherapie bei Patientinnen mit Brustkrebs oder gynäkologischen Krebserkrankungen zu erhalten. Die fragebogenbasierte Querschnittstudie wurde im Klinikum rechts der Isar der Technischen Universität München (TUM) durchgeführt. Alle Patientinnen, die zwischen September und Dezember 2014 oder Februar bis Mai 2017 in die Tagesklinik kamen, wurden gefragt, ob sie zur Teilnahme an der Umfrage bereit wären. Von den 717 Patientinnen, die angesprochen wurden, ob sie an der Studie teilnehmen möchten, haben 448 Patientinnen (62,5 %) den Fragebogen ausgefüllt und konnten ausgewertet werden, darunter 362 Patientinnen mit Brustkrebs (80,8 %). Der vorab getestete und von der Ethikkommission der TUM genehmigte Fragebogen mit acht Items wurde von den Patientinnen selbst ausgefüllt. Die behandelnden Ärzte dokumentierten sowohl die Krebsdiagnose als auch den Krankheitsstatus und die erfolgte Behandlung, um die Angaben der Patientinnen mit der ärztlichen Dokumentation zu vergleichen. Routinemäßig verordnete Präparate wie Vitamin D oder Calcium wurden nicht als komplementäre Verfahren gezählt. Über die beiden Rekrutierungszeiträume im Abstand von zwei Jahren sollten auch zeitliche Trends gefunden werden, falls sich die Nachfrage zu pflanzlichen KAM-Verfahren verändert. Im Rahmen des HTA-Berichts werden die Ergebnisse zur Bewertung der Häufigkeit der Inanspruchnahme von pflanzlichen KAM beziehungsweise der Misteltherapie verwendet. Die Studie von Fasching et al. (2007)232 untersucht den Zusammenhang zwischen der Verwendung von KAM und der Lebenszufriedenheit von Patientinnen mit Brustkrebs und Patientinnen mit bösartigen gynäkologischen Erkrankungen sowie die Inanspruchnahme von KAM innerhalb der verschiedenen Patientinnengruppen. Die Querschnittstudie wurde zwischen Juni 2000 und Februar 2002 an mehreren Standorten im Großraum Düsseldorf in Deutschland durchgeführt. Bei den Studienzentren handelt es sich um auf gynäkologische Onkologie spezialisierte Fachabteilungen, in denen die Teilnehmerinnen rekrutiert wurden. Der Anteil der Patientinnen mit Brustkrebs an der Studienpopulation liegt mit 796 Teilnehmerinnen von insgesamt 1.030 Befragten bei 77,3 %. Das entspricht annähernd den geforderten 80 % für den Einschluss der Studie in die Analyse und Synthese der Ergebnisse. Da der Anteil der Patientinnen mit Brustkrebs mit Misteltherapie nur bei 74,4 % liegt, werden von den Ergebnissen aus der Studie von Fasching et al. (2007)232 nur die Zahlen zur Inanspruchnahme der Misteltherapie verwendet. Die beiden Gruppen – Verwenderinnen von KAM und Patientinnen ohne komplementäre Maßnahmen – wurden auf Unterschiede bei den soziodemografischen Merkmalen verglichen.
Das Ziel der Studie von Fremd et al. (2007)62 ist, das Interesse an KAM und die tatsächliche Inanspruchnahme für die Gruppe der Fälle in fortgeschrittenem Stadium systematisch zu analysieren und die Häufigkeit der Verwendung abzubilden. Die Publikation bezieht sich auf eine Umfrage zum Interesse und der Verwendung von KAM bei Patientinnen mit Brustkrebs. Ebenso soll aus den Patientencharakteristika abgeleitet werden, welche Merkmale statistisch signifikant mit der Inanspruchnahme von KIM-Verfahren assoziiert sind. Die Studie ist eine Querschnittstudie, die im Zeitraum von August 2014 bis November 2015 als Teil der PRAEGNANT-Studie in 36 Studienzentren in ganz Deutschland durchgeführt wurde. Rekrutiert wurden 590 Patientinnen mit Brustkrebs, die sich entweder bereits in einem fortgeschrittenen Stadium befinden oder bei denen Metastasen vorhanden sind. Auch in dieser Studie ist der Anteil der Patientinnen mit Brustkrebs mit Misteltherapie zu gering, um Ergebnisse zu Erfahrungen mit Misteltherapie auszuwerten. Die Ergebnisse werden nur für die Beschreibung der Inanspruchnahme der Misteltherapie und die Ableitung möglicher Prädiktoren verwendet.
Hübner et al. (2014)234 haben eine Online-Befragung bei Patientinnen mit Brustkrebs durchgeführt, die zusätzlich KAM-Verfahren verwenden. Ziel der Studie ist es, mehr über die Einstellung der Patientinnen zur Verwendung des Internets als Informationsquelle und Kommunikationsmöglichkeit zu anderen Betroffenen bezüglich KAM-Verfahren zu erfahren. Außerdem wird die Inanspruchnahme der komplementären Verfahren beschrieben und welche Erfahrungen die Patientinnen mit der verwendeten KAM-Methode gemacht haben. Die Studie ist eine Querschnittstudie, in der über einen OnlineFragebogen die Nutzenden des „Krebskompass“, dem größten deutschsprachigen Online-SelbsthilfeForum, befragt wurden. Der Link zur Befragung wurde von Juni bis Oktober 2011 auf der Krebskompass-Website gepostet. Rekrutiert wurde ausschließlich über das Krebsforum. Insgesamt haben 80 Teilnehmerinnen den Fragebogen ausgefüllt. Eine Rücklaufquote ist nicht berichtet.
Die Studie von Moschen et al. (2001)237 vergleicht psychologische Aspekte und die Lebensqualität von Patientinnen mit Brustkrebs, die zusätzlich zur konventionellen Therapie komplementär-medizinische Maßnahmen in Anspruch nehmen mit Patientinnen mit Brustkrebs, die nur eine konventionelle Therapie erhalten. Für die Querschnittstudie wurde in der Brustkrebsambulanz der Universitätsklinik Innsbruck rekrutiert. In die Brustkrebsambulanz kommen Patientinnen zum geplanten Behandlungstermin. Zentrale Einschlusskriterien waren, dass die Brustkrebsdiagnose bereits vor mindestens sechs Monaten gestellt wurde und dass die Patientin ein Bewusstsein für die eigene Erkrankung hat. Wie das Bewusstsein der Patientin für die Brustkrebsdiagnose definiert oder operationalisiert wurde beziehungsweise von wem das Vorhandensein eines Bewusstseins für die Erkrankung bewertet wurde, ist nicht berichtet. 126 Patientinnen wurden in die Vorauswahl einbezogen. Ein mit 35 Items erstellter Fragebogen wurde den Patientinnen ausgehändigt und in ruhiger und anonymer Umgebung von den Patientinnen ausgefüllt.
Die Studie von Schad et al. (2018)239 untersucht die Umsetzung integrativer Behandlungskonzepte im Versorgungsalltag in einem zertifizierten Brustkrebszentrum retrospektiv auf Grundlage klinischer und demografischer Daten. Die Population besteht aus 768 Patientinnen und Patienten mit Brustkrebs, die im Zeitraum vom 1. Januar 2011 bis 30. Juni 2016 im zertifizierten Brustkrebszentrum des Gemeinschaftskrankenhauses Havelhöhe in Berlin behandelt wurden. Neben der Standardtherapie sind auch die Misteltherapie und eine Reihe anderer nicht-pharmakologischer Interventionen beschrieben, wie Kunst- und Atemtherapie, Ernährungsberatung, Massagen, Bewegungs- und Physiotherapie oder psychoonkologische Unterstützung. Die Forschenden hatten Zugang zu den Patientendaten über die lokale Krankenhausdatenbank. Die Kennzahlen, die erhoben wurden, werden basierend auf dem Jahresbericht 2016 mit den Kennzahlen anderer zertifizierter Brustkrebszentren verglichen, um einschätzen zu können, ob die Studienpopulation repräsentativ für ein zertifiziertes Behandlungszentrum in Deutschland ist. Für diesen HTA-Bericht werden ausschließlich die Zahlen zur Inanspruchnahme der Misteltherapie verwendet.
Die Studie von Schönekaes et al. (2003)240 untersucht Häufigkeit, Art und Gründe für die Inanspruchnahme komplementärer und alternativer Therapiemaßnahmen bei Patientinnen mit Brustkrebs und will die verwendeten Informationsquellen erfahren. Die Querschnittstudie besteht aus leitfadengestützten strukturierten Interviews bei 203 Patientinnen mit Brustkrebs. Es wird nach dem wahrgenommenen Einfluss der Anwendung einer komplementären Therapiemaßnahme auf das Wohlbefinden befragt. Die Interviews wurden von fünf Ärzten durchgeführt, jeweils von der behanddelnden Ärztin oder vom behandelnden Arzt der Patientin. Trotz Interviewleitfaden wurden die Teilnehmerinnen in ihren Antwortmöglichkeiten nicht eingeschränkt, sondern Mehrfachantworten und eine freie Meinungsäußerung der Patientin war erwünscht. Zeitpunkt der Erhebung war zu Beginn der Strahlentherapie oder innerhalb der ersten zwei Wochen der Bestrahlung. Die Ergebnisse werden nur für die quantitative Beschreibung der Inanspruchnahme der Misteltherapie und die Beschreibung von Merkmalen verwendet, die statistisch signifikant mit der Inanspruchnahme mit KIM-Verfahren assoziiert sind.
Die Studie von Tautz et al. (2012)241 versucht, herauszufinden, wie hoch die Inanspruchnahme von pflanzlichen KAM-Verfahren in der Studienpopulation ist und welchen Bedarf an Kommunikation und Information die Patientinnen haben. Die Patientinnen für die Querschnittstudie wurden in einem Zeitraum von drei Monaten (nicht näher beschrieben) aus vier verschiedenen Studienzentren in Freiburg im Breisgau, Deutschland, rekrutiert. Zwei der Zentren, eine gynäkologische Ambulanz und eine radiologische Praxis, befinden sich an der Universitätsklinik Freiburg. In der gynäkologischen Ambulanz werden sowohl neue Fälle als auch Fälle mit einer längeren Krankheitsgeschichte behandelt. Für die Studie konnten alle Patientinnen mit Brustkrebs aus der Ambulanz rekrutiert werden, die in der Lage waren, den Fragebogen selbst auszufüllen. Diese Patientinnen, die zum Follow-up erscheinen, erfüllen bereits die Einschlusskriterien (siehe Tabelle 61). In der radiologischen Praxis wurden für die Studie nur Fälle eingeschlossen, die sich bereits in der Nachsorge befinden. Die anderen beiden Studienzentren sind Teil der Klinik für Tumorbiologie in Freiburg: die Klinik für innere Onkologie und die Klinik für Onkologische Rehabilitation. Die Patientinnen in der Rehabilitationsklinik haben in der Regel die Akutversorgung mit einer Chemotherapie oder Bestrahlung bereits abgeschlossen. Patientinnen von der inneren onkologischen Station werden meistens bereits palliativ behandelt. Von 211 Patientinnen werden 170 (81 %) für die Studie herangezogen. Zusätzlich haben zwölf Patientinnen, die selbst nicht in der Lage waren, den Fragebogen auszufüllen, eingewilligt, dass deren Krankenakten ausgewertet werden dürfen. Im Rahmen dieses HTA-Berichts sind nur die Ergebnisse zur Inanspruchnahme der Misteltherapie relevant, weil der Anteil der Patientinnen mit Misteltherapie an der Studienpopulation zu gering ist und für Ergebnisse zum Informationsbedürfnis nicht separat berichtet wird.
Ziel der Studie von Templeton et al. (2013)242 ist, herauszufinden, welche unterstützenden Aktivitäten von Patientinnen mit Brustkrebs in den früheren Stadien (noch ohne Metastasierung) zusätzlich zur Standardtherapie betrieben werden und welche zusätzlichen Informationen die Patientinnen gerne bekommen würden. In der Querschnittstudie werden die Patientinnen mit Brustkrebs über zusätzliche unterstützende Aktivitäten und das damit einhergehende Interesse für zusätzliche Informationen zu komplementärer Medizin befragt. Zwischen Dezember 2008 und September 2010 wurden 375 Patientinnen für die Befragung im Brustzentrum St. Gallen rekrutiert. Zugelassen wurden nur Patientinnen im frühen Stadium, ohne Anzeichen eines erneuten Auftretens des Tumors. Die Teilnehmerinnen wurden gebeten einen Fragebogen auszufüllen. 342 (91 %) Patientinnen nahmen an der Befragung teil. Bei Unklarheiten war eine Krankenschwester vor Ort. Die Patientinnen wurden über ihr Interesse an Informationen und die tatsächliche Verwendung von KAM befragt. Das Ergebnis zur Häufigkeit der Verwendung der Misteltherapie eignet sich für die Bewertung der Inanspruchnahme und wird daher in die Auswertung eingeschlossen.
Patientinnenperspektive – qualitative Studien
Ziel der Studie von Brandenberger et al. (2012)230 ist es, mehr Informationen über die Lebensqualität von Krebspatientinnen zu erhalten als über objektivierende Fragebögen möglich ist. Interviews mit Krebspatientinnen sollen zusätzliche Daten zur subjektiv wahrgenommenen Lebensqualität liefern, die über Lebensqualitätsfragebögen oder-messinstrumente nicht erhoben werden können. Ein Fokus liegt auf den Bewältigungsstrategien der Patientinnen und Patienten mit der möglicherweise lebensbedrohlichen Krebserkrankung. Die Studie230 ist eine explorative Kohortenstudie, in der über Fragebögen die Lebensqualität von Patientinnen und Patienten mit verschiedenen Krebserkrankungen während der Misteltherapie erhoben wurde. Die erste Erhebung fand vor dem Beginn der Misteltherapie und die zweite Erhebung nach drei Monaten Misteltherapie statt. Im Paracelsus-Spital Richterswil in der Schweiz, wurden unter den Patienten, die eine ambulante Mistelbehandlung erhalten, Teilnehmer für die Studie rekrutiert. Von den 21 Teilnehmerinnen und Teilnehmern haben sich 17 Personen dazu bereit erklärt, an einem zusätzlichen Interview teilzunehmen. Unter den zwölf halbstrukturierten Interviews, die in die qualitative Inhaltsanalyse aufgenommen wurden, waren die von vier Patientinnen mit Brustkrebs. Neben einer Publikation zu allen Studienteilnehmerinnen und Studienteilnehmern228 wurden die Ergebnisse zu den vier Interviews mit Patientinnen mit Brustkrebs getrennt veröffentlicht230. Dadurch können alle Aussagen, die in dieser Publikation beschrieben werden, sicher den Patientinnen mit Brustkrebs zugeordnet werden. In die Auswertung wird nur die Publikation zu den Patientinnen mit Brustkrebs in die Analyse eingeschlossen.230
Die Studie von Gschwendtner et al. (2016)233 hat zum Ziel, mehr über die Beweggründe von Patientinnen für oder gegen die Anwendung von Mistelpräparaten, den Stand der Information bezüglich der Misteltherapie, sowie die Anliegen zu komplementärer Medizin zu erfahren. Die leitfadengestützte qualitative Studie ist ein Teilprojekt der Verbundforschung des Kompetenznetzwerks Komplementärmedizin in der Onkologie (KOKON). Die halbstrukturierten Interviews beziehen sich auf die Motivation für oder gegen die Anwendung der Misteltherapie bei Krebspatientinnen. Insgesamt wurden 88 Patientinnen interviewt, davon 30 Patientinnen mit Brustkrebs (34 %). Die Ergebnisse sind nicht für die Patientinnen mit Brustkrebs separat berichtet, jedoch stellt der Anteil der Patientinnen mit Brustkrebs knapp die Hälfte der Mistelanwendenden dar. Die Befragung erfolgte im Zeitraum von Oktober 2012 bis Mitte April 2013. Die persönlichen Interviews wurden von einer Person durchgeführt, die nicht in den Behandlungsprozess involviert war. Bevorzugt wurden Einzelinterviews vor Ort, jedoch wurde auf Wunsch der Patientinnen auch die Begleitung eines Familienmitglieds gestattet. Bei schlechtem Allgemeinzustand, zeitlicher Begrenzung, oder bei zu großer Entfernung zum Befragungsort wurden telefonische Interviews durchgeführt, die mittels Audiorecorder aufgenommen wurden. Die Studie bezieht sich spezifisch auf die Misteltherapie, jedoch sind die Ergebnisse, außer zur Inanspruchnahme der Misteltherapie, nicht für Patientinnen mit Brustkrebs separat berichtet. Dennoch wird die Publikation auch in die qualitative Inhaltsanalyse aufgenommen, da sich die Fragen primär auf die Gründe für die Anwendung, die erhaltenen Informationen zur Misteltherapie und der Zufriedenheit, sowie den Wünschen zur Beratung und nicht auf den Krankheitsverlauf beziehen.
Die qualitative Studie von Konitzer et al. (2001)236 befasst sich mit der Frage, was die Misteltherapie als Metapher für Anwenderinnen und Anwender verkörpert, ob die Misteltherapie für die behandelten Patientinnen und Patienten eher den Krebs verkörpert oder ein Mittel gegen den Krebs. Über das Malen von Bildern zur Misteltherapie und der Beschreibung der eigenen Bilder wird die Grundhaltung der Patientinnen und Patienten erörtert, die sie mit der Misteltherapie verbinden. Die Tonspur und das Transkript der Beschreibung der eigenen Bilder bildet die Grundlage für die qualitative Textanalyse nach der gegenstandsbezogenen Theoriebildung („grounded theory“). Über einschlägige anthroposophische und ethnologische Literatur werden die Ergebnisse trianguliert und in den Kontext des bisher verfügbaren Wissens gesetzt. Für die Studie ist weder der konkrete Ort des Studienzentrums beschrieben noch der Zeitraum. Bekannt ist lediglich, dass die zwölf Studienteilnehmerinnen, davon neun mit Mammakarzinom (75 %), über einen Zeitraum von 1,5 Jahren (laut Veröffentlichung) eine Mistelgesamtextrakttherapie in Form von Infusionen in einer Allgemeinarztpraxis erhalten und eine begleitende wöchentliche Gruppentherapie machen. In einer der Therapiesitzungen werden die Daten erhoben. Da sämtliche Autoren und Personen in der Danksagung zu Institutionen in Hannover gehören, wird davon ausgegangen, dass die Studie in oder in der Nähe von Hannover in Deutschland stattfindet. Die Rekrutierung ist nicht beschrieben, jedoch sind alle der Teilnehmenden bereits vor Studienbeginn Teil der Gruppensitzung auf tiefenpsychologischer Ebene.
Studien aus der Perspektive des behandelnden Fachpersonals
Die auf einem selbst erstellten Fragebogen basierende Querschnittstudie von Kalder et al. (2001)65 konzentriert sich auf das Angebot unkonventioneller, komplementärmedizinischer Heilmethoden, die von Gynäkologinnen und Gynäkologen angewendet werden. Ziel der Studie ist, mehr über die Präferenzen zur Verwendung von komplementären Behandlungsmethoden bei diesen Fachärzten und ‑ärztinnen zu erfahren. Nach Möglichkeit soll sich aus der Analyse eine Charakterisierung von Anbietenden und Nicht-Anbietenden ergeben, sowie ein Überblick über deren Einstellungen und Standpunkte. Die Rekrutierung der Teilnehmenden und die Datenerhebung erfolgten im Rahmen von zwei Kongressen und einer Fortbildung: Deutscher Krebskongress 1998, Kongress der deutschen Gesellschaft für Gynäkologie und Geburtshilfe 1998 und die Gießener Gynäkologische Fortbildung 1999. Insgesamt wurden 921 Fragebögen an Gynäkologinnen und Gynäkologen ausgehändigt. 102 davon meldeten zurück, dass der eigene Tätigkeitsbereich nicht in der Onkologie liege. 348 (37,8 %) der Fragebögen wurden ausgefüllt zurückgegeben.
Die Studie von Klein et al. (2017)235 ist eine Online-Befragung und befasst sich mit Einstellungen und Praktiken von Mitgliedern der Arbeitsgemeinschaft Gynäkologische Onkologie im Hinblick auf komplementärmedizinische Maßnahmen. Ziel der Studie ist, das Akzeptanzverhalten und die Anwendung, sowie die Umsetzung komplementärmedizinischer Maßnahmen bei Gynäkologinnen und Gynäkologen mit dem Schwerpunkt Onkologie in Deutschland zu evaluieren. Der Fragebogen für die Querschnittstudie wurde von den Wissenschaftlerinnen und Wissenschaftlern selbst erstellt und vorab getestet. 676 Mitglieder der Arbeitsgemeinschaft für Gynäkologische Onkologie wurden im Juli 2014 per E‑Mail angeschrieben mit der Bitte, an der Studie teilzunehmen. Bei Nicht-Beantwortung wurde im September eine Erinnerungs-E-Mail an die Mitglieder versendet. 104 Personen haben den Fragebogen ausgefüllt und konnten in die Analyse eingeschlossen werden. Das entspricht einer Antwortrate von 14,5 %. Insgesamt erstreckt sich der Zeitraum der Befragung über elf Wochen. Der Fragebogen enthält 17 Fragen zu demografischen Daten, zum Einsatz von komplementären Behandlungsmethoden, zu erbrachten Beratungsleistungen und Qualifikationen zu integrativer Medizin und weiteren Bereichen.
Die Studie von Münstedt et al. (2000)238 ist eine fragebogenbasierte Querschnittstudie zur Abbildung der Einstellungen von Ärztinnen und Ärzten zum Einsatz der Misteltherapie als unkonventionelle Heilmethode in der Onkologie. In der Auswertung wurde von den Autorinnen und Autoren der Studie zwischen drei verschiedenen Gruppen unterschieden: Therapeuten und Therapeutinnen, die eine Misteltherapie als ersten und wichtigsten Behandlungsschritt sehen, Therapeuten und Therapeutinnen, die unkonventionelle Verfahren (UKT) anbieten, aber die Mistel nicht grundsätzlich anwenden, und Nicht-Anbietende der Misteltherapie. Mögliche Unterschiede zwischen den Charakteristika dieser Gruppen sind die Zielgröße der Studie. 310 niedergelassene Ärztinnen und Ärzte aus den Räumen Gießen und Unna (jede der beiden Städte wird als ein Studienzentrum gewertet), deren Adressen dem Telefonbuch oder den Gelben Seiten entnommen werden konnten, wurden persönlich in der Praxis besucht. Die Ärzte und Ärztinne erhielten den Fragebogen mit einer kurzen Beschreibung durch das Studienpersonal. Bei den Ärzten und Ärztinnen, die den Fragebogen nicht annahmen, war die Begründung meistens, dass keine, oder nur sehr wenige, onkologische Patienten und Patientinnen betreut würden oder dass die Personen keine Zeit hätten für die Beantwortung der Fragen. 250 Ärzte und Ärztinnen nahmen den Fragebogen an, wovon 202 einen ausgefüllten Fragebogen retournierten. Die Teilnehmenden wurden in drei verschiedene Gruppen eingeteilt entsprechend der Angaben zur Verwendung der Misteltherapie.
Die Querschnittstudien und qualitativen Studien beschreiben die Studienpopulation insgesamt wenig detailliert und relevante Informationen, wie beispielsweise die Nennung der Ein- und Ausschlusskriterien oder der Erkrankungsstatus, sind nicht im Detail beschrieben. Tabelle 61 fasst die Ein- und Ausschlusskriterien zusammen, die aus den Beschreibungen in den Publikationen entnommen werden können.
Tabelle 61: Ein- und Ausschlusskriterien der Studien zu Patienten- und sozialen Aspekten
|
Studie, Jahr |
Ein- und Ausschlusskriterien |
|
Patientinnenperspektive – quantitative Studien |
|
|
Drozdoff (2018) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Fasching (2007) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Fremd (2017) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Hübner (2014) |
Einschlusskriterien:
|
|
Moschen (2001) |
Einschlusskriterien:
|
|
Schad (2018) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Schönekaes (2003) |
Einschlusskriterien: Alle Patientinnen, die sich im Zeitraum von Januar 2002 bis April 2002 in einem der drei Studienzentren aufgrund eines Mammakarzinoms in Behandlung befanden. Ausschlusskriterien: keine |
|
Tautz (2012) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Templeton (2013) |
Einschlusskriterien:
|
|
Patientinnenperspektive- qualitative Studien |
|
|
Brandenberger (2012) |
Einschlusskriterien:
|
|
Gschwendtner (2016) |
Einschlusskriterien:
Ausschlusskriterien: keine |
|
Konitzer (2001) |
Einschlusskriterien: Mitglied der wöchentlich stattfindenden tiefenpsychologischen Gruppensitzung Ausschlusskriterien: keine |
|
Studien aus der Perspektive des behandelnden Fachpersonals |
|
|
Kalder (2001) |
Einschlusskriterium: Fachärztin/-arzt der Gynäkologie oder Ärzte in Weiterbildung in gynäkologischen Abteilungen Ausschlusskriterien: keine |
|
Klein (2017) |
Einschlusskriterium: Mitglied der AGO Ausschlusskriterien: keine |
|
Münstedt (2000) |
Einschlusskriterium: Niedergelassene Ärztinnen und Ärzte im Raum Gießen und Unna, die über das Telefonbuch aufzufinden waren Ausschlusskriterien: keine |
AGO = Arbeitsgemeinschaft Gynäkologische Onkologie.
Patientinnenperspektive – quantitative Studien
In der Studie von Drozdoff et al. (2018)231 war die Voraussetzung für die Teilnahme eine Diagnose von Brustkrebs oder gynäkologischen Krebsarten und dass die Patientinnen irgendeine Form von systemischer Krebstherapie erhalten.
Fasching et al. (2007)232 haben nur Patientinnen eingeschlossen, bei denen – vermutlich von den Studienärzten – davon ausgegangen wurde, dass sie ein Bewusstsein für die eigene Krebserkrankung haben. Eine konkrete Operationalisierung, wie das Bewusstsein für die Erkrankung beurteilt wurde, ist nicht berichtet. Die Teilnehmerinnen gaben ihre Einverständniserklärung mündlich.
Die Studie von Fremd et al. (2017)62 hat nur Patientinnen mit fortgeschrittenem oder metastasierendem Brustkrebs eingeschlossen. Der Brustkrebs musste diagnostisch bewiesen inoperabel sein. Sonstige Einschränkungen zur Therapieart gab es nicht.
Die Online-Befragung von Hübner et al. (2014)234 hatte als einziges Einschlusskriterium, dass die Teilnehmenden registrierte Nutzerinnen und Nutzer des Online-Selbsthilfeforums „Krebskompass“ sein müssen. Alle registrierten Nutzenden konnten den verlinkten Fragebogen beantworten. Dass der Fragebogen sich auf Brustkrebs bezieht, war dem Titel zu entnehmen, jedoch ist in der Publikation nicht beschrieben, ob die Brustkrebsdiagnose in irgendeiner Weise validiert wurde.
In die Studie Moschen et al. (2001)237 konnten alle Patientinnen mit der Diagnose Brustkrebs eingeschlossen werden, die sich ihrer Diagnose bewusst waren („Awareness“). In der Publikation ist nicht klar beschrieben, ob die „Awareness von einer behandelnden Person bestätigt wurde oder ob das Einschlusskriterium bereits erfüllt war, wenn die Patientin das Bewusstsein für die Erkrankung mit der Zustimmung zur Einverständniserklärung bestätigte. Zudem musste die Krebserkrankung seit mindestens sechs Monaten bestehen.
Die retrospektive Analyse von Schad et al. (2018)239 hat bei der Analyse der Krankenhausdatenbank alle Patientinnen und Patienten mit Brustkrebs eingeschlossen, bei denen eine primäre Brustkrebsdiagnose vorlag. Klassifiziert werden die Fälle nach den Vorgaben des Zertifizierers OnkoZert. Diese Angaben beziehen sich zum einen auf die infrastrukturelle Ebene, welche (Rezidiv-) Fälle, welcher Institution und zu welchem Zeitpunkt zugerechnet werden. Für dieses SR ist relevant, dass für den Einschluss einer Patientin beispielsweise ein histochemischer Bericht vorliegen muss und die Therapieplanung und ‑umsetzung im interdisziplinären Team besprochen und durchgeführt werden musste und damit eine verifiziere Brustkrebsdiagnose vorhanden war.
Um für die Interviews von Schönekaes et al. (2003)240 eingeschlossen werden zu können, mussten sich die Patientinnen im Zeitraum von Januar bis April 2002 in einem der drei Studienzentren aufgrund eines Mammakarzinoms in Behandlung befinden. Sonst wurden keine Ein- oder Ausschlusskriterien genannt. Tautz et al. (2012)241 haben Patientinnen mit Brustkrebs aller Stadien eingeschlossen, die in eines der Studienzentren zum Follow-up-Besuch kamen. Weitere krankheitsbezogene oder soziodemografische Einschlusskriterien gab es nicht.
In der Studie von Templeton et al. (2013)242 wird nur aus Patientinnen rekrutiert, die zur konsekutiven Behandlung in das Brustzentrum St. Gallen kommen. Voraussetzung für die Teilnahme an der Studie war eine Brustkrebsdiagnose im Stadium I bis III. Die Patientinnen durften kein Anzeichen für einen Rückfall aufweisen.
Patientinnenperspektive – qualitative Studien
Für den Einschluss in die Publikation von Brandenberger et al. (2012)230 ist die Voraussetzung nur die Diagnose Brustkrebs und dass die Patientinnen eine ambulante Misteltherapie erhalten. Weitere Ein-und Ausschlusskriterien gibt es nicht.
Für die Interviews von Gschwendtner et al. (201 6)233 wurden Krebspatientinnen und ‑patienten aller Krebsarten eingeschlossen, unabhängig von der Therapie oder dem Krankheitszustand. Zwar wurde erwähnt, dass nur in Einrichtungen mit schulmedizinischem Hintergrund (Rehabilitationsklinik, Palliativstation, Selbsthilfegruppe, onkologische Schwerpunktpraxis, mehrere Akutkliniken) rekrutiert wurde, jedoch gab es keine Einschränkung bezüglich der Therapieform, die die Patientinnen erhalten. Außer der Bereitschaft für ein Interview sind keine Ausschlusskriterien berichtet.
In der Studie von Konitzer et al. (2001)236 ist keine Rekrutierung beschrieben. Es wird nur geschrieben, dass die Studie im Rahmen der wöchentlich stattfindenden Gruppensitzung auf tiefenpsychologischer Grundlage durchgeführt wird.
Studien aus der Perspektive des behandelnden Fachpersonals
Einziges Einschlusskriterium für die Umfrage von Kalder et al. (2001)65 war, dass die Befragten Facharzt beziehungsweise Fachärztin der Gynäkologie oder Ärzte in Weiterbildung in gynäkologischen Abteilungen waren und sich auf einer der drei Veranstaltungen aufhielten, auf denen rekrutiert wurde: der Deutsche Krebskongress 1998, Kongress der deutschen Gesellschaft für Gynäkologie und Geburtshilfe 1998 und die Gießener Gynäkologische Fortbildung 1999. Ausschlusskriterien sind nicht berichtet.
Die Befragung von Klein et al. (2017)235 ging über einen E‑Mail-Verteiler an alle Mitglieder der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO). Mitglieder der AGO sind primär gynäkologische Onkologinnen und Onkologen, können aber auch aus nicht-medizinischen Fachkreisen kommen: Ernährungswissenschaftler/innen, auf Brustkrebs spezialisierte Pflegekräfte, Sportwissen-schaftler/innen, Studien-Pflegekräfte, „Mind-body therapist“ und Kollaborationspartner/in der Gesellschaft, z. B. aus klinischen Zentren für integrative Medizin. Die Studie von Klein et al. (2017)235 ist die einzige eingeschlossene Studie aus Behandelndenperspektive, die nicht nur Ärztinnen oder Ärzte berücksichtigt.
Die Ärztinnen und Ärzte in der Studie von Münstedt et al. (2000)238 sind niedergelassene Medizinerinnen und Mediziner aus den Räumen Gießen und Unna, deren Adressen dem Telefonbuch oder den Gelben Seiten entnommen werden konnten. Ein weiteres Ein- oder Ausschlusskriterium gab es nicht.
Die Studien zur Bewertung der Patienten- und sozialen Aspekte sind ausschließlich Beobachtungsstudien. Keine der Studien hat konkrete Einschlusskriterien bezüglich der Standardtherapie (siehe Tabelle 61). Für die drei Publikationen zur Behandelndenperspektive – Kalder et al., Klein et al. und Münstedt et al.65, 235, 238 – ist die Beschreibung der Behandlung am Ende des Abschnitts in Textform berichtet, da die Ärzte nicht zu einem konkreten Patientinnenkollektiv, sondern allgemein zu deren Verordnungsverhalten befragt wurden. Tabelle 62 beinhaltet daher nur Studien zu Patientinnen mit Brustkrebs.
Studien aus Patientinnenperspektive
Für diese Domäne ist die Art der Standardtherapie nicht relevant für den Ein- oder Ausschluss der Publikation. Der Detailgrad der Beschreibung der Behandlung unterscheidet sich deutlich zwischen den Publikationen. Bei Fasching et al. (2007)232, Gschwendtner et al. (2016)233 und Moschen et al. (2001)237 ist die Standardtherapie gar nicht beschrieben. Die Beschreibung der Misteltherapie unter Einbeziehung des verwendeten Präparats ist bei Brandenberger et al. (2012)230 und bei Konitzer et al. (2001)236 zu finden. Bei Brandenberger erhalten die Patientinnen zwei- bis dreimal pro Woche eine Mistelinjektion. Die vier befragten Patientinnen mit Brustkrebs verwenden die Präparate Iscador®, abnobaVISCUM® oder Isorel®. Die Patientinnen und Patienten in der Studie von Konitzer (2001)236 erhalten über 1,5 Jahre jeweils ein- bis dreimal pro Woche Mistelgesamtextrakt-Infusionen mit Isorel®.
Alle anderen Publikationen – sowohl zur Behandelnden- als auch zur Patientinnenperspektive – nennen weder die Dosierung noch das verwendete Präparat, sondern berichten nur, dass eine Misteltherapie verabreicht wurde.
Da sich bei den Studien die Standardtherapie der einzelnen Patientinnen erheblich unterscheidet und auch Patientinnen ohne Standardtherapie eingeschlossen sind, wird die angewendete Intervention soweit möglich in Tabelle 62 nach Studienarmen getrennt berichtet. Auch zusätzliche Therapiemaßnahmen sind erfasst. Die Informationen können zudem hilfreich sein für die Interpretation der Ergebnisse.
|
Studie, Jahr |
Standardtherapie, Anzahl (%) Misteltherapie |
Patientinnenperspektive – quantitative Studien
|
Drozdoff (2018) |
Chemotherapie: n. b. 220 (66,3) der KAM-Anwender; 58 (50,0) Nicht-Anwender Hormontherapie: 100 (30,1) der KAM-Anwender; 50 (43,1) der Nicht-Anwender Antikörper: 143 (43,1) der KAM-Anwender; 53 (45,6) der Nicht-Anwender Bisphosphonate: 87 (26,2) der KAM-Anwender; 42 (36,2) der Nicht-Anwender Immunmodulation: 2 (0,6) der KAM-Anwender; 0 (0) der Nicht-Anwender |
|
Fasching (2007) |
n. b. n. b. |
|
Fremd (2017) |
Chemotherapie: n. b. 318 (72,9) der Patientinnen mit Interesse an KAM, 84 (66,7) der Patientinnen ohne Interesse an KAM; Bestrahlung: 276 (63,3) der Patientinnen mit Interesse an KAM, 72 (57,1) der Patientinnen ohne Interesse an KAM; Antihormontherapie: 275 (63,1) der Patientinnen mit Interesse an KAM, 79 (62,7) der Patientinnen ohne Interesse an KAM; Anti-HER2-Therapie: 50 (11,5) der Patientinnen mit Interesse an KAM, 14 (11,1) der Patientinnen ohne Interesse an KAM |
|
Hübner (2014) |
Chemotherapie:15 (18,75) n. b. Bestrahlung: 3 (3,75) Hormontherapie: 34 (42,5) Nur Bisphosphonate: 2 (2,5) Zusätzliche Therapieformen: 5 (6,25) Antikörpertherapie; Bisphosphonate: 2 (2,5) |
|
Moschen (2001) |
n. b., aber Standardtherapie ist Bedingung für den Einschluss in die n. b. Studie |
|
Schad (2018) |
OP: 722 (97,4) n. b. Bestrahlung: 396 (53,4) Hormontherapie: 280 (37,8) Chemotherapie: 188 (25,3) Gezielte Therapie oder immunmodulierende Therapie: 63 (8,5) Bisphosphonate 31 (4,2) |
|
Schönekaes (2003) |
Bestrahlung: 203 (100), davon: n. b. Adjuvante Bestrahlung nach brusterhaltender OP: 167 (82,2) Behandlung wegen Lokalrezidivs: 9 (4,4) Behandlung von Fernmetastasen: 27 (13,3) |
|
Tautz (2012) |
Mastektomie: n. b. 42 (42) KAM-Anwender; 9 (15) Nicht-Anwender Chemotherapie: 80 (80) KAM-Anwender; 40 (65) Nicht-Anwender Hormontherapie: 64 (64) KAM-Anwender; 39 (63) Nicht-Anwender |
|
Templeton (2013) |
OP: 338 (98,8) Chemotherapie: 26 (7,6) laufend; 189 (55,3) bereits abgeschlossen Bestrahlung: 244 (71,3) bereits abgeschlossen Hormontherapie: 197 (57,6) laufend; 124 (36,3) bereits abgeschlossen Anti-HER2-Therapie: 13 (3,8) laufend; 30 (8,8) bereits abgeschlossen |
n. b. |
|
Patientinnenperspektive – qualitative Studien |
||
|
Brandenberger (2012) |
Unter den 4 Patientinnen mit Brustkrebs: Chemotherapie:1 (25) vor Beginn der Misteltherapie Bestrahlung:1 (25) (vor und während Misteltherapie) Hormontherapie: 4 (100) OP: 4 (100) |
2 bis 3‑mal pro Woche mit Iscador®, abnobaVISCU M® oder Isorel® |
|
Gschwendtner (2016) |
n. b. |
n. b. |
|
Konitzer (2001) |
n. b. |
1 bis 3‑mal pro Woche mit Isorel® |
HER2 = Human epidermal growth factor receptor 2. KAM = Komplementäre und alternative Medizin. n. b. = Nicht berichtet. OP = Operation.
Patientinnenperspektive – quantitative Studien
In der Studie von Drozdoff et al. (2018)231 haben alle Teilnehmerinnen eine systemische Krebstherapie erhalten. Die Angaben zur Anzahl der Patientinnen nach Art der Standardtherapie werden in der Publikation nicht getrennt für Brustkrebs gemacht, sondern nur gemeinsam für Brust- (83,3 % der Patientinnen) und Eierstockkrebs (16,7 % der Patientinnen). Außerdem wird nur nach KAM-Anwendenden (beinhalten 24,8 % Mistelanwendende) und Nicht-Anwendenden unterschieden, nicht nach Patientinnen mit und ohne Misteltherapie. Eingesetzt wurden folgende Therapiearten (mehrere Therapien gleichzeitig waren möglich): Chemo- (66,3 % beziehungsweise 50,0 %), Hormon- (30,1 % beziehungsweise 43,1 %) und Antikörpertherapie (43,1 % beziehungsweise 45,6 %). Von den Patientinnen, die eine Chemotherapie erhalten, verwendet die Mehrheit zusätzlich eine pflanzliche KAM-Methode (79,1 % von allen Patientinnen mit Chemotherapie). Informationen zu einer möglichen Bestrahlung wurden nicht berichtet, da der Fokus der Studie auf der Nutzung pflanzlicher KAM-Verfahren zusätzlich zur systemischen Therapie liegt. Das heißt nicht zwingend, dass keine der Patientinnen eine Bestrahlung erhalten hat. Zusätzliche Bisphosphonate, die vor allem dann eingesetzt werden, wenn Knochenmetastasen bestehen, erhielten deutlich mehr Patientinnen aus der Gruppe der Nicht-Anwendenden (36,2 %) als aus der der KAM (26,2 %).
Für Fasching et al. (2007)232 ist weder die Standard- noch die Misteltherapie beschrieben.
In der Studie von Fremd et al. (2017)62 wurde die Anzahl der Patientinnen je Therapieform erfasst, abhängig davon, ob sie sich für KAM interessieren oder nicht. Bezüglich der Anteile der Therapieformen sind die Gruppen vergleichbar, wobei der Anteil der Patientinnen, die eine Chemotherapie oder Bestrahlung erhielten, jeweils 6,2 % höher ist bei den Patientinnen, die sich für KAM-Verfahren interessieren.
Unter den Teilnehmerinnen der Online-Umfrage von Hübner et al. (2014)234 erhielten zum Zeitpunkt der Befragung 67 der 80 Patientinnen (83,7 %) mindestens eine Standardtherapie (Chemo‑, Radio- oder Hormontherapie), elf (13,8 %) erhalten keine konventionelle Therapie. Zwei Personen haben die Frage nicht beantwortet (2,5 %). Die Angaben in der Publikation sind zu ungenau, um konkret bestimmen zu können, wie viele der 67 Patientinnen welche Standardtherapie erhalten haben, denn die in Tabelle 62 genannten Zahlen ergeben nicht die genannten 67 Patientinnen. Die Prozentangaben beziehen sich auf die gesamte Studienpopulation (80 Personen). Nach Angaben der Autoren der Studie haben 13 Patientinnen mindestens zwei Standardtherapien aus dem Bereich Chemo‑, Radio- oder Hormontherapie erhalten, jedoch ist nicht ersichtlich, ob diese bei den in Tabelle 62 genannten Zahlen bereits integriert sind oder nicht. Therapieformen, die zusätzlich zur Standardtherapie verwendet
wurden, sind die Antikörpertherapie und die Gabe von Bisphosphonaten. Unklar ist, ob die beiden Patientinnen, die Bisphosphonate erhalten haben, auch zu den Patientinnen zählen, die eine Standardtherapie erhalten oder nicht. Die Form der Misteltherapie ist nicht beschrieben.
Für die Studie von Moschen et al. (2001)237 ist die Behandlung nicht konkret berichtet, aber eine Standardtherapie ist Bedingung für den Einschluss in die Studie.
In der Studie von Schad et al. (2018)239 wurde bei 722 (97,4 %) der 741 Patientinnen mit primärem Brustkrebs eine Operation durchgeführt. Von 741 Patientinnen mit primärem Brustkrebs erhielten 396 Patientinnen eine Bestrahlung, 280 Patientinnen eine Hormontherapie, 188 Patientinnen eine Chemotherapie, 63 Patientinnen eine gezielte Therapie oder immunmodulierende Therapie und 31 Patientinnen Bisphosphonate. Weitere Details zu den einzelnen Therapien und deren Ausführung sind in der Veröffentlichung beschrieben. Das verwendete Mistelpräparat ist nicht beschrieben, aber die Applikationsform. Von den 238 Anwendern haben 204 (85.7 %) die Mistelpräparate subkutan erhalten und 68 (28.6 %) intravenös als Off-Label-Gebrauch. Aufgrund der Zahlen müssten 34 Personen beide Applikationsformen erhalten haben. Dies ist jedoch nicht explizit beschrieben.
Da die Studienzentren der Studie von Schönekaes et al. (2003)240 radiologische Abteilungen waren, und nur Patientinnen eingeschlossen wurden, die am Beginn einer Bestrahlungstherapie standen, erhalten alle Patientinnen eine Bestrahlung. Eine vorherige brusterhaltende Operation hatten 167 von 203 Patientinnen (82,2 %).
In der Studie von Tautz et al. (2012)241 wurde weder die Chemo- noch die Hormontherapie genau beschrieben. Erfasst wurde nur die Anzahl der Patientinnen, die eine Chemo- oder Hormontherapie erhalten, abhängig davon ob sie KAM-Verfahren verwenden oder nicht. Aus der Gruppe der Patientinnen, die KAM-Verfahren anwenden, haben 39,3 % eine Mastektomie, 80 % eine Chemo- und 64 % eine Hormontherapie erhalten. Aus der Gruppe der Patientinnen, die keine KAM-Verfahren anwenden, haben 25 % weniger eine Mastektomie und 15 % weniger eine Chemotherapie erhalten. Der Anteil der Hormontherapie war vergleichbar. Auch in dieser Studie ist der Anteil von Patientinnen mit Chemotherapie bei Patientinnen, die KAM verwenden, deutlich höher als bei Nicht-Anwendern.
Von den 342 Patientinnen in der Studie von Templeton et al. (2013)242 wurden 98,8 % operiert. 93,9 % erhielten zusätzlich eine Hormontherapie. Die meisten Patientinnen erhielten auch eine Bestrahlung (71,3 %) und/oder eine Chemotherapie (62,9 %). 12,6 % erhielten eine Anti-HER2 Therapie. Alle prozentualen Angaben in Tabelle 62 beziehen sich auf alle 342 Studienteilnehmerinnen.
Patientinnenperspektive – qualitative Studien
Bei den vier Patientinnen mit Brustkrebs aus der Studie von Brandenberger et al. (2012)230 ist die Standardtherapie für jede Patientin leicht unterschiedlich. Die Gemeinsamkeit ist, dass bei allen vier Patientinnen der Tumor durch eine Operation entfernt wurde – bei einer Patientin zumindest partiell ‑und alle vier sowohl eine Hormonbehandlung als auch zwei- bis dreimal pro Woche eine Misteltherapie erhalten haben. Die verwendeten Präparate waren: Iscador®, abnobaVISCUM® oder Isorel®. Zwei der Patientinnen (F56) und (F63) haben eine zusätzliche Bestrahlung abgelehnt und eine von ihnen (F56) hat zudem auch die Chemotherapie aufgrund von starken Nebenwirkungen abgebrochen. Die beiden Patientinnen setzten die Misteltherapie als einzige Therapie, zusätzlich zur Hormontherapie ein. Die dritte Patientin (F42) erhielt vor Beginn der Misteltherapie eine Chemotherapie und eine Bestrahlung. Die vierte Patientin (F69) erhielt als Standardtherapie eine Radiotherapie vor und während der Misteltherapie und Bisphosphonate wegen Knochenmetastasen. Keine der Patientinnen mit Brustkrebs erhielt die Mistelpräparate zusätzlich zur beziehungsweise während der Chemotherapie.
Für Gschwendtner et al. (2016)233 ist keine Standard- oder Misteltherapie beschrieben. Relevant war nur, dass die interviewten Personen eine Misteltherapie erhielten oder bereits erhalten hatten.
Für die Patientinnen oder Patienten in der Studie von Konitzer et al. (2001)236 ist keine Standardtherapie berichtet. Die Teilnehmer der Gruppentherapie werden ambulant in einer Allgemeinarztpraxis versorgt und erhalten seit 1,5 Jahren ein- bis dreimal pro Woche Infusionen mit Isorel®.
Studien aus der Perspektive des behandelnden Fachpersonals
In keiner der drei Studien zur Behandelndenperspektive65, 235, 238 ist beschrieben, welche Therapieformen einer Standardtherapie angewendet werden. Von verwendeten KIM-Verfahren in der Onkologie werden bei Kalder et al. (2001)65 die häufigsten genannt (beginnend mit dem häufigsten): Misteltherapie (circa 50 %), Homöopathie (circa 35 %), Akupunktur (circa 26 %), Vitamine (circa 19 %) und Diäten (circa 15 %).
Klein et al. (2017)235 zählen sämtliche verwendete KIM-Verfahren, die von den gynäkologischen Onkologinnen und Onkologen angegeben wurden auf (beginnend mit der häufigsten): Sport (77 %), Ernährungsberatung (57 %), Nahrungsergänzungsmittel (54 %), Meditation (46 %), Kräutertherapie (45 %), Homöopathie (36 %), Misteltherapie (36 %), Massagen (33 %), Aromatherapie (19 %), Kompressen (19 %), Traditionelle Chinesische Medizin (18 %), Yoga/Tai Chi/Chi Gong (13 %), „Mind-Body-Interventions“ (11 %), Anthroposophische Medizin (10 %), Osteopathie/Chiropraktik (10 %), Hyperthermie (7 %), Krebs-Diät (6 %), Ayurveda (2 %) und Autohaemotherapie (1 %). Welche KIM-Methode von den befragten Ärztinnen und Ärzten für Patientinnen mit Brustkrebs während der Chemotherapie empfohlen wird, ist nicht berichtet.
Münstedt et al. (2000)238 betrachten nur die Misteltherapie als KIM-Verfahren, unterscheiden jedoch drei Gruppen von Therapeutinnen und Therapeuten, die aufgrund der Angabe zur Häufigkeit der Anwendung der Misteltherapie von den Autorinnen und Autoren der Studie gebildet wurden: Therapeutinnen und Therapeuten, die eine Misteltherapie als ersten und wichtigsten Behandlungsschritt sehen (21 %), Therapeutinnen und Therapeuten, die eine Misteltherapie unter anderem anwenden (44 % „KIM-Therapeuten“) und eine weitere Gruppe, die die Misteltherapie gar nicht anwendet (35 %). Weitere Ausführungen zur Beschreibung der KIM- und Misteltherapeuten/innen sowie NichtAnbietenden sind in den Ergebnissen in Abschnitt 5.3.7 zur Einstellung der Ärztinnen und Ärzte gegenüber der Misteltherapie beschrieben.
Die Misteltherapie wurde in keiner der Studien näher spezifiziert.
Zielgrößen, die aus dem EUnetHTA „HTA Core Model®71 abgeleitet und auch für die Literatursuche und ‑selektion verwendet wurden, sind die bereits in Tabelle 8 genannten Bereiche:
-
• Häufigkeit der Inanspruchnahme der begleitenden Misteltherapie
-
• Einstellung gegenüber/ Akzeptanz der begleitenden Misteltherapie
-
• Erwartungen an die begleitende Misteltherapie
-
• Wissen über die begleitende Misteltherapie
-
• Zugang zur Misteltherapie für verschiedene Patientengruppen
-
• Erfahrungen mit der begleitenden Misteltherapie
-
• Zufriedenheit mit der begleitenden Misteltherapie im Alltagsleben
-
• Art, Umfang und Bewertung der Patientinneninformation zur begleitenden Misteltherapie
-
• Bewertung der Arzt-Patienten-Kommunikation hinsichtlich der begleitenden Misteltherapie
Diese Zielgrößen erhalten jeweils ein eigenes Unterkapitel, in dem die verfügbare Evidenz aus den Ergebnisteilen der eingeschlossenen quantitativen und qualitativen Publikationen zusammengefasst und berichtet wird. Dabei wird innerhalb jeder Zielgröße unterschieden zwischen der Patientinnen- und der Behandelndenperspektive, soweit vorhanden. Weitere Zielgrößen, die nicht aus dem EUnetHTA HTA Core Model® abgeleitet wurden, konnten auch über die qualitative Analyse nicht gefunden werden. Ergänzt wurde jedoch die Perspektive der Behandelnden, die einen vergleichbaren Stellenwert einnimmt wie die der Patientinnen.
Bei der qualitativen Analyse ist das Ergebnis das Codesystem mit den induktiv-deduktiv abgeleiteten Codes, zusammengefasst als Kategoriensystem. Die Ergebnisse der qualitativen Inhaltsanalyse, die auch separat in Abschnitt 5.3.7.10 berichtet werden, werden zusätzlich den Abschnitten zu den einzelnen Zielgrößen (5.3.7.1 bis 5.3.7.9) zugeordnet, wenn diese in den Bereich der jeweiligen Zielgröße der Domäne Patienten- und soziale Aspekte fallen.
Tabelle 63 gibt einen Überblick über die berichteten Zielgrößen der eingeschlossenen Publikationen und welche Ergebnisse davon für unsere Synthese verwertbar berichtet sind. Ein „x“ bedeutet, die Daten sind berichtet und verwertbar in der Analyse. Das heißt, dass die Ergebnisse aus dieser Publikation Teil der Ergebnisdarstellung im jeweiligen Kapitel in Abschnitt 5.3.7 sind.
Um die Darstellung in der Tabelle übersichtlicher zu gestalten, werden die Zielgrößen durchnummeriert. Die Beschreibung der Zielgröße ist der Legende zu entnehmen (siehe Tabelle 63). Z1, die Häufigkeit der Inanspruchnahme der Misteltherapie, ist die einzige Zielgröße, die auch Publikationen enthält, bei denen der Anteil der Patientinnen mit Brustkrebs und begleitender Misteltherapie geringer als 80 % ist.
Tabelle 63: Auflistung der Zielgrößen nach Studien
|
Studie, Jahr |
Z1 Z2 |
Z3 |
Z4 |
Z5 |
Z6 |
Z7 |
Z8 |
Z9 |
|
Patientinnenperspektive |
- quantitative Studien |
|||||||
|
Drozdoff (2018) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Fasching (2007) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Fremd (2017) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Hübner (2014) |
xx |
x |
x |
- |
- |
x |
x |
x |
|
Moschen (2001) |
xx |
x |
- |
^B |
^B |
^B |
^B |
- |
|
Schad (2018) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Schönekaes (2003) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Tautz (2012) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Templeton (2013) |
x- |
^B |
^B |
^B |
^B |
^B |
^B |
- |
|
Patientinnenperspektive |
- qualitative Studien |
|||||||
|
Brandenberger (2012) |
-x |
x |
- |
x |
x |
- |
- |
- |
|
Gschwendtner (2016) |
xx |
x |
- |
x |
- |
- |
x |
x |
|
Konitzer (2001) |
– |
- |
- |
- |
x |
x |
- |
- |
Studien aus der Perspektive des behandelnden Fachpersonals
|
Kalder (2001) |
x |
x |
x |
–x— |
|
Klein (2017) |
x |
x |
- |
xxx- xx |
|
Münstedt (2000) |
x |
x |
x |
–x–x |
x Daten werden berichtet und sind verwertbar.
- Keine Daten berichtet oder die Daten können nicht für die Bewertung der Zielgröße verwendet werden.
Z1: Häufigkeit der Inanspruchnahme der begleitenden Misteltherapie.
Z2: Einstellung gegenüber/Akzeptanz der begleitenden Misteltherapie.
Z3: Erwartungen an die begleitende Misteltherapie.
Z4: Wissen über die begleitende Misteltherapie.
Z5: Zugang zur Misteltherapie für verschiedene Patientengruppen.
Z6: Erfahrungen mit der begleitenden Misteltherapie.
Z7: Zufriedenheit mit der begleitenden Misteltherapie im Alltagsleben.
Z8: Art, Umfang und Bewertung der Patientinneninformation zur begleitenden Misteltherapie.
Z9: Bewertung der Arzt-Patienten-Kommunikation hinsichtlich der begleitenden Misteltherapie.
Tabelle 63 beschreibt, in welchen der Publikationen Informationen zu den einzelnen Zielgrößen genannt wurden. Jede der Zielgrößen wurde in mindestens einer Publikation beschrieben. In dreizehn Studien werden Zahlen zur Häufigkeit der Inanspruchnahme der Misteltherapie genannt. Teilweise sind auch Merkmale beschrieben, die statistisch signifikant mit der Inanspruchnahme von KIM-Verfahren assoziiert sind. Fünf Studien berichten Ergebnisse zur Einstellung gegenüber beziehungsweise der Akzeptanz der begleitenden Misteltherapie, vor allem aus Sicht der behandelnden Personen. Sechs Studien berichten Erwartungen der Patientinnen sowie der behandelnden Personen an die Misteltherapie. Zwei Studien berichten konkrete Informationen zum Wissensstand bezüglich der Misteltherapie, eine Studie aus Patientinnenperspektive und eine Studie aus der Perspektive der behandelnden Fachkreise. Informationen zum Zugang zur Misteltherapie konnten in drei Studien gefunden werden. Fünf Studien berichten Erfahrungen mit der begleitenden Misteltherapie. Zwei Studien präsentieren Ergebnisse zur Zufriedenheit mit der Misteltherapie. Zu Art, Umfang und Bewertung der Patientinneninformation sind Ergebnisse in drei Studien enthalten. Vier Studien bewerten die Arzt-Patienten-Kommunikation.
Zu sieben Zielgrößen (Z2, Z3, Z5, Z6, Z7, Z8 und Z9), zu denen auch in den qualitativen Studien relevante Informationen gefunden wurden, sind die Ergebnisse der qualitativen Inhaltsanalyse getrennt von den quantitativen Studien am Ende jedes Abschnitts unter der Überschrift „Patientinnenperspektive – qualitative Studien“ berichtet.
Die verwendeten Checklisten aus dem Critical Appraisal Skills (CASP)-Programm103, 104 – in der englischen Originalfassung mit der deutschen Übersetzung durch die Autorinnen (CS und PSI) und den durchgeführten Anpassungen für Querschnittstudien – sind im Anhang in Abschnitt 9.3.3 (Tabelle 110 und Tabelle 111) dargestellt. Eine kurze Erläuterung zur Verwendung oder Nicht-Verwendung bestimmter Items aus den CASP-Checklisten ist ebenso den beiden genannten Tabellen zu entnehmen. Zur besseren Übersicht sind die Fragen für qualitative Studien mit „Q“ gekennzeichnet und die Fragen zur Querschnittstudien-Checkliste erhalten ein „QS“ vor der Fragennummer. Die ausgefüllten Checklisten, mit Kommentaren zur Bewertung, sind für jede Publikation getrennt im Anhang in Abschnitt 9.4.2 zu finden. Bei der Bewertung der Qualität und des Verzerrungspotenzials der Studien werden ausschließlich die Ergebnisse berücksichtigt, die sich auf die Zielgrößen zu Patienten- und sozialen Aspekten beziehen.
Querschnittstudien
In Tabelle 64 sind die Ergebnisse der Qualitätsbewertung der quantitativen Studien zusammengefasst. Die für den HTA-Bericht relevanten Ergebnisse, die in der CASP-Checkliste (Tabelle 111) für Kohortenstudien in Frage 7 „Was sind die Ergebnisse dieser Studie?“ abgefragt werden, sind in diesem Abschnitt nicht genannt, da diese Teil der Ergebnisdarstellung in Abschnitt 5.3.7 sind.
Tabelle 64: Übersichtstabelle CASP-Bewertung Querschnittstudien
|
QS1 |
QS2 |
QS3 |
QS4* |
QS9 |
QS10 |
|
|
Patientinnenperspektive |
- quantitative Studien |
|||||
|
Drozdoff (2018) |
Ja |
Ja |
Ja |
?*/? |
Ja |
? |
|
Fasching (2007) |
Ja |
? |
Ja |
Ja*/Ja |
Ja |
Ja |
|
Fremd (2017) |
Ja |
? |
Ja |
Ja*/Nein |
Ja |
? |
|
Hübner (2014) |
Ja |
? |
Nein |
Ja*/? |
? |
? |
|
Moschen (2001) |
Ja |
? |
? |
Ja*/Ja |
? |
? |
|
Schad (2018) |
Ja |
Ja |
Ja |
Ja*/Ja |
Ja |
? |
|
Schönekaes (2003) |
Ja |
Ja |
Nein |
Ja*/Ja |
Ja |
? |
|
Tautz (2012) |
Ja |
Ja |
Ja |
Ja*/Ja |
Ja |
Ja |
|
Templeton (2013) |
Ja |
? |
Ja |
Ja*/Ja |
Ja |
? |
Studien aus der Perspektive des behandelnden Fachpersonals
|
Kalder (2001) |
Ja |
Ja |
Ja |
Ja*/Ja |
Ja |
? |
|
Klein (2017) |
Ja |
Ja |
Ja |
Ja*/? |
? |
? |
|
Münstedt (2000) |
Ja |
Ja |
? |
Ja*/? |
Ja |
? |
*QS4 ist unterteilt in die Zielgröße „Häufigkeit der Inanspruchnahme (erste Bewertung)/alle weiteren Zielgrößen (zweite Bewertung).
Ja = Kriterium ist erfüllt. Nein = Kriterium ist nicht erfüllt.„?“ = Unklar.
QS1) Hat sich die Studie mit einem klar fokussierten Thema befasst?
QS2) Wurde die Stichprobe in akzeptabler Weise rekrutiert?
QS3) Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren?
QS4) Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren?
QS9) Sind die Ergebnisse glaubwürdig?
QS10) Sind die Ergebnisse auf die Zielpopulation übertragbar?
CASP = Critical Appraisal Skills Programme.
Ziel der Forschung (QS1) und Rekrutierung (QS2)
Das Ziel der Studie, die Forschungsfragen sowie die Rekrutierung der Teilnehmerinnen und Teilnehmer sind in allen Publikationen klar beschrieben. Bei den meisten Studien ist die Beschreibung der Rekrutierung akzeptabel65, 231, 235, 237, 238, 241, darunter alle drei Studien zur Perspektive der behandelnden Person. Vier Studien62, 232, 234, 242 weisen Schwächen bei der Rekrutierung auf, die im Folgenden beschrieben werden:
Die Rekrutierung der Patientinnen für die Studie von Fasching et al. (2007)232 erfolgte in verschiedenen Studienzentren. 1.030 Teilnehmerinnen in verschiedenen Phasen der Behandlung konnten in die Studie eingeschlossen werden. Die Auswahl der Patientinnen wird als zufällig beschrieben, jedoch ohne Nennung eines Verfahrens. Auch das Einschlusskriterium „Bewusstsein der Erkrankung“ ist nicht operationalisiert und könnte zu nicht-beabsichtigter Selektion führen. Daher ist das Verzerrungspotenzial durch Selektion unklar. In der Publikation von Fremd et al. (2017)62 sind die Rekrutierung und Befragung nicht genau beschrieben. Hübner et al. (2014)234 rekrutieren die Studienstichprobe über ein Online-Krebsforum, zu dem nur aktive Mitglieder von Krebskompass.de Zugang haben. Bei Templeton et al. (2013)242 ist die Angemessenheit der Rekrutierung fraglich, weil nicht genau berichtet wurde, wie und von wem die Patientinnen auf die Studie aufmerksam gemacht wurden, sondern nur, wo die Befragung stattgefunden hat.
Messung der Exposition (QS3)
Die gesuchte Exposition, die für die Auswertung relevant ist, ist eine gesicherte Brustkrebsdiagnose und die Inanspruchnahme von KIM-Verfahren beziehungsweise der Misteltherapie. Je nach Studiendesign zählt auch die Inanspruchnahme von KIM-Verfahren zur Exposition, jedoch zählt diese bei den meisten Studien zu den Ergebnissen. Für die sieben Publikationen (Drozdoff et al. (2018)231, Fasching et al. (2007)232, Fremd et al. (2011)62, Schad et al. (2018)239, Schönekaes et al. (2003)240, Tautz et al. (2012)241 und Templeton et al. (2013)242, die nur eingeschlossen wurden, weil sie Häufigkeiten zur Inanspruchnahme der Misteltherapie beinhalten, ist das Vorliegen einer Brustkrebsdiagnose jeweils Einschlusskriterium für die Studienteilnahme. Bei Drozdoff et al. und bei Fasching et al. waren auch gynäkologische Krebsarten als Diagnose möglich.
Fraglich ist das tatsächliche Vorliegen einer Brustkrebsdiagnose nur bei Hübner et al. (2014)234, weil die Angaben der Patientinnen, die den Fragebogen online ausgefüllt hatten, nicht kontrolliert werden können. Die Angaben dazu, werden von den Patientinnen selbst gemacht.
In den Studien von Moschen et al. und Schönekaes et al. ist nicht berichtet, ob die Angaben zur Inanspruchnahme der Misteltherapie von den Studienärzten validiert wurden und wie nach der Misteltherapie gefragt wurde.
In den Studien aus Perspektive der behandelnden Fachpersonen gibt es keine Einschlusskriterien zu Vorerfahrungen mit der Misteltherapie oder komplementären Verfahren oder einer Mindestanzahl an onkologisch betreuten Patientinnen. Wie hoch jeweils der Anteil an behandelten Patientinnen mit Brustkrebs ist und ob die Erfahrungswerte repräsentativ sind, ist nicht angegeben. Da in den Studien jedoch einige potenzielle Teilnehmende bereits bei der Rekrutierung die Teilnahme abgelehnt hatten, weil sie sich als nicht geeignet und/oder repräsentativ eingeschätzt hatten, wird davon ausgegangen, dass die subjektive Beurteilung der eigenen Berufserfahrung bereits zu einer Selbstselektion von Teilnehmern geführt hat, die Erfahrung mit Patientinnen mit Brustkrebs und Misteltherapie haben. In der Studie von Münstedt et al. (2000) werden die Ergebnisse für die Gruppe der „Misteltherapeuten“, die eine Misteltherapie als ersten und wichtigsten Schritt sehen, und Therapeuten/innen, die die Misteltherapie nur unter anderem anwenden, berichtet. Dadurch wird der Einfluss von Erfahrung und Einstellung der Ärztin oder des Arztes auf die Ergebnisse expliziter gemacht.
Messung der Ergebnisse (QS4)
Sieben Studien62, 231, 232, 239–242 wurden ausschließlich zur Bewertung der Häufigkeit der Inanspruchnahme der Misteltherapie eingeschlossen. Diese Zielgröße wird in den Studien anhand von Fragen zur Inanspruchnahme verschiedener KIM und KAM gemessen.
Die Bewertung für die Frage QS4 ist unterteilt zwischen der in Spalte 5 zuerst für die Zielgröße „Häufigkeit der Inanspruchnahme (erste Bewertung)’ und allen danach für alle weiteren Zielgrößen angegeben. Mit Ausnahme der Publikation von Drozdoff et al. (2018)231 enthalten alle Publikationen in Tabelle 64 eine genaue Angabe der Häufigkeit der Inanspruchnahme einer Misteltherapie bei Patientinnen mit Brustkrebs. Bei Drozdoff et al. wurde die Inanspruchnahme der Misteltherapie sowohl für Patientinnen mit Brustkrebs als auch für Patientinnen mit gynäkologischen Krebsarten gemeinsam berichtet und könnte somit eventuell unterschätzt werden, weil sich die Inanspruchnahme zwischen den Krebsarten in der Regel unterscheidet und bei Brustkrebs meistens höher ist.
Zusätzlich werden in acht der Querschnittstudien, davon sechs der Studien aus Patientinnenperspektive62, 231, 232, 240–242 und zwei Studien aus Perspektive des behandelnden Fachpersonals65, 238 Merkmale berichtet, die mit der Inanspruchnahme von komplementären Verfahren statistisch signifikant assoziiert sind. Bis auf die Studie von Drozdoff et al. (2018)231, die sich – wie die Zahlen zur Inanspruchnahme – auch auf Patientinnen mit gynäkologischen Krebsarten beziehen, werden die assoziierten Merkmale in den Studien aus Patientinnenperspektive als angemessen erhoben beurteilt (berichtet in Tabelle 69 und Tabelle 70). Für jedes der assoziierten Merkmale werden in allen Studien geeignete statistische Kennzahlen berichtet. Auch in den Studien zu Merkmalen behandelnder Fachpersonen sind die assoziierten Merkmale angemessen erhoben und mit statistischen Kennzahlen zur Stärke des Zusammenhangs berichtet (siehe Tabelle 72). Bei Münstedt et al.238 ist jedoch die Darstellung der Vorgehensweise bei der Ableitung von assoziierten Merkmalen teilweise unklar beschrieben. Der Messfehler bei der Identifizierung assoziierter Merkmale, wird als gering eingestuft. Jedoch sind Merkmale, die statistisch signifikant mit der Inanspruchnahme von KIM-Verfahren assoziiert sind, nur begrenzt auf die Inanspruchnahme der Misteltherapie übertragbar, wenn der Anteil der Misteltherapie unter den KIM-Verfahren klein ist. Keine der Studien zur Patientinnenperspektive hat Prädiktoren zur Inanspruchnahme der Misteltherapie allein berichtet, sondern es sind immer auch andere KIM-Verfahren einbezogen. Dies betrifft die sechs Studien62, 231, 232, 240–242, die nur für die Bewertung der Inanspruchnahme eingeschlossen werden konnten. Die Studie von Münstedt et al. (2000)238 ist die einzige Studie, in der nur die Misteltherapie untersucht wurde. Aber auch hier werden Therapierende eingeschlossen, die eine Misteltherapie nur unter anderem einsetzen. Das Potenzial für Messfehler für diese Studie wird als sehr gering eingestuft, da die Therapierenden nur angeben müssen, ob sie die Misteltherapie als erstes und wichtigstes KIM-Verfahren einsetzen oder nur als ein mögliches komplementäres Verfahren. Dass die Angaben zur eigenen Person korrekt sind, wird angenommen.
Für die fünf Studien, die auch in die Analyse für andere Zielgrößen einbezogen wurden – zwei zur Patientinnen-234, 237 und drei zur Behandelndenperspektive65, 235 238 – beinhalten auch Informationen zu den Zielgrößen Z2 bis Z9. Diese Zielgrößen beziehen sich auf die Einstellung gegenüber und die Akzeptanz sowie die Erwartungen an und das Wissen über die begleitende Misteltherapie, den Zugang zur Misteltherapie für verschiedene Patientengruppen, die Erfahrungen und Zufriedenheit mit der begleitenden Misteltherapie sowie die Art, den Umfang und die Bewertung der Patientinneninformation zur begleitenden Misteltherapie sowie die Bewertung der Arzt-Patienten-Kommunikation hinsichtlich der begleitenden Misteltherapie. Bei den beiden quantitativen Studien aus Patientinnenperspektive 234,237 ist eine eingeschränkte Gültigkeit der Ergebnisse auf die Misteltherapie wahrscheinlich, da sich die Ergebnisse nicht konkret auf die Misteltherapie beziehen, sondern auf alle in den beiden Studien eingeschlossenen komplementären Verfahren. Die Bewertung ist daher für diese Studien „unklar“.
Ein ähnliches Problem besteht für die Studie von Klein et al.235, da die Misteltherapie nur eines der beschriebenen komplementären Verfahren ist und sich die assoziierten Merkmale auch auf andere komplementären Verfahren beziehen könnten. Dennoch sind die Ergebnisse der Zielgrößen Z2 bis Z9 so allgemein, dass kein Grund zur Annahme besteht, dass sich die Ergebnisse explizit nicht auf die Misteltherapie beziehen.
Glaubwürdigkeit der Ergebnisse (QS9)
Insgesamt sind die Ergebnisse glaubwürdig, vor allem innerhalb der einzelnen Studien und bezogen auf die Zielgrößen, die in den vorliegenden Bericht in die Analyse einbezogen wurden. Die Ergebnisse von neun Studien 62,65,231,232,237,238,240–242 erscheinen plausibel und sind nachvollziehbar.
Für zwei Studien234, 235 wurde die Glaubwürdigkeit der Ergebnisse als unklar bewertet.
Ob die von Hübner et al. (2014)234 verwendete Online-Plattform mit Nähe zur Pharmaindustrie für eine Befragung zu KAM geeignet war, ist fraglich, da nicht ersichtlich ist, wer tatsächlich an der Befragung teilgenommen hat, und ob es sich bei den aktiven Mitgliedern von krebskompass.de bereits um eine Vorselektion von möglichen Teilnehmenden handelt oder ob das Online-Portal eine repräsentative Stichprobe aus betroffenen Patientinnen mit Brustkrebs darstellt. Krebskompass.de war jedoch die größte deutschsprachige Plattform für den Austausch von Patienten mit Krebs in Internetforen und die Autoren bestätigen, keinen Interessenskonflikt zu haben. Zum anderen fehlt in der Publikation eine Diskussion der Ergebnisse. Die Unzufriedenheit mit der Misteltherapie ist vergleichsweise zu den anderen Studien unerwartet hoch. Da eine kritische Reflexion der Ergebnisse und ihrer Limitationen fehlt, ist die Glaubwürdigkeit der Ergebnisse unklar.
Bei Klein et al. (2017)235 wird die Glaubwürdigkeit der Zahlen zur Inanspruchnahme komplementärer Verfahren als unklar bewertet, weil die Teilnahmerate mit 104 von 676 eingeladenen Personen (15 %) sehr gering war und deshalb mit erheblicher Selektion zu rechnen ist. Das Ausmaß der Inanspruchnahme liegt mit 93 % beim Fachpersonal deutlich über dem der anderen Studien. Die hohe Inanspruchnahme von KAM-Verfahren könnte ein Hinweis dafür sein, dass in der Studie ein Selektionsbias vorliegen könnte, der auch einen Einfluss auf die Häufigkeit der Inanspruchnahme der Misteltherapie hätte. Auch die starke Integration von verschiedenen Fachdisziplinen erweckt den Anschein, dass es sich dabei nicht primär um die Misteltherapie handelt, sondern um Ernährungsberatung durch Diätologen/Diätologen oder physikalische Therapie. Möglicherweise haben sich Ärztinnen und Ärzte, die bereits mit KIM-Verfahren vertraut sind und selbst die eigenen Patientinnen beraten, eher von der Befragung angesprochen gefühlt und teilgenommen. Die Ergebnisse zu den anderen Zielgrößen, wie Wissen zur Misteltherapie, Zugang zur, Erfahrungen mit und Akzeptanz der Misteltherapie erscheinen ebenso wie die Ergebnisse zur Patientinneninformation und Arzt-PatientenKommunikation als glaubwürdig für den Krankenhausbereich.
Übertragbarkeit der Ergebnisse auf die Zielpopulation (QS10)
In den Einschlusskriterien wurde das Einzugsgebiet der Studienpopulation auf den deutschsprachigen Raum eingegrenzt. Unterschiede könnte es zwischen Regionen, die Beratungszentren für komplementäre Medizin haben, und Regionen ohne Beratungszentren geben, weil sich der Zugang zu evidenzbasiertem Wissen unterscheiden könnte. Die Übertragbarkeit der Ergebnisse zu komplementären Verfahren auf die Misteltherapie hängt stark von der Art der Anwendung ab. Die Ergebnisse zu nicht-medikamentösen KIM-Verfahren wie Beten, Yoga oder Ernährungsberatung werden weniger Ähnlichkeit zur Misteltherapie haben als pflanzliche KAM, wie bei Drozdoff et al. (2018)231. Zur Prüfung einer Übertragbarkeit ist insbesondere auf die Definition der betrachteten KAM-Verfahren zu achten und wie hoch der Anteil der Mistelanwendenden an der Studienpopulation ist. Außerdem ist unklar, wie die Patientinnen zur Inanspruchnahme der Misteltherapie oder komplementären Verfahren im Allgemeinen befragt wurden. Die tatsächliche Häufigkeit der Inanspruchnahme in der Bevölkerung könnte höher sein als in den Studien, wenn nicht konkret nach der Misteltherapie gefragt wurde, sondern nur allgemein, ob die Patientin oder die behandelnde Person bereits komplementäre Verfahren angewendet hat oder nicht.
Bei der Messung der Inanspruchnahme der Misteltherapie ergibt sich zudem das Problem der Generalisierbarkeit durch eine Selektion der Patientinnen bei der Rekrutierung in den einzelnen Studien. Wenn in einem Beratungszentrum zu komplementärer Medizin bestimmte komplementäre Behandlungsmethoden für die Beratung bevorzugt verwendet werden, werden diese wahrscheinlich auch häufiger in der Studienpopulation verwendet. Außerdem könnten Ärztinnen beziehungsweise Ärzte oder Forschungsteams, die Studien zur Misteltherapie durchführen, bereits Einfluss auf deren Umfeld gehabt haben. Dadurch könnte die Inanspruchnahme der Misteltherapie für die Gesamtpopulation der Patientinnen mit Brustkrebs überschätzt werden.
Die Übertragbarkeit scheint für die deutsche Bevölkerung grundsätzlich für alle Studien gegeben, jedoch ist das Setting der meisten Studien eingeschränkt, entweder dadurch, dass nur eine spezielle Zielgruppe eingeschlossen wurde62, 241, nur in einem Studienzentrum rekrutiert wurde231, 234, 237, 239, 242 oder nur Bestrahlungspatientinnen betrachtet wurden240. Nachteil zweier Befragungen bei Ärztinnen und Ärzten ist das Alter der Daten, da die Ergebnisse bereits circa 20 Jahre alt sind.65, 238 Die Haltung der Ärztinnen und Ärzte könnte sich im Lauf der Jahre verändert haben. Daher ist die Übertragbarkeit auch für diese beiden Studien unklar.
Qualitative Studien
In Tabelle 65 sind die Ergebnisse der Qualitätsbewertung der qualitativen Studien zusammengefasst.
Tabelle 65: Übersichtstabelle CASP-Bewertung qualitative Studien
|
Q1 |
Q2 |
Q3 |
Q4 |
Q5 |
Q6 |
Q7 |
Q8 |
Q9 |
|
|
Brandenberger (2012) |
Ja |
Ja |
Ja |
? |
Ja |
? |
Ja |
Nein |
Ja |
|
Gschwendtner (2016) |
Ja |
Ja |
Ja |
Ja |
? |
? |
Ja |
? |
Ja |
|
Konitzer (2001) |
Ja |
Ja |
Ja |
? |
Ja |
Nein |
Nein |
Ja |
Ja |
Ja = Kriterium ist erfüllt. Nein = Kriterium ist nicht erfüllt. „?“ = Kann nicht beantwortet werden oder unklar.
Abschnitt A: Sind die Ergebnisse der Studie gültig?
Q1. Gab es eine klare Aussage zu den Zielen der Forschung?
Q2. Ist eine qualitative Methodik angemessen?
Q3. War das Forschungsdesign für das Ziel der Forschung angemessen?
Q4. War die Rekrutierungsstrategie für die Forschungsziele angemessen?
Q5. Wurden die Daten so gesammelt, dass das Forschungsproblem beantwortet werden konnte?
Q6. Wurde das Verhältnis zwischen Forschenden und Teilnehmenden angemessen bedacht?
Abschnitt B: Was sind die Ergebnisse?
Q7. Wurden ethische Fragen berücksichtigt?
Q8. War die Datenanalyse ausreichend gründlich?
Q9. Gibt es eine klare Aussage zu den Ergebnissen?
Q10. Welchen Nutzen hat die Forschung? (Freitextantworten siehe Abschnitt 9.4.2.2)
CASP = Critical Appraisal Skills Programme.
Die Ergebnisse der Qualitätsbewertung der beiden qualitativen Studien sind im Folgenden zusammengefasst. Da die Fragen in der originalen Fassung der CASP-Checkliste für qualitative Studien verwendet werden, dienten die Hinweise zum Ausfüllen als Orientierung zur Interpretation der Fragen.
Ziel der Forschung (Q1), Methodik (Q2) und Forschungsdesign (Q3)
Sowohl Brandenberger et al. (2012)230 als auch Gschwendtner et al. (2016)233 und Konitzer et al. (2001)236 stellen die Ziele ihrer Forschung klar dar. Ziel der Forschung von Brandenberger et al. (2012)230 ist die Erhebung qualitativer Aspekte der Lebensqualität von Patientinnen mit Brustkrebs mit komplementärer Misteltherapie zu subjektiven Dimensionen der Lebensqualität, wie der empfundenen Bewältigung der Erkrankung durch die Patientin mit Brustkrebs. Gschwendtner et al. (2016)236 untersuchen die Beweggründe von Krebspatientinnen für und gegen die Inanspruchnahme der Misteltherapie, um diese zu erfahren und Themenfeldern zuzuordnen. Konitzer et al. (2001)236 erörtern, „ob Mistel sich für die behandelten Patienten nach „Krebs“ anhört oder nach „Mittel gegen Krebs“ im Sinne einer festen Vokabel“.
Da alle drei Studien neue Erkenntnisse generieren wollen, ist eine qualitative Methodik angemessen. Zu den adressierten Zielgrößen der Interviewstudien, wie der Unterstützung der Krankheitsbewältigung der Patientin durch die Misteltherapie, welche Gründe es für die Inanspruchnahme der Misteltherapie gibt oder wie die Arzt-Patienten-Kommunikation aus Sicht der Behandelnden oder Patientinnen bewertet wird, gab es vor der Planung der Studien keine veröffentlichte Evidenz für den deutschsprachigen Raum.
Das Forschungsdesign der Interviews von Brandenberger et al. (2012)230 ist passend, auch wenn die Rekrutierung der Teilnehmerinnen Mängel aufweist. Das qualitative Design ist eine geeignete Möglichkeit, um Informationen zur Bewältigung der Brustkrebserkrankung von Patientinnen zu erhalten, da vor der Studie kaum Informationen zu diesem Thema veröffentlicht wurden. Gschwendtner et al. (2016)236 beschäftigen sich ebenfalls mit einem bis dahin kaum erforschten Thema, der Untersuchung der Beweggründe für die Inanspruchnahme der Misteltherapie und anderer KIM-Verfahren. Bei Konitzer et al. (2001)236 erscheinen das qualitative Forschungsdesign und der Forschungsansatz der „grounded theory“ geeignet, die assoziierten Gedankenmuster zur Misteltherapie zu identifizieren.
Rekrutierung (Q4), Datenerhebung (Q5) und Verhältnis zum Forschenden (Q6)
Brandenberger et al. (2012)230 rekrutierten im Paracelsus-Spital Richterswil in der Schweiz über den jeweiligen behandelnden Arzt beziehungsweise die behandelnde Ärztin. Die Beschränkung auf ein Krankenhaus bei der Rekrutierung kann sowohl dazu führen, dass die Repräsentativität der Stichprobe nicht ausreichend ist, um die Ergebnisse auf andere Patientinnengruppen übertragen zu können, als auch, dass sich das Patientinnenkollektiv eines Krankenhauses ähnlich ist und so ähnliche Aspekte in den Interviews genannt werden. Da aber nur vier Patientinnen mit Brustkrebs interviewt wurden, kann schon allein wegen zufälliger Abweichungen nicht von der Repräsentativität der Stichprobe ausgegangen werden, auch ist aufgrund der geringen Fallzahl nicht zu erwarten, dass alle Aspekte erfasst werden konnten. Die 30 Patientinnen mit Brustkrebs, als Teil der Studienpopulation von Gschwendtner et al. (2016)236, wurden in verschiedenen Einrichtungen rekrutiert: in einer Rehabilitationsklinik, auf der Palliativstation, in einer Selbsthilfegruppe, einer onkologischen Schwerpunktpraxis und in mehreren Akutkliniken. Die Rekrutierung der Patientinnen und Patienten war passend. In der Publikation von Konitzer et al. (2001)236 ist die Rekrutierung gar nicht beschrieben, jedoch erscheint die Auswahl des Settings in der Gruppentherapie als geeignet.
Die Datenerhebung über semi-strukturierte Interviews, basierend auf Interviewleitfäden, die in zwei Studien verwendet wurden, und die Datenanalyse nach der „grounded theory“ in der dritten Studie, ermöglichen den Forschenden, dass die Aspekte, die Zielgrößen der Befragung sind, auch angesprochen werden. Bei Brandenberger et al. (2012)230 wurden sowohl die Misteltherapie als auch die gesuchten Zielgrößen direkt adressiert. Obwohl bei Gschwendtner et al.236 eine direkte Erwähnung der Misteltherapie nicht Teil des Interviewleitfadens war, ist diese Intervention von Patientinnen häufig angesprochen worden. Somit konnte die Forschungsfrage auch für die Misteltherapie gut beantwortet werden, weil ausreichend Informationen von den Patientinnen genannt wurden. Bei Konitzer et al.236 wurden nur Patientinnen befragt, die bereits eine Misteltherapie erhalten.
Bei Brandenberger et al. (2012)230 war der Interviewende ein/e angehende/r Ärztin/Arzt und nicht die/der behandelnde Ärztin/Arzt. Eine Person, die vor der Befragung nicht in den Behandlungsprozess eingebunden ist, dennoch ist der Interviewende eine medizinische Fachperson, was bei integrativen Behandlungsmethoden schwierig sein könnte. Bei Gschwendtner et al. (2016)236 sind keine Angaben zum Verhältnis zwischen Interviewendem und Befragten zu finden, deswegen ist die Bewertung des Verzerrungspotenzials unklar. Das Verhältnis zum Forschenden ist auch bei Konitzer et al. (2001)236 nicht genauer erörtert und beschrieben.
Ethik (Q7), Bewertung der Analyse (Q8) und Ergebnisdarstellung (Q9)
Ob ethische Fragen bei der Studienplanung berücksichtigt und kritisch reflektiert wurden, können die Autorinnen des HTA-Berichts nicht direkt nachvollziehen, weil die Protokolle nicht verfügbar sind, aber da in den Publikationstexten geschrieben wurde, dass für die beiden Studien von Brandenberger et al. (2012)230 und Gschwendtner et al. (2016)236 jeweils ein Ethikvotum vorliegt, wird angenommen, dass sich die Autoren der Studie mit ethischen Fragestellungen beschäftigt haben. In der Studie von Konitzer et al.236 werden ethische Aspekte gar nicht adressiert. In der Diskussion erwähnt keine der Studien explizit ethische Fragestellungen.
Das Vorgehen bei der Datenanalyse ist in allen Publikationen benannt und erscheint für den Zweck angemessen. Die Transparenz bei der Beschreibung der Datenanalyse in der Publikation unterscheidet sich jedoch deutlich. Für die Studie von Brandenberger et al. (2012)230 sind die Schritte der Datenanalyse grundsätzlich berichtet, aber der Kodierungsprozess ist nicht transparent dargestellt und es wird keine Triangulation der Ergebnisse beschrieben. Auch die Schlussfolgerung in der Diskussion, dass die Misteltherapie zusätzlich zu „konkreten lebensqualitativen Wirkungen’230 auch eine Möglichkeit biete, eine „integrativere (und aktivere) Bewältigung von Krebserkrankungen anzubieten, was in einer subjektiv verbesserten QoL zum Ausdruck kommt/‘230, wird im Ergebnisteil nicht konkret belegt. Mehr Details zum Vorgehen bei der Analyse der Interviews hätten in der Publikation zu den Patientinnen mit Brustkrebs230 die Nachvollziehbarkeit der Analyse verbessern können.
Bei Gschwendtner et al. (2016)233 ist das Vorgehen bei der Analyse anhand der einzelnen Schritte gut geschildert, jedoch fehlt auch hier trotz der Nennung von Ankerbeispielen die Nachvollziehbarkeit der Analyse in der Publikation und es wurde keine Methodentriangulation angewendet. Die Ergebnisse werden nur im Diskussionsteil in den Kontext anderer Forschungsergebnisse gesetzt.
Konitzer et al. (2001)236 haben die eigenen Ergebnisse in den Kontext des verfügbaren Wissens gesetzt. Alle Kodierungen und das Vorgehen bei der Datenanalyse und der Herleitung der Metaphern ist transparent berichtet.
In allen drei Publikationen wurden für alle Ergebnisse die Aussagen mit Zitaten belegt und den Patientinnen zugeordnet.
Die Charakteristika der Studienteilnehmerinnen werden für Studien zur Patientinnen- in Tabelle 66 und für Studien zur Behandelndenperspektive in Tabelle 67 beschrieben. Für Patientinnen werden – soweit vorhanden – Angaben zum Alter und Tumorstatus beschrieben, sowie Informationen zum sozioökonomischen Status oder weiteren Merkmalen, die die Autoren der Studien erhoben haben. Für behandelnde Personen werden in der Regel das Alter, die Fachrichtung und sonstige Charakteristika berichtet.
Informationen zu Merkmalen, die mit der Verwendung der Misteltherapie durch Patientinnen und behandelnde Personen assoziiert waren, sind in Abschnitt 5.3.7.1 in Tabelle 69 „Häufigkeit der Inanspruchnahme von KAM und Misteltherapie’ dargestellt.
Die Patientinnen- oder Behandelndencharakteristika werden in den Studien nur für das gesamte Studienkollektiv berichtet, in dem in der Regel auch andere Krebsarten und andere komplementärmedizinische Verfahren vertreten sind. In den Studien von Moschen et al. (2001)237 und Tautz et al. (2012)241 wurde in der Darstellung der Patientencharakteristika zwischen KAM-Anwendenden und Nicht-Anwendenden von KAM unterschieden, bei Fremd et al. (2017)62 zwischen Interessenten für KAM-Verfahren und Patientinnen, die nicht an KAM-Verfahren interessiert sind.
Tabelle 66: Charakteristika der Patientinnen
|
Studie, Jahr |
Alter in Jahren Mittelwert (SD) oder Median (SW) |
Tumorklassifikation (TNM, UICC oder beschreibend) Anzahl(%) |
Weitere berichtete Charakteristika Anzahl(%) |
|
Quantitative Studien |
|||
|
Drozdoff (2018) |
Für alle Krebsarten: 62,2 (12,4) |
Frühes Stadium: 147 (32,8) Fortgeschritten: 201 (44,9) Rückfall: 13 (2,9) |
Krebsart (Brust, Eierstock oder andere gynäkologische Krebsarten); Verwendung von pflanzlichen KAM nach Alter: Bis 60 Jahre: 154 (79,8) Über 60 Jahre: 77 (30,2) |
|
Fasching (2007) |
Für alle Krebsarten: Median 53,6 (20–92) |
Für alle Krebsarten: Metastasen: 250 (24); Rückfall: 367 (37) |
Für alle Krebsarten: In einer Partnerschaft: 737 (71,6); Aktiv religiös: 637 (61,8); Menopause: 835 (81,3); Ausbildung: High School-Abschluss: 561 (54,5) Akademischer Abschluss oder Berufsausbildung: 767 (84,2) Aktives Arbeitsverhältnis: 438 (42,5) Krebsfälle in der Familie: 246 (23,9); TN in Präventionsprogramme: 840 (81,6); TN in Follow-up-Screening: 896 (87); Suchtverhalten: Aktive Raucher: 665 (64,6) Ehemalige Raucher: 195 (18,9) Alkoholabhängige: 53 (5,1) |
|
Fremd (2017) |
Patientinnen mit Interesse an KAM: 59,62 (11,95); Patientinnen ohne Interesse an KAM: 64,58 (12,28) |
Alle im fortgeschrittenen Stadium; Fernmetastasen: 508 (89,8) |
Alter bei der ersten Diagnose: Patientinnen mit Interesse an KAM: 51,72 (11,78), (n = 411); Patientinnen ohne Interesse an KAM: 56,93 (12,85) (n = 120) |
|
Hübner (2014) |
n. b. |
n. b.; Metastasen: 21 (26,3) keine Metastasen: 59 (73,8) |
n. b. |
|
Moschen (2001) |
KAM-Anwender: 50,7 (8,0) Nicht-Anwender: 55,2 (7,6) |
KAM-Anwender: Stadium 0–1: 22 (40); Stadium 2: 28 (51); Stadium 3–4: 5 (9); Nicht-Anwender: Stadium 0–1: 29 (46); Stadium 2: 30 (48); Stadium 3–4: 4 (6) |
KAM-Anwender (n = 55): Ausbildung: Pflichtschulabschluss: 18 (33) Technische Oberschule: 26 (47) Abitur/Universität: 11 (20) Dauer der Erkrankung: 3,8 Jahre (SD: 3,5); KPI:
Pflichtschulabschluss: 33 (53) Technische Oberschule: 24 (39) Abitur/Universität: 5 (8) Dauer der Erkrankung: 6,2 Jahre (SD: 5,6); KPI:
|
|
Schad (2018) |
Median: 57,4 (49,369,9) |
UICC-Stadium: Stadium 0: 64 (8,6) Stadium 1: 266 (35,9) Stadium 2: 253 (34,1) Stadium 3: 95 (12,8) Stadium 4: 61 (8,2) n. b.: 2 (0,3) |
Männlich: 2 (0,3) |
|
Schönekaes (2003) |
Median 54 (38–77) |
n. b.; Lokalrezidiv: 9 (4,4) Metastasen: 27 (13,3) |
Anwendung von KAM nach Berufsgruppen: Arbeiterinnen/einfache Angestellte: 46 (77,9); Qualifizierte Angestellte/Selbstständige: 27 (84,4) Hausfrauen: 38 (77,5) Rentnerinnen: 48 (76,1) |
|
Tautz (2012) |
KAM-Nutzende: 56 (10) Keine Nutzenden 61 (11) |
Alle im fortgeschrittenen Stadium (haben entweder ein Rezidiv, Metastasen oder eine weitere Krebsdiagnose) |
KAM-Anwendender (n = 107): Ausbildung: Keine formelle Ausbildung: 6 (6) Abgeschlossene Ausbildung: 67 (68) Universitätsabschluss: 26 (26) Behandlungsziel: Palliativ: 45 (45) Kurativ: 56 (55) KAM-Nicht-Anwender (n = 63): Ausbildung: Keine formelle Ausbildung: 11 (21) Abgeschlossene Ausbildung: 33 (62) Universitätsabschluss: 9 (17) Behandlungsziel: Palliativ: 11 (18) Kurativ: 52 (83) |
|
Templeton (2013) |
Median 61 (2994) |
I: 99 (29) IIA: 120 (35) IIB: 68 (20) IIIA/B: 55 (16) |
Partner/in lebt im Haushalt: 258 (75) Leben in ländlicher Region: 245 (72) Private Krankenversicherung: 139 (41); Ausbildung: Keine formelle Ausbildung: 107 (31) Abgeschlossene Ausbildung: 163 (48) Universitätsabschluss: 67 (20) Geburtsland: Schweiz: 265 (77) EU: 50 (15) Sonstige: 27 (8) Körperliche Aktivität: 232 (69) Postmenopausal: 298 (87) Medikamentös behandelte Begleiterkrankungen können nicht zusammengefasst werden. |
|
Qualitative Studien |
|||
|
Brandenberger (2012) |
57,7 (10) |
n. b; Knochenmetastasen: 1 (25) |
n. b. |
|
Gschwendtner (2016) |
Gesamt: 59,6 (10,6) (Brustkrebs separat n. b.) |
n. b. |
n. b. |
|
Konitzer (2001) |
51,6 (3,65) |
n. b. |
n. b. |
EU = Europäische Union. KAM = Komplementäre und alternative Medizin (KAM, da Benennung in der Studie). KPI = Karnofsky Performance Index. N: Anzahl; n. b.: nicht beschrieben; n. a.: nicht anwendbar. SD = Standarddifferenz. SW = Spannweite. TNM = T: Tumor, N: Nodus, M: Metastasen. TN = Teilnehmerin. UICC = Union Internationale Contre le Cancer.
Patientinnenperspektive – quantitative Studien
Für das Alter der Patientinnen ist in den sieben quantitativen und zwei qualitativen Studien entweder der Mittelwert oder der Median angegeben. Als Lagemaß ist bei vier quantitativen Studien62, 231, 237, 241 der Mittelwert und bei drei quantitativen Studien232,240,242 der Median angegeben. Für die beiden qualitativen Studien230, 233 ist als Lagemaß für das Alter der Mittelwert verfügbar. Der Median für die Mittelwerte des Alters der Patientinnen in den vier Querschnittstudien von Drozdoff, Fremd, Moschen und Tautz liegt bei 59,3 Jahren (Spannweite: 53,1 bis 62,2 Jahre). Der Median für das Alter der drei Querschnittstudien von Fasching, Schönekaes und Templeton beträgt 54 Jahre (Spannweite: 53,6 bis 61 Jahre). Der Median der beiden Mittelwerte für das Alter der Patientinnen aus den qualitativen Studien liegt bei 58,6 Jahren (Spannweite: 57,7 bis 59,6 Jahre). Insgesamt sind bei den Studien, die das Alter getrennt nach KAM-Anwendenden beziehungsweise Interessenten und Nicht-Anwendenden berichten62, 237, 241, die Patientinnen in der Mistelgruppe im Durchschnitt etwa fünf Jahre jünger als in der Gruppe ohne Interesse an der Misteltherapie. Für diese drei Studien ist das Alter der Patientinnen in der Mistelgruppe im Median 56 Jahre (Spannweite: 50,7 bis 59,62 Jahre) und in der Vergleichsgruppe 61 Jahre (Spannweite: 55,2 bis 64,58). Die Teilnehmerinnen der Studie von Drozdoff et al. (2018)231 sind mit durchschnittlich 62 Jahren älter als die Patientinnen in den anderen Studien.
Alle quantitativen Studien62, 231, 232, 234, 237, 240–242 beschreiben in irgendeiner Weise den Schweregrad der Krebserkrankung, bei zwei Studien über die Tumorklassifikation237, 242, aber die meisten Studien beschreiben die aufgetretenen Rezidive (Rückfälle) und/oder Metastasen62, 231, 232, 234, 240, 241. Bei Drozdoff et al. (2018) befinden sich zu Beginn der Studie 45 % im fortgeschrittenen Stadium der Erkrankung. Von den Teilnehmerinnen der Online-Umfrage von Hübner et al. (2014)234 gaben 26 % an, Metastasen gehabt zu haben, 74 %, dass nicht. Fasching et al. (2007)232 berichten nur für alle Krebsarten, dass 24 % bereits Metastasen hatten und 37 % der Patientinnen einen Rückfall erlitten haben, aber machen keine Angaben für die Gruppe der KAM-Anwendenden separat. Fremd et al. (2017)62 beschreiben keine Zahlen zu Merkmalen, die mit dem Erkrankungsstatus in der
Studienpopulation zusammenhängen, da sich alle bereits in einem fortgeschrittenen Stadium befinden und 90 % auch an Fernmetastasen leiden. In der Studie von Moschen et al. (2001)237 wurde der Erkrankungsstatus vor der Operation auf einer Skala von null bis vier gemessen, jedoch wurde nicht berichtet, wie die Skala von null bis vier interpretiert werden kann. Vermutlich handelt es sich um den Tumorstatus nach UICC. Nur in einer Studie, von Templeton et al. (2013)242, sind konkrete Angaben zu den Tumorstadien der Patientinnen berichtet, in den anderen Studien sind nur weniger konkrete Beschreibungen zu finden, ob Patientinnen bereits Metastasen oder Rückfälle hatten oder nicht. In der Studie von Tautz et al. (2012)241 wurden, wie bei Fremd et al. (2017)62, nur Patientinnen mit fortgeschrittenem Stadium eingeschlossen, das definiert wird über das Vorliegen von Rezidiven, Metastasen oder weiteren Krebsdiagnosen. Der konkrete Tumorstatus nach TNM oder UICC wird in den Publikationen nicht mehr genannt.
Weitere berichtete Charakteristika unterscheiden sich deutlich zwischen den Studien. Diese reichen von sozioökonomischen Merkmalen bis hin zu Informationen über die Erkrankung. Während in den Publikationen von Drozdoff et al. und Fremd et al.62, 231 nur eine weitere Unterteilung des Alters mit Zusammenhang zur Inanspruchnahme präsentiert wird, liefern andere Publikationen zahlreiche zusätzliche Informationen232, 237, 238, 240–242.
Von den beiden Publikationen, die in die Analyse zu weiteren Zielgrößen außer der Inanspruchnahme eingeschlossen sind, berichten nur Moschen et al. (2001)237 weitere Merkmale, Hübner et al. (2014)234 nicht. In der Studie von Moschen et al. fällt beim Bildungsstand auf, dass der Anteil der Patientinnen mit Abitur oder Universitätsstudium bei den Anwendenden von KAM mit 20 % höher ist als bei den NichtAnwendenden, mit 8 %.
Für die Patientinnen in der Studie von Fasching et al. (2007)232 wurde eine ganze Reihe von Charakteristika berichtet, beispielsweise die Ausbildung, das Suchtverhalten, die Teilnahme an Nachsorgeprogrammen oder die familiäre Situation, jedoch nicht getrennt für Patientinnen mit Brustkrebs, sondern für alle Patientinnen in der Studie.
In der Publikation von Schad et al. (2018)239 ist der Schweregrad der Krebserkrankung über die UICC-Klassifikation abgebildet. 70 % der Patientinnen und Patienten befinden sich in den Stadien I und II. Der Anteil der Patientinnen und Patienten im Stadium 0 entspricht in etwa dem Anteil von sehr schweren Fällen, die bereits Metastasen haben. Das Alter der Patientinnen und zwei männlichen Patienten entspricht mit im Median 57,4 Jahren in etwa dem Durchschnitt der eingeschlossenen Publikationen.
Schönekaes et al.240 vergleichen die Anwendung von KAM nach der Zugehörigkeit zu Berufsgruppen. Ähnlich zu den Ergebnissen bezogen auf den Bildungsstand der Anwenderinnen zeigt sich auch hier, dass die Verwendung von KAM unter den Selbständigen und qualifizierten Angestellten mit 84,4 % am höchsten ist, verglichen mit den anderen Gruppen, in denen zwischen 76,1 und 77,9 % der Patientinnen KAM anwenden. Die Merkmale sind für Patientinnen mit Misteltherapie nicht getrennt berichtet, jedoch wenden in 59 % der KAM-Nutzenden die Misteltherapie an.
Tautz et al. (2012)241 unterscheiden zwischen KAM-Anwendenden und KAM-Nicht-Anwendenden. Unter den KAM-Anwendenden ist der Anteil der Patientinnen mit einem höheren Ausbildungsniveau größer als in der Nicht-Anwendergruppe. Bei den Anwenderinnen haben 68 % eine abgeschlossene Berufsausbildung und 26 % einen Universitätsabschluss. Bei den Nicht-Anwendenden haben 62 % der Patientinnen eine abgeschlossene Berufsausbildung, aber nur 17 % einen Universitätsabschluss. Auch das angestrebte Behandlungsziel (palliativ oder kurativ) wurde erhoben. Unter den KAM-Anwendenden war der Anteil der Patientinnen in einem palliativen Setting mit 45 % deutlich höher als in der NichtAnwendergruppe mit 18 %.
Templeton et al. (2013)242 berichten neben dem Ausbildungsstand auch das Geburtsland der Patientin und ob der/ Partner beziehungsweise die Partnerin der Patientin mit Brustkrebs im selben Haushalt lebt (75 %), ob die Patientin in der Stadt oder in einer ländlichen Region lebt (72 %) und ob eine private Krankenversicherung vorliegt (41 %). In der Studienpopulation haben 31 % keine formelle Ausbildung, 48 % haben eine abgeschlossene Ausbildung und 20 % einen Universitätsabschluss. Drei Viertel der Patientinnen (77 %) sind in der Schweiz geboren, 15 % in der EU sowie 8 % in anderen Staaten.
Patientinnenperspektive – qualitative Studien
Die vier Patientinnen von Brandenberger et al. (2012)230 sind 42, 56, 63 und 69 Jahre alt. Zum Tumorstatus ist keine konkrete Angabe berichtet, außer dass eine Patientin aufgrund von Knochenmetastasen behandelt wird. Soziodemografische Daten zu den befragten Patientinnen sind in der Publikation nicht berichtet.
Gschwendtner et al. (2016)233 berichten das durchschnittliche Alter der Studienpopulation nur für alle Krebsarten und nicht getrennt für Brustkrebs. Unterschieden wird nach Befragten, die bereits eine Misteltherapie verwenden oder verwendet haben (Mittelwert: 57,8 (SD: 9,4) Jahre), Personen, die keine Misteltherapie verwenden (Mittelwert: 59,0 (SD: 10,8) Jahre) und solchen, die in den Interviews die Misteltherapie nicht angesprochen haben (Mittelwert: 63,8 (SD: 10,7) Jahre). Sonstige Charakteristika zu den Patientinnen sind nicht berichtet. Eine objektive Beurteilung, ob die Misteltherapie mit einem kurativen oder palliativen Behandlungsziel eingesetzt wurde, war geplant, aber laut Angaben der Autoren der Studie nicht möglich. Die subjektive Wahrnehmung der Patientinnen zur eigenen Prognose unterschied sich zu stark von einem nach aktuellen Standards der Schulmedizin erreichbarem Behandlungsziel.
Konitzer et al. (2001)236 beschreiben neben dem durchschnittlichen Alter von 51, 6 Jahren (SD: 3,65 Jahre) keine weiteren Patientinnencharakteristika.
Studien aus der Perspektive des behandelnden Fachpersonals
|
Tabelle 67: |
Charakteristika behandelndes Fachpersonal |
|
Studie, Jahr |
Alter in Fachrichtung und Setting Weitere berichtete Jahren Charakteristika Median (SW) |
|
Kalder |
Median*: Gynäkologie: Geschlecht: weiblich: 174 (50,0); |
|
(2001) |
37,6; – Uni-Frauenklinik:71 (20,4) männlich: 174 (50,0); bis 40: 193 – Krankenhaus: 152 (43,7) Erfahrung im Arztberuf: (55,5) – Niedergelassener Bereich: 125 (35,9) - Bis 10 Jahre: 143 (41,1) 41 bis 50: 80 Berufliche Position im stationären Bereich: - 11 bis 20 Jahre: 117 (33,6)
, (88,5)
(11,5) Akademische Ausbildung:
(21,8) |
|
Klein |
Median: Gynäkologinnen und Gynäkologen mit dem Geschlecht weiblich: 35 (32,7); |
|
(2017) |
47 (3^—71) Schwerpunkt Onkologie; männlich 71 (67,3); Mitglieder der AGO können auch Nicht- Medizinische akademische Titel: Mediziner sein. 60 (56,7) |
Mitarbeitende eines zertifizierten Brustkrebszentrums 81 (76,0);
Mitarbeitende eines zertifizierten gynäkologischen Krebszentrums: 60 (56,7)
|
Münstedt |
Median* |
Niedergelassene Ärztinnen |
Geschlecht weiblich: 48 (23,6) |
|
(2000) |
45,9; |
und Ärzte: |
- Gruppierung anhand der Häufigkeit der |
|
bis 40: 33 |
- Allgemeinmedizin: 66 |
Verordnung von Mistelpräparaten: |
|
|
(16,3) |
(32,7); |
- Überwiegend oder ausschließlich Anwendung |
|
|
41 bis 50: 90 |
- Innere Medizin: 51 |
der Misteltherapie bei KIM: 71 (35,1) |
|
|
(44,4) |
(25,2); |
- Misteltherapie als eine mögliche KIM bei |
|
|
> 50: 79 |
- Gynäkologie: 32 (15,8); |
Krebspatientinnen: 160 (79,2) |
|
|
(39,3) |
|
- Keine Verwendung von KIM: 42 (20,8) |
|
|
(22,8) |
* Der Median wurde von den HTA-Autorinnen aus den prozentual in Altersgruppen angegebenen Werten berechnet.
**Die Gruppe der Chefärzte beinhaltet neben Chefärzten auch Abteilungsleiter und Ordinarien.
AGO = Arbeitsgemeinschaft Gynäkologische Onkologie. HTA = Health Technology Assessment. KIM = Komplementäre und integrative Medizin. n. b. = Nicht beschrieben. SW = Spannweite.
Die drei Studien65, 235, 238 umfassen insgesamt 654 Personen aus dem medizinischen Fachpersonal. Der Median für das Alter der behandelnden Personen beträgt 45,9 Jahre (Spannweite: 37,3 bis 47 Jahre). Für Klein et al. und Münstedt et al. wurden aus den prozentual in Altersgruppen angegebenen Werten die Mediane berechnet. Der Median des Frauenanteils in den drei Studien betrug 32,7 % (Spannweite: 23,6 bis 50 %).
Das Setting, in dem die Ärztinnen und Ärzte beziehungsweise die Angehörigen sonstiger Fachkreise tätig waren, beinhaltet den Sektor (stationär oder niedergelassen), in dem die Personen tätig sind und deren Fachqualifikation. Die Studie von Kalder et al.65 umfasst niedergelassene Frauenärzte und ‑ärztinnen (35,9 %) sowie Ärztinnen und Ärzte in gynäkologischen Abteilungen des stationären Bereichs, 43,7 % in kleinen und mittelgroßen Krankenhäusern und 20,4 an der Universitäts-Frauenklinik. Knapp die Hälfte (49,1 %) der Befragten sind Assistenzärzte und ‑innen, 27,3 % sind Oberärztinnen und ‑ärzte sowie 18,3 % Chefärztinnen und ‑ärzte, Abteilungsleiter/in oder Ordinarii.
In der Studie von Klein et al. (2017)235 wurden alle Mitglieder der AGO mit dem Schwerpunkt onkologische Gynäkologie eingeladen. Die AGO umfasst auch Angehörige nicht-medizinischer Fachkreise und Kollaborationspartnerinnen und Kollaborationspartner der Gesellschaft.
In der Studie von Münstedt et al. (2014)187 wurden ausschließlich niedergelassene Ärztinnen und Ärzte aller Fachrichtungen befragt. Am häufigsten sind die Fachrichtungen Allgemeinmedizin (32,7 %) und Innere Medizin (25,2 %) vertreten.
Für alle drei Studien werden weitere Charakteristika berichtet, die vor allem mit der beruflichen Qualifikation und Berufserfahrung zusammenhängen. Knapp 60 % der Ärztinnen und Ärzte in der Studie von Kalder et al. sind seit mehr als zehn Jahren im Arztberuf tätig, davon 25,3 % sogar über 20 Jahre. Die meisten der befragten Ärztinnen und Ärzte leben in einer Stadt (88,5 %). Zwei Drittel der Ärztinnen und Ärzte haben einen akademischen Titel, 67,2 % eine Promotion und 10,4 % eine Habilitation.
Klein et al. (2017)235 berichten, dass 56,7 % der Befragten einen akademischen Abschluss in Medizin mit Titel (Dr. med. oder MD) haben. Ein Drittel der Befragten hat sogar eine höhere Qualifikation als eine Professur. Ein großer Anteil der Ärztinnen und Ärzte arbeitet in einem zertifizierten Zentrum für Brustkrebs und/oder in einem zertifizierten gynäkologischen Krebszentrum.
Münstedt et al.187 charakterisieren die Studienteilnehmenden nur über die von den Autoren der Studie getroffene Einteilung anhand der Häufigkeit der Verordnung von Mistelpräparaten in „Misteltherapierenden“, die bei einer Anwendung von komplementärer Medizin überwiegend oder ausschließlich die Misteltherapie anwenden (35,1 %), Ärztinnen beziehungsweise Ärzte, die die Misteltherapie als eine mögliche Option für ein komplementäres Verfahren bei Krebspatientinnen sehen (79,2 %) und Ärztinnen beziehungsweise Ärzte, die keine komplementären Verfahren anwenden (20,8 %).
Im Folgenden werden die Ergebnisse zu jeder der neun Zielgrößen (sieheTabelle 63) jeweils getrennt nach Perspektive und Studientyp zusammengefasst. Für Ankerbeispiele aus den qualitativen Studien wird immer auf die Ergebnisdarstellung der qualitativen Inhaltsanalyse in Abschnitt 5.3.7.10 verwiesen, um Doppelungen zu vermeiden.
-
5.3.7.1 Häufigkeit der Inanspruchnahme oder Verordnung der begleitenden
In dreizehn Studien62, 65, 231–235, 237–242 mit 4.075 Teilnehmenden werden Ergebnisse zur Häufigkeit der Inanspruchnahme von KIM und der Misteltherapie berichtet. Die qualitative Studie von Gschwendtner et al. (2016)233 berichtet neben qualitativen Ergebnissen auch quantitative Ergebnisse für die Inanspruchnahme der Misteltherapie und Merkmale, die mit der Anwendung der Misteltherapie statistisch signifikant assoziiert sind. Deswegen wird die Studie für diese Zielgröße gemeinsam mit den Querschnittstudien berichtet und nicht getrennt als qualitative Studie.
Neben Zahlen zur Inanspruchnahme wird beschrieben, durch welche Merkmale sich Patientinnen, die eine Misteltherapie in Anspruch nehmen, von Patientinnen, die keine Misteltherapie in Anspruch nehmen, unterscheiden. Die Zahlen zur Inanspruchnahme und die Merkmale, die mit der Inanspruchnahme assoziiert sind, werden nacheinander getrennt berichtet, für die neun Studien aus Patientinnenperspektive62, 231–234, 237, 240–242 und die drei Studien aus der Perspektive des behandelnden Fachpersonals65, 235, 238.
Patientinnenperspektive – quantitative Studien
Die zehn Studien aus Patientinnenperspektive62, 231–234, 237,239–242 mit insgesamt 3.421 Patientinnen mit Brustkrebs berichten Ergebnisse zur Häufigkeit der Inanspruchnahme der Misteltherapie. Die Häufigkeit der Inanspruchnahme der begleitenden Misteltherapie wird definiert als Anteil der Patientinnen mit Brustkrebs, die eine begleitende Misteltherapie erhalten oder erhalten haben. Der entsprechende Wert wurde den Publikationen entweder direkt entnommen oder aus den dort berichteten Angaben berechnet. Alle genannten Informationen zur Häufigkeit der Inanspruchnahme der Misteltherapie beziehungsweise zur Verwendung von KIM-Verfahren, sind in Tabelle 68 aufgelistet.
Die Anteile für die Inanspruchnahme von KIM beziehungsweise der Misteltherapie werden immer im Verhältnis zu allen Patientinnen mit Brustkrebs angegeben. Es werden sowohl die Ergebnisse zur Inanspruchnahme von KIM als auch zur Misteltherapie genannt. Die prozentualen Angaben beziehen sich sowohl in der Spalte „Anzahl Patientinnen mit KIM“ als auch in der Spalte „Anzahl Patientinnen mit Misteltherapie“ auf die Zahl in der Spalte „Anzahl Patientinnen mit Brustkrebs“.
|
Studie, Jahr |
Anzahl Patientinnen mit Brustkrebs (%)* |
Anzahl Patientinnen mit KIM (%) |
Anzahl Patientinnen mit Misteltherapie** (%) |
|
Drozdoff (2018) |
361 (80,6) |
264 (73,1) |
84 (18,8)*** |
|
Fasching (2007) |
796 (77,3) |
399 (50,1) |
297 (37,3) |
|
Fremd (2017) |
580 (100) |
251 (56,4) |
87 (15) |
|
Gschwendtner (2016) |
30 (34) |
8 (26,7) |
8 (26,7) |
|
Hübner (2014) |
80 (100) |
61 (76,3) |
10 (12,5) |
|
Moschen (2001) |
117 (100) |
55 (47) |
27 (23,1) |
|
Schad (2018) |
741 (100) |
238 (32,1)**** |
238 (32,1) |
|
Schönekaes (2003) |
203 (100) |
159 (78) |
94 (46,3) |
|
Tautz (2012) |
170 (100) |
107 (63) |
55 (32,4) |
|
Templeton (2013) |
342 (100) |
159 (46) |
25 (7,3) |
*Anteil der Patientinnen mit Brustkrebs an der gesamten Studienpopulation in Klammern.
**Anteil der Patientinnen mit Misteltherapie bezogen auf alle Patientinnen mit Brustkrebs.
***In der Publikation ist nur die Anzahl aller Mistelanwenderinnen angegeben, einschließlich Patientinnen mit Eierstockkrebs.
****Nicht-pharmakologische Therapien sind getrennt berichtet und werden von 96,1 % der Patientinnen verwendet, werden hier aber nicht einbezogen, da die Misteltherapie nicht Teil der nicht-pharmakologischen Interventionen ist.
KIM = Komplementäre und integrative Medizin.
Im Median verwenden 24,9 % (Spannweite: 7,3 bis 46,3 %) der Patientinnen mit Brustkrebs Mistelextrakte. In der Summe beträgt die Anzahl der Mistelanwenderinnen 925 Patientinnen (27,1 % der Patientinnen mit Brustkrebs). Die Ergebnisse der univariaten Analysen und multivariaten Regressionsanalysen, die unten in Tabelle 69 berichtet werden, beziehen sich jedoch auf die Inanspruchnahme von komplementären Verfahren im Allgemeinen. Da die Misteltherapie in fast allen Studien, bis auf die Studien Gschwendtner et al. (2016)236 und Schad et al. (2018)239, nur eines der betrachteten komplementären Verfahren ist, wird im folgenden Abschnitt für jede der Studien in Tabelle 68 auch die Gesamtanzahl der Patientinnen beschrieben, die komplementäre Methoden anwenden.
In der Studienpopulation von Drozdoff et al. (2018)231 lag der Anteil der Patientinnen mit Brustkrebs bei 80,8 % der Teilnehmerinnen. Davon hatten bereits 77,6 % pflanzliche KAM verwendet. Eine Misteltherapie haben in der Studie insgesamt 84 Patientinnen verwendet. Das entspricht 18,8 % aller Patientinnen in der Studie, inklusive Patientinnen mit Eierstockkrebs. Da unklar ist, wie viele der Mistelanwenderinnen Patientinnen mit Brustkrebs sind, wird der Anteil nicht auf die Patientinnen mit Brustkrebs bezogen, sondern auf alle.
Fasching et al. (2007)232 berichten die Zahlen zur Inanspruchnahme für die Patientinnen mit Brustkrebs separat. Von den 796 Patientinnen mit Brustkrebs verwenden 399 (50,1 %) komplementäre Methoden und 297 (37,3 %) eine Misteltherapie.
In der Studie von Fremd et al. (2017)62 lag der Anteil der KAM-Anwenderinnen mit 251 Patientinnen bei 56,4 % und bei den Mistelanwenderinnen mit 87 Patientinnen bei 15 %. Ein grundsätzliches Interesse an KAM äußerten 436 der 580 Patientinnen (75 %).
In der Studie von Gschwendtner et al. (2016)233 wurden 30 Patientinnen mit Brustkrebs interviewt (34 % der gesamten Studienpopulation), von denen acht die Misteltherapie anwendeten (26,7 % der Patientinnen mit Brustkrebs) und 19 die Misteltherapie nicht anwendeten (63,3 % der Patientinnen mit Brustkrebs). In drei Interviews wurde die Misteltherapie nicht erwähnt (10 %).
In der Studie von Hübner et al. (2014)234 ist nicht eindeutig ersichtlich, wie viele Patientinnen mit Brustkrebs eine Standardtherapie erhalten und zusätzlich Mistelextrakte verwendeten. Es ist nur
beschrieben, dass 67 Patientinnen (83,75 %) derzeit eine Standardtherapie erhalten und 61 Patientinnen (76,25 %) KAM verwenden. Zehn Patientinnen wenden eine Misteltherapie an (12,5 %).
In der Studie von Moschen et al. (2001)237 wenden 55 der 117 Patientinnen KAM-Verfahren an (47 %). Eine Misteltherapie erhielten 27 Patientinnen (23,1 %).
Schad et al. (2018)239 berichten die Misteltherapie als getrennte Intervention und berichten sonst nur nicht-pharmakologische Interventionen. In Tabelle 69 werden daher die Patientinnen mit KIM-Verfahren gleichgesetzt mit den Patientinnen mit Misteltherapie, nämlich 32,1 % aller 238 Patientinnen und Patienten mit Brustkrebs.
Bei Schönekaes et al. (2003)240 liegt die Inanspruchnahme von komplementären oder alternativen Therapieformen mit 159 Anwenderinnen bei 78 % und die Inanspruchnahme der Misteltherapie mit 94 Patientinnen bei 46,3 %.
In der Studie von Tautz et al. (2012)241 wenden 107 Patientinnen KAM-Verfahren an (63 %). Eine Misteltherapie wenden 55 Patientinnen an (32,4 %). In der Publikation ist beschrieben, dass zusätzlich zu den 170 Patientinnen, die einen Fragebogen ausgefüllt haben, Informationen aus den Patientenakten von zwölf Patientinnen verwendet werden, die selbst nicht in der Lage waren, den Fragebogen auszufüllen. In der Ergebnisdarstellung und in der statistischen Analyse erscheinen diese zwölf Patientinnen in der Darstellung der quantitativen Ergebnisse nicht mehr, deswegen beziehen sich die Prozentangaben immer auf 170 Patientinnen.
In der Studie von Templeton et al. (2013)242 wenden 159 der 342 Patientinnen KAM-Verfahren an (46 %). 25 (7,3 %) wenden eine Misteltherapie an.
Merkmale, die bei Patientinnen mit Brustkrebs bei Anwendung der Misteltherapie häufiger vorkommen als bei Nicht-Anwendung
Sieben der Studien62, 231–233, 240–242, die für die Bewertung der Inanspruchnahme eingeschlossen sind, berichten soziodemografische, krankheits- oder therapiebezogene Merkmale, die bei Patientinnen mit Brustkrebs häufiger bei Anwendung komplementärer Verfahren vorkommen als bei Nicht-Anwendung. In zwei Studien, Drozdoff et al. und Fasching et al.231, 232, beziehen sich die Prädiktoren für die Inanspruchnahme komplementärer Verfahren auch auf gynäkologische Krebsarten. Angaben zum Anteil der Patientinnen mit Brustkrebs sind in Tabelle 68 beschrieben.
Eine Studie, von Gschwendtner et al.233, berichtet eine univariate Analyse zum Einfluss des Alters auf die Inanspruchnahme der Misteltherapie. Die Ergebnisse beziehen sich auf alle Krebsarten in der Studie: Brust‑, Prostata‑, Lungen- sowie Darmkrebs und sonstige Krebsdiagnosen. Der Anteil der Mistelanwenderinnen mit Brustkrebs liegt im Vergleich zu den anderen Krebsarten bei 44,4 %.
Sofern Ergebnisse der statistischen Analysen zu Merkmalen, die mit der Häufigkeit der Inanspruchnahme assoziiert sind, auch für andere Zielgrößen innerhalb der Domäne Patienten- und soziale Aspekte relevant sind, werden diese zusätzlich im jeweiligen Unterkapitel berichtet. Dies trifft für Hübner et al. (2014)234 und Moschen et al. (2001)237 zu.
Keine Publikation bezieht die Merkmale nur auf die Misteltherapie. Die Studien in Tabelle 69 beziehen die Merkmale auf alle in der Studie eingeschlossenen Verfahren.
Diese assoziierten Merkmale ergeben sich aus unterschiedlichen statistischen Auswertungsmethoden. Vier Studien62, 231, 232, 242 wenden eine multivariate Regressionsanalyse an, um mögliche Prädiktoren für die Inanspruchnahme zu finden und drei Studien233, 240, 241 beschreiben statistische Zusammenhänge über t‑Tests oder Chi2-Tests. In Tabelle 69 sind die Studien mit einer multivariaten Regressionsanalyse berichtet und in Tabelle 70 folgen die Ergebnisse der univariaten Analysen. Die Ausprägungen der Patientinnencharakteristika sind für alle Studien zu den Patienten- und sozialen Aspekten in Abschnitt 5.3.6 in Tabelle 66 beschrieben. Tabelle 69 und Tabelle 70 berichtet nur Assoziationen mit den zugehörigen p‑Werten.
|
Multivariate Regressionsanalyse Tabelle 69: Merkmale, die in einer multivariaten Regressionsanalyse mit der Inanspruchnahme von KIM-Verfahren assoziiert sind |
|||
|
Studie, Jahr |
Faktoren, die analysiert wurden (uni- oder multivariat) |
Statistisch signifikante Prädiktoren für KIM-Anwendung: Effektgröße (95%-KI)/p‑Wert |
Statistische Methoden** |
|
Drozdoff (2018) |
Alter (bis 60 Jahre und > 60 Jahre), Therapie (Chemo‑, Hormontherapie, Bisphosphonate), Therapielinie bei Brustkrebs (neoadjuvant, adjuvant, Metastasen (Erst‑, Zweit‑, Dritt‑, oder Viertlinientherapie und höher), Rückfall (Erstlinientherapie, Zweitlinientherapie und höher), Therapielinie bei Eierstockkrebs (adjuvant, Rückfall) |
Jüngeres Alter: für über 60-Jährige (OR): 0,61 (0,39; 0,97)/0,038; Bei Brustkrebs Metastasen in Erstlinientherapie (OR): 0,394 (0,159; 0,973)/p‑Wert n. b. |
Multivariate logistische Regression, Variablenselektion n. b. |
|
Fasching (2007) |
Alter, Familienstand, Erkrankungsstatus (beschwerdefrei, Rezidiv, Metastasen), Schulbildung, Berufsausbildung, Anzahl der Kinder, Menopausenstatus, Religiosität, Vorliegen eines ärztlichen Attests, aktive Teilnahme in Nachsorgeprogramm, Raucherstatus, Alkoholmissbrauch, Ende der Partnerschaft während der Erkrankung, gestärkte Partnerschaft, Krebsart |
Bildungsstand: Abitur (OR): 1,597 (1,053; 2,423)/0,028; Kein Schulabschluss (OR): 0,463 (0,270; 0,793)/0,005 Berufliche Tätigkeit: Angestellte (OR): 2,077 (1,374; 3,140)/0,001; Arbeitsunfähigkeit (OR): 0,452 (0,267; 0,765)/0,003 Partnerschaft: Ende der Partnerschaft während der Erkrankung (OR): 4,937 (1,085; 22,463)/0,039; Gestärkte Partnerschaft (OR): 0,611 (0,377; 0,990)/0,045; Unveränderter Beziehungsstatus (OR): 0,521 (0,345; 0,788)/0,002 Verlauf der Erkrankung: Lokales Rezidiv oder Metastasen (OR): 1,790 (1,103; 2,906)/0,019 Sonstiges: Aktive Teilnahme an Nachsorgeprogrammen (OR): 3,127 (1,612; 6,067)/0,001 |
Schrittweise Vorwärtsselektion; Signifikanzniveau: p < 0,05; Multivariate logistische Regression |
|
Fremd (2017) |
Im Regressionsmodell: Alter, Alter bei Diagnosestellung, Fernmetastasenstatus zum Diagnosezeitpunkt, vorhergehende Bestrahlung, vorhergehende Chemotherapie |
Geburtsjahr (OR): 1,042 (0,040; 1,083)/0,040; bereits Metastasen (OR): 0,404 (0,227; 0,719)/0,002) |
Multivariate logistische Regression, Variablenselektion n. b. |
|
Templeton Körperliche Aktivität, Bildungsstand, (2013) Alter (10-Jahresgruppen), Ernährung, Begleiterkrankungen, Menopausenstatus |
Alter (Erhöhung um 10 Jahre) (OR): 0,7 (0,6; 0,9)/ < 0,01; Bildungsstand (OR): 1,6 (1,1; 2,2)/< 0,01; Körperliche Aktivität (OR): 2,0 (1,2; 3,3)/< 0,01 |
Prospektive Hypothesengenerierung, binäres logistisches Regressionsmodell bei binären Variablen, multivariates Regressionsmodell, Selektion der Variablen schrittweise |
|
|
*Die Anzahl der Patientinnen, die in die Korrelations- oder Regressionsanalyse eingeschlossen waren. **Die statistische Analyse bezieht sich auf die Regressionsanalyse zum Einfluss der soziodemografischen, krankheits- und therapiebezogenen Merkmale auf die Inanspruchnahme der evaluierten komplementären Verfahren in der Studie. KI = Konfidenzintervall. KIM = Komplementäre und integrative Medizin (als Sammelbegriff für alle komplementären Therapiearten). n. b. = Nicht beschrieben. OR = Odds Ratio. stat. sig. = statistisch signifikant. |
|||
In allen Studien in Tabelle 6962, 231, 232, 242 ist die Misteltherapie nur eines von mehreren angewandten komplementärmedizinischen Verfahren und die assoziierten Merkmale beziehungsweise Prädiktoren beziehen sich auf alle KIM-Verfahren. Bei Drozdoff et al. (2018)231 beziehen sich die Merkmale sowohl auf alle KIM-Verfahren als auch auf alle Krebsarten in der Studie: Brustkrebs und gynäkologische Krebsarten.
Merkmale, die häufiger bei Anwenderinnen der Misteltherapie als bei Nicht-Anwenderinnen bei Patientinnen mit Brustkrebs vorkommen, sind in Tabelle 69 beschrieben. Die Effektgrößen für die Prädiktoren der KIM-Anwendung sind in Odds Ratios (OR) angegeben.
In der Analyse von Drozdoff et al. (2018)231 waren das Alter der Patientin (OR: 0,612/p = 0,038) und die Therapielinie der Brustkrebstherapie (OR: 0,394/p‑Wert nicht beschrieben) statistisch signifikante Prädiktoren. Referenzkategorie war die Altersgruppe bis 60 Jahre. Die OR von 0,612 beschreibt, dass die Chance einer Anwendung von pflanzlichen KAM bei Patientinnen über 60 Jahren niedriger ist im Vergleich zur Altersgruppe bis 60 Jahre. Für die Variable „Therapielinie bei Brustkrebs’ beschreiben Drozdoff et al. ein statistisch signifikantes Ergebnis für die Gruppe mit Metastasen in der Erstlinientherapie bei Brustkrebs. Die Variable hat die Ausprägungen neoadjuvant, adjuvant, Metastasen (in der Erst‑, Zweit‑, Dritt‑, oder Viertlinientherapie und höher) und Rückfall in der Erstlinienoder Zweitlinientherapie und höher. Referenzkategorie ist die Ausprägung neoadjuvante Therapie (findet i. d. R. vor der Operation zur Reduzierung der Tumormasse statt). Patientinnen mit Metastasen in der Erstlinientherapie bei Brustkrebs wenden also seltener pflanzliche KAM-Verfahren an als Patientinnen in einer neoadjuvanten Therapie.
Für die Patientinnen in der Studie von Fasching et al. (2007)232 wurden in einem multivariaten logistischen Regressionsmodell neun statistisch signifikante Prädiktoren für die Anwendung von KAM gefunden. Die KI sind Tabelle 69 zu entnehmen. Die Prädiktoren sind ein höherer Bildungsstand, ausgedrückt durch die Variablen „Abitur“ (OR: 1,597/p = 0,028) und „kein Schulabschluss“ (OR: 0,463/p = 0,005). Ein Angestelltenverhältnis war mit einer häufigeren KAM-Anwendung verbunden (OR: 2,077/p = 0,001), Arbeitsunfähigkeit mit einer niedrigeren (OR: 0,452/p = 0,003). Während eine gestärkte und eine unveränderte Partnerschaft mit einer selteneren Anwendung von KAM einhergehen, ist dies beim Ende der Partnerschaft während der Erkrankung umgekehrt. Bei einer Verschlechterung des Erkrankungsstatus durch ein lokales Rezidiv oder Metastasen (OR: 1,790/p = 0,019) sowie bei aktiver Teilnahme an Nachsorgeprogrammen (OR: 3,127/p = 0,001) werden KAM-Verfahren häufiger angewendet.
In der Studie von Fremd et al.62 beziehen sich die Prädiktoren auf das Interesse an KIM-Verfahren, nicht auf die tatsächliche Inanspruchnahme. Das multivariate logistische Regressionsmodel ergibt ein statistisch signifikantes Ergebnis für die Prädiktoren Geburtsjahr (OR: 1,042/p < 0,002) und ob bereits Metastasen vorliegen oder nicht (OR: 0,404/p < 0,002). Wenn bei der Patientin primäre Metastasen diagnostiziert wurden, ist die Chance, dass die Patientin KAM-Verfahren anwenden wird um den Faktor 0,404 (p = 0,002) geringer als ohne Metastasen. Das bedeute im Umkehrschluss, dass Patientinnen in dieser Studie häufiger KAM-Verfahren angewendet haben, wenn sie (noch) keine Metastasen hatten.
Die drei Faktoren, die bei Templeton et al. (2013)242 im multivariaten Regressionsmodell statistisch signifikant mit der höheren Inanspruchnahme von komplementären Verfahren assoziiert sind, sind mehr körperliche Aktivität (OR: 2,0/p < 0,01), ein höherer Bildungsstand (OR: 1,6/p < 0,01) und ein jüngeres Alter (OR: 0,7/p < 0,01); bezogen auf die Erhöhung des Alters um zehn Jahre). Diese OR können wie folgt interpretiert werden. Ein OR von 2,0 bedeutet, dass Patientinnen, die körperlich aktiv sind, eine doppelt so hohe Chance haben, dass sie komplementäre Verfahren in Anspruch nehmen. Bei einem höheren Bildungsstand, definiert als eine Berufsausbildung oder einen Universitätsabschluss, ist die Chance, KAM-Verfahren anzuwenden um 1,6‑Mal höher als bei niedrigerem Bildungsstand. Die OR kleiner eins bezogen auf die Erhöhung des Alters um zehn Jahre bedeutet, je jünger die Patientin ist, desto höher ist die Chance, dass KAM-Verfahren angewendet werden. Wenn das Alter der Patientin um zehn Jahre ansteigt, verringert sich die Chance der Anwendung von KAM-Verfahren um den Faktor 0,7.
Univariate Analyse
Tabelle 70: Merkmale, die in einer univariaten Regressionsanalyse mit der Inanspruchnahme von KIM-Verfahren assoziiert sind
|
Studie, Jahr |
Faktoren, die analysiert wurden (univariat) |
Faktoren mit statistisch Statistische signifikantem Effekt auf Methoden* KIM-Anwendung (p- Wert) |
|
Univariate Analyse |
||
|
Gschwendtner et al. (2016) |
Alter, Diagnose (n. r.) und Geschlecht (n. r.) |
Alle n. s. Chi2- und t‑Test; Signifikanzniveau: p < 0,05 |
|
Schönekaes (2003) |
Alter, Metastasen, Rezidiv, Berufsgruppe |
Jüngeres Alter (p = 0,03), Chi2- und Mann Lokalrezidiv oder Whitney-Wilcoxon- Metastasen (p = 0,04) Test; Signifikanzniveau: p < 0,05 |
|
Tautz (2012) |
Alter, Größe des Wohnorts, Bildungsstand, klinische Situation (kurativ oder palliativ), fortgeschrittenes Stadium (Metastasen, Rezidiv, weitere Krebsdiagnose), Lymphknotenstatus, Art der Standardtherapie (Mastektomie, Chemo‑, Hormontherapie) |
Jüngeres Alter (p = 0,02), Chi2- und t‑Test; höherer Bildungsstand Signifikanzniveau: (0,017), p < 0,05 positiver Lymphknotenstatus (p = 0,015), Metastasen (p = 0,032), Chemotherapie (p = 0,029), Mastektomie (p = 0,001), fortgeschrittenes Stadium/palliatives Setting (p < 0,001) |
*Die statistische Analyse bezieht sich auf die univariate Analyse über Chii2- oder t‑Test zum Einfluss der soziodemografischen und therapiebezogenen Merkmale auf die Inanspruchnahme der evaluierten komplementären Verfahren in der Studie.
HTA= Health Technology Assessment. KIM = Komplementäre und integrative Medizin (als Sammelbegriff für alle komplementären Therapiearten). n. r.: = nicht relevant für den HTA-Bericht. n. s. =nicht signifikant.
In der Studie von Gschwendtner et al. (2016)233 wurden für die gesamte Studienpopulation mit 88 Patientinnen und Patienten, darunter 18 (20,5 %) Mistelanwendenden, Charakteristika von Anwenderinnen und Anwendern der Misteltherapie mit Nicht-Anwenderinnen beziehungsweise NichtAnwendern hinsichtlich Alter, Diagnose und Geschlecht über Chi2- und t‑Tests mit einem Signifikanzniveau von 5 % verglichen. Für keines der Merkmale hat sich ein statistisch signifikanter Unterschied ergeben.
In den zwei Studien von Schönekaes et al. (2003)240 und Tautz et al. (2012)241 wurden Korrelationsanalysen über Chi2- und t‑Tests zu Alter, Bildungsstand, Therapie und Krankheitsverlauf durchgeführt. In beiden Studien zeigte sich sowohl eine Korrelation zwischen dem Alter und der Anwendung von KAM [Schönekaes: jüngeres Alter (p = 0,03); Tautz: jüngeres Alter (p = 0,02)], als auch des Verlaufs der Erkrankung mit der Anwendung von KAM (Schönekaes: Lokalrezidiv oder Metastasen (p = 0,04); Tautz: positiver Lymphknotenstatus (p = 0,015), Metastasen (p = 0,032), fortgeschrittenes Stadium/palliatives Setting (p < 0,001)). Bei Tautz et al. waren zusätzlich die Korrelationen zwischen dem Erhalt einer Chemotherapie (p = 0,029) beziehungsweise einer Mastektomie (p = 0,001) mit der Anwendung von KAM statistisch signifikant.
Studien aus der Perspektive des behandelnden Fachpersonals
In drei Studien aus Behandelndenperspektive65,235,238 schätzen die behandelnden Personen, in der Regel Ärztinnen und Ärzte, die Inanspruchnahme von KIM-Verfahren und der Misteltherapie selbst ein. Beim behandelnden Fachpersonal, das bei Kalder et al. und Münstedt et al. aus Ärztinnen und Ärzten besteht, und bei Klein et al. auch Angehörige anderer Berufsgruppen im Krankenhausbereich umfasst, ist die Inanspruchnahme definiert als Anzahl der Personen, die angeben, eine Misteltherapie einzusetzen. Bei Klein et al. kann dies auch bedeuten, dass in der jeweiligen Institution grundsätzlich auch komplementäre Verfahren beziehungsweise die Misteltherapie angeboten werden. Der entsprechende Wert wird den Publikationen entweder direkt entnommen oder aus den dort berichteten Angaben berechnet.
Tabelle 71: Häufigkeit der Inanspruchnahme von KIM und Misteltherapie durch das behandelnde Fachpersonal
|
Studie, Jahr |
Anzahl der behandelnden Fachpersonen (%) |
Anzahl der Anwender von KIM (%) |
Anzahl der Anwender der MT* (%) |
|
Kalder (2001) |
348 |
186 (53,4) |
102 (29,3) |
|
Klein (2017) |
104 |
97 (93) |
30 (28,8) |
|
Münstedt (2000) |
202 |
160 (79,2) |
160 (79,2), davon 71 (35,1) primär MT und 89 (44,1) überwiegend MT |
*Die Anzahl der Anwendenden der MT bezieht sich auf alle behandelnden Fachpersonen. Davon ausgenommen ist nur die Unterteilung zwischen Therapierenden, die primär oder überwiegend die MT anwenden bei Münstedt et al. (2000).
KIM =Komplementäre und integrative Medizin. MT = Misteltherapie.
Der Median der Anteile der Inanspruchnahme der Misteltherapie an allen behandelnden Fachpersonen liegt bei 29,3 % (Spannweite: 29,3 bis 79,2 %). Je nach Definition, was als komplementäres Verfahren gezählt wird, variiert der Anteil der Anbietenden von KAM-Verfahren und der Misteltherapie stark, mit 53,4 % versus 29,3 % bei Kalder et al. (2001)65 und 93 % versus 28,8 % bei Klein et al. (2017)235.
Da in der Studie von Münstedt et al. (2000)238 die Misteltherapie das einzige KIM-Verfahren ist, das erhoben ist, ist die Anzahl der Ärztinnen und Ärzte, die eine Misteltherapie grundsätzlich anwenden, mit 160 Anwenderinnen und Anwendern identisch mit der Anzahl der Anwenderinnen und Anwender von KIM-Verfahren. Unterschieden wird zwischen Ärztinnen und Ärzten, die eine Misteltherapie als primäre komplementäre Methode anwenden und Ärztinnen und Ärzten, die eine Misteltherapie nur als ein mögliches KAM-Verfahren einsetzen.
Neben Zahlen zur Inanspruchnahme wurden auch Charakteristika von Ärztinnen und Ärzten sowie sonstigem medizinischen Fachpersonal erhoben (siehe hierzu Tabelle 67). In zwei Studien65, 238 wurden univariate Analysen zu Assoziationen zwischen einzelnen Variablen und der Anwendung komplementärer Methoden (bei Kalder et al.) beziehungsweise der Misteltherapie (bei Münstedt et al.) durch Ärztinnen und Ärzte durchgeführt.
Die Merkmale für die Anwendung der Misteltherapie aus Sicht der behandelnden Personen sind in Tabelle 72 beschrieben.
Tabelle 72: Merkmale, die bei Anwendern/innen der Misteltherapie häufiger vorkommen als bei Nicht-Anwendern/innen
|
Studie, Jahr |
Faktoren, die analysiert wurden (univariat) |
Faktoren mit stat. sig. Effekt auf KIM- Anwendung (Effektgröße/p‑Wert) |
Statistische Methoden |
|
Univariate Analyse |
|||
|
Kalder (2001) |
Alter, Geschlecht, Setting, berufliche Position und Berufserfahrung, Region (Stadt/Land), akademische Ausbildung |
Höheres Alter (Anteil der Anbietenden bei über 50-Jährigen am höchsten (bis 40 Jahre:44,6 %; 41 bis 50 Jahre:63 %; > 50 Jahre:65,3 %/pchi2 = 0,001); Geschlecht „männlich’ (59,1 %/pchi2 p = 0,027). Niedergelassene Ärzte (Praxis: 66,4 %; Krankenhaus: 48,7 %; Uni Klinik: 33,8 %/p‑Wert n. b.); Im Krankenhaussetting: hierarchischer Status: 62,5 % der Chefärzte/pchi2 = 0,013) |
Chi2-Test; Signifikanzniveau: p < 0,05 |
|
Münstedt (2000) |
Alter, Geschlecht, Wohnort (Stadt/Land), Fachrichtung, jährlicher Aufwand für die berufliche Weiterbildung, die Zahl der behandelten onkologischen Patienten, akademische Titel, Zufriedenheit mit dem Beruf, Einstellungen zur Selbstverantwortlichkeit der Patienten, zur Lehre der UKT an Universitäten, Beziehung zu Patienten |
Höheres Alter: Anteil der Misteltherapeuten bei über 50-Jährigen am höchsten (Chi2 = 14,4; df = 4/p = 0,006). Fachrichtung: Allgemeinmedizin mit deutlichster Präferenz (circa 40 % der Mistelanbietende und 48 % der Anbietenden unkonventioneller Therapien) (Chi2 = 13,5; df = 6/p = 0,035). |
Chi2- und t‑Test; Signifikanzniveau: p < 0,05 |
KIM = Komplementäre und integrative Medizin. Stat. sig. = Statistisch signifikant. UKT = Unkonventionelle Therapiemethoden.
Bei Kalder et al. (2001)65 waren die Ärztinnen beziehungsweise Ärzte, die unkonventionelle Heilmethoden verordnen, deutlich älter als Nicht-Anbietende. Der Anteil der Anbieterinnen beziehungsweise Anbieter unter 40 Jahre lag bei 44,6 %, der Anteil der 41 bis 50-Jährigen bei 63 % und über 65,3 % waren älter als 50 Jahre (p = 0,001). Männer verordneten häufiger komplementäre Verfahren als Frauen (59,1 % Männer, 47,7 % Frauen/p = 0,027). Der Anteil der behandelnden Personen, die komplementäre Verfahren anwenden und im niedergelassenen Bereich tätig sind, ist mit 66,4 % höher als der Anteil der Anbietenden von komplementären Verfahren im Krankenhaus mit 48,7 %. Ärztinnen und Ärzte, die an einer Universitätsklinik tätig waren, boten am seltensten KIM-Verfahren an (33,8 %). Kalder et al. haben auch einen statistischen Zusammenhang zwischen dem hierarchischen Status und der Häufigkeit der Verordnungen von komplementären Maßnahmen, zu denen auch die Misteltherapie zählt, gefunden. Von den Ärztinnen beziehungsweise Ärzten im Praktikum verordnen nur zwei von zwölf (16,7 %), von den Assistenzärztinnen und ‑ärzten 43 von 108 (39,8 %), von den Oberärztinnen und ‑ärzten 30 von 59 (50,8 %) sowie von Chefärztinnen und ‑ärzten 25 von 40 (62,5 %/p = 0,013) komplementäre beziehungsweise unkonventionelle Heilmethoden.65 Münstedt et al. (2000)238 berichten das Alter des Arztes beziehungsweise der Ärztin und die Fachrichtung der behandelnden Person als Merkmale, die assoziiert ist mit der Anwendung beziehungsweise Verordnung von Mistelpräparaten. Der Anteil der Misteltherapeuten war bei Ärztinnen und Ärzten, die über 50 Jahre alt waren, höher als in den jüngeren Altersgruppen (Chi2 = 14,4; df = 4/p = 0,006). Es zeigte sich eine Tendenz, dass KAM und insbesondere die Misteltherapie häufiger von Allgemeinmedizinerinnen und ‑medizinern angeboten wird, im Vergleich zu anderen Fachrichtungen, wie Gynäkologie, Urologie, Chirurgie, Hämatologie oder Pädiatrie (Chi2 = 13,5; df = 6/p = 0,035). Die prozentualen Anteile der Studienteilnehmenden nach Fachrichtungen sind Tabelle 67 zu entnehmen. Ein Zusammenhang mit dem Geschlecht der behandelnden Person, wie bei Kalder et al.65, wurde bei Münstedt et al.238 nicht gefunden. Zu den Faktoren, die nach Angabe der
Autoren/-innen keinen statistisch signifikanten Zusammenhang mit der Häufigkeit der Verordnung der Misteltherapie haben, wurden keine Zahlen berichtet.
53.7.2 Einstellung gegenüber/Akzeptanz der begleitenden Misteltherapie
Sieben Studien, zwei quantitative Studien zur Patientinnenperspektive234,237 mit 197 Patientinnen, drei quantitative Studien65,235,238 mit 654 behandelnden Personen und die beiden qualitativen Studien230,233 mit 34 Patientinnen berichten Ergebnisse zur Einstellung gegenüber und Akzeptanz der Misteltherapie. Die Einstellung gegenüber und Akzeptanz der Misteltherapie werden vor allem durch Gründe für und gegen die Anwendung der Misteltherapie ausgedrückt. Die Gründe in Tabelle 73 müssen sich nicht direkt auf die Wirkweise der Mistelextrakte beziehen, sondern können auch mit der Situation verbunden sein, in der sich die Patientinnen oder behandelnden Personen befinden. Es ist anzunehmen, dass auch die Patientinnen aus der qualitativen Studie von Konitzer et al.236 eine positive Haltung gegenüber der Misteltherapie haben, da sie seit 1,5 Jahren sowohl eine Misteltherapie machen als auch zu wöchentlichen Gruppensitzungen gehen. Die Aussagen der Patientinnen beziehen sich jedoch primär auf ihre Erfahrungen mit der Misteltherapie und sind deswegen den Erfahrungen und der Zufriedenheit mit der Misteltherapie zugeordnet (Abschnitt 5.3.7.6 und 5.3.7.7).
Tabelle 73: Ergebnisse zu Einstellung gegenüber und Akzeptanz der Misteltherapie
Studie, Jahr Beschreibung
Patientinnenperspektive
Hübner (2014) Gründe für die Verwendung von KAM
Vertrauen zur beratenden Person:
-
- Patientinnen verlassen sich darauf, dass die Misteltherapie gut für sie sei, wenn sie ihnen von der Person empfohlen wird (keine Anzahl berichtet)
-
- Anwendung von KAM bei Patientinnen, die jemanden kennen, der kompetent ist in Bezug auf komplementäre Verfahren: (90 %)
-
- Anwendung von KAM bei Patientinnen, die sich auf andere Informationsquellen beziehen (62 %)
Moschen (2001) Die wichtigsten Gründe für die Verwendung von alternativen Therapien:
-
- Nichts unversucht lassen (47 %)
-
- Wunsch nach aktiver Rolle in der Behandlung (47 %)
-
- Die Standardtherapie ergänzen (31 %)
-
- Starker Wunsch nach einer sanften Behandlung ohne Nebenwirkungen (18 %)
-
- Konventionelle Therapie ist wirkungslos (3,6 %)
Behandelndenperspektive
Kalder (2001) Gründe für die Verwendung der Misteltherapie aus Sicht Anbietender
-
- Wunsch der Patientinnen (82 %)
-
- Motivation der Patientinnen (62 %)
-
- Erweiterung des Angebotsspektrums (59 %)
-
- Eigene Überzeugung (55 %)
-
- Unwirksamkeit konventioneller Therapien (46 %)
-
- Rat von Kollegen/inen (42 %)
Gründe gegen die Anwendung aus Sicht Nicht-Anbietender
-
- Zeit geht verloren durch Verzögerung wegen unkonventioneller Behandlungen (32,9 %)
-
- Zu hohe Kosten (30,4 %)
-
- Verhinderung konventioneller Therapien (28,6 %)
-
- Unkonventionelle Heilmethoden sind wirkungslos (27,3 %)
-
- Unkonventionelle Therapien wecken falsche Hoffnungen bei der Patientin (26,1%)
-
- Ärzte befürchten schädliche Wirkungen der Misteltherapie (16,1%)
Tabelle 73 – Fortsetzung
|
Klein (2017) |
Gründe gegen die Anwendung aus Sicht Nicht-Anbietender
Teil der klinischen Routine; jedoch ist bei 64,7 % eine Integration von KIM geplant
profitabel für das Krankenhaus seien
|
|
Münstedt (2000) |
Gründe für die Verwendung der Misteltherapie (keine Zahlen berichtet)
Eigene Überzeugung zur Wirksamkeit der Misteltherapie durch Anwender
Misteltherapie überzeugt |
KAM = Komplementäre und alternative Medizin. KIM = Komplementäre und integrative Medizin.
Patientinnenperspektive – quantitative Studien
In einer der beiden Studien, von Moschen et al. (2001)237, sind die Hauptgründe für die Anwendung komplementärer Verfahren, nichts unversucht zu lassen (47 %) und der Wunsch der Patientin, eine aktive Rolle in der Behandlung einzunehmen (47 %). Knapp ein Drittel der Patientinnen begründet die Inanspruchnahme von KIM damit, dass sie die Standardtherapie ergänzen möchten (31 %). Der Wunsch, durch das komplementäre Verfahren eine sanftere Behandlung ohne Nebenwirkungen zu erzielen, war für 18 % der Anwenderinnen ausschlaggebend. Es ist allerdings unklar, wie hoch zum einen der Anteil bei Patientinnen ist, die eine Chemotherapie erhalten, weil in der Studie die Standardtherapie nicht genauer beschrieben wurde, und in welchem Ausmaß dies auch die Gründe für Patientinnen mit Misteltherapie sind.
Hübner et al. (2014)234 untersuchten den Zusammenhang der Anwendung von KAM mit der Einschätzung der Kompetenz für KAM von Personen aus dem eigenen Umfeld. 90 % der Patientinnen, die jemanden kennen, den sie in Bezug auf komplementäre Verfahren für kompetent halten, wendeten in der Studie komplementäre Verfahren an. Bei Patientinnen, die ihre Informationen aus anderen Quellen beziehen, wenden nur 62 % eine komplementäre Methode an. Ein Zusammenhang zwischen der Anwendung einer Misteltherapie und damit, ob die behandelnde Ärztin beziehungsweise der behandelnde Arzt ausreichend Zeit für die Beratung hatte, konnte in dieser Studie nicht gezeigt werden.
Studien aus der Perspektive des behandelnden Fachpersonals
Drei Studien65, 235, 238 mit 654 Befragten berichten Ergebnisse zur Einstellung gegenüber der Misteltherapie aus der Behandelndenperspektive. In Hinblick auf die Einstellung der Ärztinnen und Ärzte gegenüber der Misteltherapie unterscheiden Münstedt et al. (2000)238 in der Analyse der Ergebnisse zwischen drei Gruppen von Ärztinnen und Ärzten danach, wie häufig sie die Misteltherapie im Rahmen von KIM verwenden. Zu den Misteltherapierenden, die angegeben hatten, dass die Misteltherapie im Rahmen einer unkonventionellen Therapie „den ersten und wichtigsten Behandlungsschritt“ darstellt, zählen 71 (35,2 %) der befragten Ärztinnen und Ärzte.238 Diese gaben an, dass sie die Misteltherapie „weit überwiegend oder ausschließlich” einsetzten. Die Gruppe der Ärztinnen und Ärzte, die zwar unkonventionelle oder komplementäre Therapiemethoden (UKT) anwenden, bei denen die Misteltherapie aber „nicht Therapie der ersten und zweiten Wahl“238 ist, wird als UKT-Gruppe bezeichnet. Diese besteht aus 89 (44,1 %) Ärztinnen und Ärzten. Die Nicht-Anbietenden von unkonventionellen Behandlungsmethoden sind 42 (20,8 %) Ärztinnen und Ärzte.
Zwei Studien65,238 berichten Gründe für die Verwendung der Misteltherapie, bei Kalder et al. (2001)65 mit Prozentangaben und bei Münstedt et al. (2000)238 ohne Prozentangaben, jedoch sind die genannten Aspekte in den Studien sehr ähnlich. Die behandelnden Personen in beiden Studien geben an, dass die Misteltherapie vor allem auf Nachfrage der Patientinnen angewendet wird. Die Hauptgründe für die Inanspruchnahme sind bei Kalder et al. (2001) der Wunsch der Patientinnen (82 %) und die Motivation der Patientinnen (62 %). Auch bei Münstedt et al. (2000)238 ist der Wunsch der Patientinnen als erstes genannt. Gründe, die behandelnde Personen motivieren, die Misteltherapie anzubieten, sind in beiden Studien einerseits betriebswirtschaftlicher Natur, weil sich dadurch das eigene Angebotsspektrum erweitert. Dies nennen 59 % der Anbietenden bei Kalder et al. und der Glaube an die Unwirksamkeit der Standardtherapie, insbesondere der Chemotherapie (46 % bei Kalder et al. (2001)). Zwischen 55 und 82 % der Ärztinnen und Ärzte, die bei Patientinnen eine Misteltherapie anwenden, sind selbst von der Wirksamkeit der Misteltherapie überzeugt. Bei Kalder et al. (2001) geben 55 % der Ärztinnen und Ärzte die eigene Überzeugung als Grund für die Anwendung der Misteltherapie an, bei Münstedt et al. (2000)238 sehen 65,7 % der Therapeutinnen und Therapeuten eine Misteltherapie als wichtigste komplementäre Maßnahme und 82,2 % der Therapierenden, die eine Misteltherapie unter anderem anwenden, sind von deren Wirksamkeit überzeugt. 42 % der Misteltherapie-Anwendenden berufen sich auf den Rat von Kolleginnen und Kollegen, der sie zur Anwendung der Misteltherapie motiviert hat.
Zwei Studien, Kalder et al. (2001) und Klein et al. (2017)65,235, beschreiben die Haltung der befragten Behandelnden unter anderem über die Darstellung von Gründen gegen die Misteltherapie (siehe Tabelle 73). Aus Sicht der behandelnden Personen sind Gründe gegen die Anwendung einer Misteltherapie entweder struktureller Art, dass unkonventionelle Therapien grundsätzlich nicht angeboten werden aufgrund fehlender Ressourcen bei den Leistungserbringern/innen beziehungsweise bei den Ärztinnen/Ärzten, insbesondere bei Klein et al. (2017)235, oder weil komplementäre Verfahren wie die Misteltherapie negative Nebeneffekte oder keinen Effekt haben könnten.
Die Nicht-Anbietenden in der Studie von Kalder et al. (2001) nennen als Gründe gegen die Anwendung komplementärer Verfahren, dass Zeit verloren geht durch Verzögerungen durch KIM (32,9 %), die Misteltherapie zu teuer ist (30,4 %), KIM-Verfahren wirkungslos sind (27,3 %) oder durch die KIM-Verfahren bei der Patientin falsche Hoffnungen geweckt werden (26,1 %). Außerdem könnten komplementäre Verfahren eine schädliche Wirkung haben (16,1 %).
Die Ausführungen von Klein et al. (2017)235 beziehen sich unter anderem auf die Infrastruktur im Versorgungsalltag eines Krankenhauses. 66,7 % der Nicht-Anbietenden unter den gynäkologischen Onkologinnen und Onkologen im Krankenhaus-Setting nennen als Grund gegen die Anwendung, dass KIM-Verfahren (noch) nicht Teil der klinischen Routine ihres Krankenhauses sind. Bei 64,7 % davon sei eine Integration von KIM-Verfahren im klinischen Versorgungsalltag geplant, aber noch nicht umgesetzt. Neben Personalmangel, der die Ausführung von KIM-Maßnahmen verhindern würde, erschwere die Tatsache, dass KIM-Verfahren nicht abgerechnet werden können, und somit nicht profitabel seien, die Umsetzung (berichten 55,5 % der Nicht-Anbietenden). Außerdem fehle spezifisches Fachwissen und Qualifikationen der behandelnden Ärztinnen und Ärzte zu KIM-Verfahren.
Patientinnenperspektive – qualitative Studien
Zur Einstellung beziehungsweise Haltung der Patientinnen zur Misteltherapie beschreiben zwei qualitative Studien230, 233 Ergebnisse. Vertreten sind sowohl Patientinnen, die bereits eine Misteltherapie verwendet hatten, als auch jene, die keine Misteltherapie verwenden. Die in der qualitativen Inhaltsanalyse identifizierten Haltungen reichen von einer ablehnenden Haltung über Unsicherheit oder einer neutralen Haltung, die eine Misteltherapie nicht grundsätzlich ablehnt. Eine Patientin äußerte, dass sie nach Möglichkeit komplementäre Maßnahmen gegenüber der Schulmedizin bevorzugt und nannte dabei die Behandlung einer Arthritis als Beispiel (siehe Tabelle 78). Jedoch ist fraglich, in wie weit diese Einstellung auch in der Onkologie vertreten ist, denn die Patientin hat die schulmedizinische Behandlung nicht abgelehnt.230 Für die Patientinnen in der Studie von Gschwendtner et al.233 wird die Haltung gegenüber der Misteltherapie, vergleichbar mit den Ergebnissen von Hübner et al. in Tabelle 73, dadurch beeinflusst, ob die Misteltherapie von der beratenden Person befürwortet oder abgelehnt wird: „Patienten erklärten, dass sie ihren Ärzten oder dem Heilpraktiker vertrauten und davon ausgingen, dass diese ihnen empfehlen, was notwendig und hilfreich ist. Dieses Vertrauen war besonders groß, wenn sich mehrere Ärzte z. B. in einem Tumorboard über die Behandlung berieten.“233 Insbesondere dann, wenn die Empfehlung von mehreren Ärztinnen/Ärzten oder einem Tumor-Board empfohlen wurde und die Misteltherapie in die Standardtherapie integriert wäre, sei die Akzeptanz der Misteltherapie besonders hoch (siehe Tabelle 78, Code „Unterstützung durch beratende Personen und Integration in die Standardtherapie“ in der Unterkategorie „Einstellung und Akzeptanz“). Das Bedürfnis der Patientinnen nach Integration wird aus der Tatsache abgeleitet, dass sich Anwendende wünschen, dass sie vom Fachpersonal zur Misteltherapie informiert werden. Zudem haben alle Anwendenden in der Studie die Misteltherapie mit einem behandelnden Arzt beziehungsweise einer behandelnden Ärztin abgeklärt. (siehe Tabelle 80, Codes „Kompetenz der beratenden Person“ und „Vertrauen in das Fachpersonal“ in der Unterkategorie „Arzt-Patienten-Kommunikation/Rolle der Ärztin beziehungsweise des Arztes für die Therapieentscheidung).
Die Patientinnen aus der Studie von Gschwendtner et al.233 haben teilweise keine Misteltherapie erhalten. Als Grund dafür wurde genannt, dass sie generell kein Interesse an oder eine negative Haltung gegenüber der Misteltherapie haben. Auch die Zufriedenheit mit der Standardtherapie oder die Überzeugung, dass ihnen die Misteltherapie in ihrer spezifischen Situation nicht weiterhelfen würde, hält Patientinnen von der Inanspruchnahme der Misteltherapie ab. Falls sich der eigene Gesundheitszustand verschlechtert, könnten sich manche Patientinnen vorstellen, dass sie doch eine Misteltherapie beginnen würden. Andere Patientinnen hatten grundsätzlich eine neutrale bis positive Haltung gegenüber der Misteltherapie, aber haben trotzdem nie mit der Misteltherapie begonnen. Die Selbstinjektion der Mistelpräparate wird grundsätzlich als unangenehm empfunden und wurde auch als Grund gegen die Anwendung genannt.
Patientinnen nannten auch als Grund für die Anwendung, den Wunsch im Behandlungsprozess aktiv zu sein oder dass die Misteltherapie die letzte Option sei, die noch zur Verfügung steht und deswegen angewendet wird.
Die Codes zu dieser Zielgröße, befinden sich in Tabelle 78 in der Unterkategorie „Einstellung und Akzeptanz. Weitere Ausführungen zu den Ergebnissen der qualitativen Inhaltsanalyse mit Ankerbeispielen sind in Abschnitt 5.3.7.10 zu finden.
5.3. Er 3 Erwartungen an die begleitende Misteltherapie
In sechs Studien, zwei quantitativen Studien zur Patientinnenperspektive234, 237 mit 197 Patientinnen, zwei Studien aus der Perspektive des behandelnden Fachpersonals (Kalder et al. 2001, Münstedt et al. 2000)65, 238 mit 550 behandelnden Personen und den zwei qualitativen Studien von Brandenberger et al. (2012) und Gschwendtner et al. (2016)230, 233 mit 34 Patientinnen, werden Ergebnisse zu den Erwartungen an komplementäre Verfahren beziehungsweise die Misteltherapie berichtet. Hübner et al., Moschen et al. und Kalder et al. beziehen sich auf alle komplementären Verfahren in ihren Studien. Münstedt et al, Brandenberger et al. und Gschwendtner et al. beziehen ihre Aussagen auf die Misteltherapie. Die Erwartungen an die begleitende Misteltherapie spiegeln sich zu einem großen Teil in den Gründen für oder gegen die Inanspruchnahme wider.
Tabelle 74: Ergebnisse zu Erwartungen an die Misteltherapie
Studie, Jahr Beschreibung
Patientinnenperspektive
Hübner (2014) Ziele für die Anwendung komplementärer Therapien, die mit der Verwendung
von Misteltherapie korrelieren:
-
- Reduktion von Nebenwirkungen (81 %) (p = 0,029)
-
- Stärkung des Immunsystems (81 %) (p = 0,041)
-
- Aktiv werden (80 %) (p > 0,05)
-
- Erkrankung besser kontrollieren (60 %)
-
- Ganzheitliche Therapie erhalten (52 %)
-
- Keine Möglichkeit auslassen (52 %)
-
- Positive Vorerfahrung (52 %)
-
- Stressreduzierung (44 %)
Moschen (2001) Wichtigste Erwartungen für die Anwendung alternativer Therapien:
-
- Stärkung des Immunsystems (82 %)
-
- Verbesserung des Allgemeinzustands (53 %)
-
- Ergänzung der Standardtherapie (31 %)
-
- Prävention eines Rückfalls (Rezidiv) (27 %)
-
- Wunsch nach Reduktion von Nebenwirkungen (18 %)
Behandelndenperspektive
Kalder (2001) Einschätzung der Wirksamkeit von KIM-Verfahren durch Anbietende:
Geschätzte Anteile der Wirksamkeit von KIM-Verfahren an folgenden Krankheitsverläufen (Medianwerte und Spannweite in Klammern):
-
- Komplette Remissionen 0 % (SW: 0–100%)
-
- Partielle Remissionen 10 % (SW: 0–60%)
-
- Stabilisierung der Erkrankung 25 % (SW: 0–100%)
-
- Progressive Erkrankung 27 % (SW: 0–100%)
Geschätzter Beitrag von KIM-Verfahren zur Lebensqualität (Medianwerte und SW in Klammern):
-
- Deutlich gebesserte Symptomatik 10 % (SW: 0–100%)
-
- Gebesserte Symptomatik 32 % (SW: 0–100%)
-
- Gleichbleibende Symptomatik 25 % (SW: 0–100%)
-
- Verschlechterte Symptomatik 0 % (SW: 0–70%)
Münstedt (2000) Motivation der Ärzte zum Angebot der Misteltherapie*
-
- Deutliche Verbesserung der Lebensqualität: 27 % der Misteltherapeuten und 38 % der UKT-Anbietenden
-
- Leichte Verbesserung: 32 % der Misteltherapeuten und 25 % der UKT-Anbietenden
-
- Verstärkung der Effekte der konventionellen Behandlung (Zahlen n. b.)
-
- Reduktion der Nebenwirkungen (Zahlen n. b.)
*Die Angaben zur Motivation der Ärzte/innen zum Angebot der Misteltherapie werden aus der Abbildung in Münstedt et al. (2000) abgelesen.
KIM = Komplementäre und integrative Medizin. n. b. = nicht berichtet. SW = Spannweite. UKT-Anbietende = Anbietende für unkonventionelle Therapiemethoden, verwendet von Münstedt et al. zur Abgrenzung der Anbietenden, die eine Misteltherapie nur als eine mögliche unkonventionelle Therapiemöglichkeit sehen, zu den Misteltherapeuten/innen.
Patientinnenperspektive – quantitative Studien
Zwei quantitative Studien zur Patientinnenperspektive234, 237 mit 197 Patientinnen berichten Ergebnisse zu den Erwartungen an die Misteltherapie als Gründe für die Verwendung von KAM-Verfahren. Bei Moschen et al. (2001)237 sind die Gründe mit der Prozentangabe zur Häufigkeit der Nennung genannt.
In der Publikation von Hübner et al. (2014)234 wurde für die drei häufigsten Gründe, die für die Inanspruchnahme von allen KAM-Patientinnen für die Misteltherapie genannt wurden, eine Korrelationsanalyse mit verschiedenen KAM-Therapien durchgeführt: Nebenwirkungen mindern, das Immunsystem stärken und aktiv etwas tun. Für die Misteltherapie ergab sich eine positive Korrelation zum Faktor „Reduzieren von Nebenwirkungen’ (p = 0,029) und „Stärkung des Immunsystems“ (p = 0,041). Die Stärke der Korrelation wurde nicht berichtet. Für den Anwendungsgrund selbst aktiv zu werden lag der p‑Wert über 0,05.
In der Publikation von Moschen et al. (2001)237 wurde als häufigste Erwartung an die komplementäre Methode die Stärkung des Immunsystems mit 82 % genannt. Eine Verbesserung des Allgemeinzustands erwarteten 53 % und einen positiven Effekt durch die Ergänzung der Standardtherapie 31 %. Die Prävention eines Rückfalls (Rezidiv) erwarteten 27 % und eine Reduktion von Nebenwirkungen erhofften sich 18 %.
Studien aus der Perspektive des behandelnden Fachpersonals
Zwei Studien, von Kalder et al. (2001)65 und Münstedt et al. (2000)238, mit 550 Befragten berichten Faktoren, wie Ärzte KIM-Verfahren (bei Kalder et al.65) beziehungsweise die Misteltherapie (bei Münstedt et al. 238) einschätzen und warum sie diese anbieten. In der Studie von Kalder et al. (2001) wurden Ärztinnen und Ärzte, die die Misteltherapie anbieten, nach deren Einschätzung zur Wirksamkeit gefragt. Es wurden Mediane und Spannweite des geschätzten Anteils der Patientinnen angegeben. Eine Auswirkung der Mistelextrakte auf komplette oder partielle Remissionen hielt die Mehrzahl der Ärztinnen und Ärzte für unwahrscheinlich (Median bei 0 % beziehungsweise 10 %), aber bei einer hohen Spannweite der Antworten. Eine Auswirkung der Misteltherapie auf eine Stabilisierung der Krebserkrankung oder bei einer Progression der Erkrankung hielten mit einem Median von 25 beziehungsweise 27 % mehr Ärztinnen und Ärzte für wahrscheinlich, jedoch liegt auch hier eine hohe Spannweite von 0 bis 100 % vor. Bei der Einschätzung des Beitrags der Misteltherapie zur Lebensqualität während des Krankheitsverlaufs äußern sich die Ärztinnen und Ärzte tendenziell positiv, jedoch zurückhaltend. Im Median sehen 25 % eine gleichbleibende Symptomatik, 32 % sehen eine gebesserte Symptomatik durch die Misteltherapie und 10% eine deutlich gebesserte Symptomatik und im Median 0 % eine verschlechterte Symptomatik. Die Ärztinnen und Ärzte in der Studie von Münstedt et al. (2000) werden auch bei der Ergebnisdarstellung zu den Erwartungen an die Misteltherapie unterschieden nach der relativen Häufigkeit der Anwendung der Misteltherapie, unterschieden nach Therapeutinnen und Therapeuten, die eine Misteltherapie als ersten und wichtigsten Schritt bei der Anwendung von komplementärer Medizin sehen (in Tabelle 74 als „Misteltherapeuten“ bezeichnet) und Therapeuten, die eine Misteltherapie unter anderem anwenden (in Tabelle 74 als „UKT-Anbietende“ bezeichnet. In Hinblick auf die Erwartungen der Ärztinnen und Ärzte gegenüber der Misteltherapie erhoffen sich 27 % der Misteltherapeuten versus 38 % der UKT-Anbieter eine deutliche Verbesserung der Lebensqualität und 32 % der Misteltherapeuten versus 25 % der UKT-Anbietenden eine leichte Verbesserung der Lebensqualität. Zum Vergleich sind auch Zahlen erhoben, welcher Anteil der Ärztinnen und Ärzte eine gleichbleibende Symptomatik erwartet (28 % der Misteltherapierenden und 26 % der UKT-Anbietenden) und welcher Anteil eine verschlechterte Symptomatik durch die Misteltherapie erwartet (18 % der Misteltherapeuten/innen und 14 % der UKT-Anbietenden). Die erwartete Wirkung der Misteltherapie ist bei UKT-Anbietenden besser als bei Misteltherapeuten/innen. Neben einer verbesserten Lebensqualität erwarten die Anwendenden der Misteltherapie auch einen unterstützenden oder verstärkenden Effekt für die Standardtherapie und/oder eine Reduktion der Nebenwirkungen der konventionellen Therapie. Hierzu sind jedoch keine Zahlen berichtet. Die Publikation von Münstedt et al. (2000)238 beinhaltet eine Abbildung zu Mittelwerten des geschätzten Therapieerfolgs der Misteltherapie, jedoch fehlt eine Legende zu den Abkürzungen der einzelnen Subgruppen, wodurch die untersuchte Subgruppe unklar und eine Zuordnung der Zahlen nicht möglich ist.
Patientinnenperspektive – qualitative Studien
Beide qualitativen Studien230, 233 berichten Erwartungen an die Misteltherapie aus Patientinnensicht. Die Patientinnen berichten sowohl positive als auch negative Erwartungen.
In beiden Studien berichten Patientinnen, dass sie sich von der Misteltherapie ein höheres Wohlbefinden erwarten und sie sich selbst stärken wollen.233 Zum Wohlbefinden trage auch das komplementäre beziehungsweise ganzheitliche Behandlungs-Setting bei, in dem die Misteltherapie verabreicht wird.230
In der Studie von Gschwendtner et al. (2016)233 wurden als weitere positive Erwartungen an die Misteltherapie genannt, das Tumorwachstum durch die Stärkung des Immunsystems zu verlangsamen. Die Patientinnen schätzen die Misteltherapie als sicheres und natürliches Verfahren ein. Eine Patientin schätzt die Natürlichkeit der Misteltherapie als pflanzliches Verfahren.
Negative Erwartungen an die Misteltherapie als Gründe gegen die Anwendung beschreiben Patientinnen bei Gschwendtner et al. (2016)233. Die Patientinnen zweifeln an der Wirksamkeit der Misteltherapie oder befürchten sogar, dass das Tumorwachstum durch die Mistel gefördert wird. Die unklare Studienlage verunsichert die Patientinnen. Unsicherheit herrscht auch in Bezug auf mögliche Neben- und Wechselwirkungen mit anderen Medikamenten. Andere Patientinnen befürchteten Allergien in Zusammenhang mit der Misteltherapie. Die Sicherheit und Verträglichkeit der Mistelextrakte sind ein Thema für Patientinnen.
Es kann auch vorkommen, dass das Abraten durch eine Ärztin oder einen Arzt als Herausforderung interpretiert wird, zu demonstrieren, dass die Misteltherapie doch die richtige Option sei, wie bei einer Patientin aus dem Interview von Brandenberger et al. (2012)230 in dem die Inanspruchnahme gegen den Willen der Ärztin oder des Arztes als Autonomieschritt verstanden wurde (siehe Tabelle 78, Unterkategorie „Erwartungen“). Die Patientin befand sich in einem sehr fortgeschrittenen Erkrankungsstadium.
Die entsprechenden Codes mit Ankerbeispielen für positive und negative Erwartungen befinden sich in Tabelle 78 in der Unterkategorie „Erwartungen“.
5.3.7.4 Wissen über die begleitende Misteltherapie
Zwei quantitative Studien, eine Studie zur Patientinnenperspektive, von Hübner et al. (2014)234 mit 80 Patientinnen, und eine Studie von Klein et al. (2017)235 zur Behandelndenperspektive, mit 104 Teilnehmenden, berichten Ergebnisse zum Wissensstand.
Tabelle 75: Ergebnisse zum Wissen zur Misteltherapie
Studie, Jahr Beschreibung
Patientinnenperspektive
Hübner (2014) Verstehen der Wirkweise der Misteltherapie
80 % der Patientinnen bestätigen, dass die die Wirkweise der Misteltherapie verstanden haben
20 % haben die Wirkweise nicht verstanden
Behandelndenperspektive
Klein (2017) Fehlendes Wissen und ein Mangel an Fortbildung in dem Bereich (Anzahl n. b.)
n. b. = Nicht beschrieben.
Patientinnenperspektive – quantitative Studien
In der Studie von Hübner et al. (2014)234 mit 80 Patientinnen ist der Zusammenhang zwischen dem Verstehen der Wirkweise der komplementären Therapie und der Inanspruchnahme erörtert worden. So haben deutlich mehr Patientinnen KAM-Verfahren verwendet, die angegeben haben, dass sie die Wirkweise verstehen (81 %; 52 von 64), als die Patientinnen, die die Wirkweise nicht verstanden haben (56 %; 9 von 16).234 Insgesamt haben 80 % der Patientinnen angegeben, dass sie die Wirkweise der Misteltherapie verstanden haben und 20 %, dass nicht. In der Publikation wurde nicht berichtet, ob es sich bei den 80 % um Patientinnen handelt, denen das komplementäre Verfahren erklärt wurde und/oder sie das komplementäre Verfahren anwenden oder nicht.
Studien aus der Perspektive des behandelnden Fachpersonals
In der Studie von Klein et al. (2017)235 berichten Onkologinnen und Onkologen von den Herausforderungen in der klinischen Praxis, die eine Anwendung integrativer Therapiekonzepte – und somit auch die Misteltherapie – erschweren. Fehlendes Fachwissen, fehlende Qualifikationen und fehlende Evidenz zur Wirksamkeit der Misteltherapie beziehungsweise des KIM-Verfahrens werden als Gründe genannt, warum KIM-Verfahren nicht angewendet werden. Da die Herausforderungen in Freitextfeldern angegeben wurden, sind keine Angaben zur Häufigkeit der Nennung möglich.235
Eine Studie von Klein et al. (2017)235 mit 104 Patientinnen berichtet Ergebnisse zum Zugang zur Misteltherapie, wenn auch in geringem Umfang. Zwei Drittel der gynäkologischen Onkologinnen und Onkologen erklären, dass integrative Medizin nicht Teil der klinischen Routinebehandlungen sei. Eine Implementierung integrativer Therapieansätze sei aber zumindest bei 64,7 % davon in Planung. Verzögert werde die Einführung integrativer Konzepte auch dadurch, dass es für Krankenhäuser bisher keine Finanzierung für integrative Therapien gebe. Dadurch sei die Anwendung für das Krankenhaus nicht profitabel und es fehle der Anreiz.235 Als Herausforderungen nannten die Befragten unter anderem einen Fachkräftemangel.
Die finanzielle Belastung durch die Misteltherapie oder Probleme bei der Beschaffung der Mistelpräparate wurden in den eingeschlossenen Publikationen von keiner Patientin erwähnt. Aus Sicht der Ärztinnen und Ärzte wurde zwar erwähnt, dass die Misteltherapie teuer ist, aber von einer Zugangsbeschränkung wurde nichts berichtet.
Patientinnenperspektive – qualitative Studien
Zwei qualitative Studien230,233 berichten Gesichtspunkte, die mit gesellschaftlichen Aspekten bezüglich des Zugangs zur Misteltherapie in Zusammenhang stehen. Bei Gschwendtner et al. (2016)233 berichtet eine Patientin, dass ihr der Zugang zur Misteltherapie über eine anthroposophische Klinik ermöglicht wurde.
Für eine Patientin von Brandenberger et al. (2012)230 eröffnete sich der Zugang zur Misteltherapie durch das ganzheitliche Therapie-Setting, dem sie positiv gegenüberstand. Die Wertschätzung ihrer sozialen Bedürfnisse im Rahmen einer anthroposophischen Behandlung war für sie ein wichtiger Punkt für die Entscheidung eines Behandlungs-Settings. Das ganzheitliche Verständnis war für die Wahl des Settings ausschlaggebend, die Misteltherapie war nur ein Teil der anthroposophischen Behandlung und nicht Hauptgrund für die Inanspruchnahme.
Drei Studien aus der Perspektive des behandelnden Fachpersonals65, 235, 238 zu 654 Befragten beschreiben Informationen zu Erfahrungen mit der Misteltherapie aus Arztperspektive. Zwei qualitative Studien230, 236 zu 13 Patientinnen mit Brustkrebs ergänzen die Erfahrungen aus Patientinnenperspektive.
Studien aus der Perspektive des behandelnden Fachpersonals
Alle drei Studien65, 235, 238 aus der Perspektive des behandelnden Fachpersonals berichten Erfahrungen mit der Misteltherapie als Gründe für und gegen die Anwendung der Misteltherapie. Diese Gründe sind bereits im Abschnitt 5.3.7.2 zur Einstellung gegenüber und Akzeptanz der Misteltherapie berichtet. Die Einschätzung der Wirksamkeit und den Einfluss von KIM-Verfahren auf die Lebensqualität von Kalder et al. (2001)65 sind in Abschnitt 5.3.7.2 berichtet.
Patientinnenperspektive – qualitative Studien
Aus Patientinnenperspektive adressieren nur die qualitativen Studien von Brandenberger et al. (2012)230 zu vier Interviews mit Patientinnen mit Brustkrebs und die Studie von Konitzer et al. (2001)236 mit neun Patientinnen mit Brustkrebs Erfahrungen der Patientinnen mit der Misteltherapie. Die Patientinnen in beiden Studien nehmen durch die Misteltherapie eine stärkere Vitalität und Aktivierung bei sich wahr, die sich in mehr Lebensenergie, schnellerer Erholung nach der akuten Krebserkrankung und eigenem Antrieb ausdrückt.230, 236 Zudem berichten die Patientinnen bei Brandenberger et al. (2012)230 von einer Unterstützung der eigenen Bewältigungsstrategie durch die Misteltherapie, die sich in Form von mehr Autonomie, einer bewussteren Selbstfürsorge und dem Gefühl „eine Chance zu nutzen“, etwas im eigenen Leben besser zu machen, ausdrückt.230 Die berichteten Erfahrungen beziehen sich vor allem auf psychisch-wahrgenommene Erfahrungen, wie der Unterstützung der eigenen Bewältigungs-strategie230, 236, eine bessere Akzeptanz der Krebserkrankung236, sowie eine entspanntere Haltung durch die Misteltherapie230. Die Patientinnen führen diese Verbesserungen direkt auf die Misteltherapie zurück.
Auch die in den Studien zur Sicherheit häufig beschriebenen lokalen Reaktionen an der Einstichstelle wurden genannt. Die Akzeptanz der lokalen Reaktionen ist bei den befragten Patientinnen hoch, denn keine hat die Misteltherapie deshalb abgebrochen. In manchen Fällen wurden diese Reaktionen sogar erwartet und als Bestandteil der Therapie gedeutet.
In der metamorphorischen Analyse von Konitzer et al.236 drücken die Patientinnen unter anderem in Form von Bildern und Metaphern ihr Erleben und ihre Wahrnehmung der Misteltherapie aus. Eine Patientin sieht eine Ähnlichkeit zwischen dem Krebsgeschwür und der Mistelpflanze. Die Mistelpflanze sehe für sie ähnlich diffus aus wie ein Krebsgeschwür. Die Mistel sei am Baum ein Schmarotzer und der Krebs im Körper. Die Überlegung dahinter ist, gleiches mit gleichem zu behandeln. Außerdem sei die Mistel ihr Verbündeter im Kampf gegen den Krebs. Eine andere Patientin sieht die Mistel als Sonne, weil für sie das Leben heller ist und sich auch ihr Wohlbefinden verbessert hat. Für eine dritte Patientin ist die Mistel ein Retter aus dem Teufelskreis.
Mistelanwenderinnen werden auch gebeten, in der Beschreibung ihres Bildes ihre Erfahrungen mit der Misteltherapie mitzuteilen. Der Mistel wird von den Anwenderinnen eine Reihe von Wirkungen auf deren körperlichen und geistigen Zustand zugeschrieben: die Nebenwirkungen der Chemotherapie zu mildern und den Haarausfall stoppen. Des Weiteren wird der Mistel eine stimmungsaufhellende Wirkung zugesprochen, die auch dabei hilft, die Angst vor Herausforderungen zu nehmen, neue Energie zur Krankheitsbewältigung und mehr Luft zu bekommen. Die „goldene Mistel“ sorge außerdem für Gelassenheit und Wohlbefinden. Eine Patientin berichtet von Erfahrungen zu Reaktionen, die umgehend nach der Mistelinfusion bei ihr einsetzen: ein warmer, geröteter Kopf, und empfundene Anstrengung, von der sie sich ausruhen muss.236
Eine andere Patientin erlebt die Misteltherapie als wichtiges Ritual, aus dem sie Kraft schöpft. Das Ritual besteht bei der Patientin nicht nur aus der Mistelinjektion, sondern auch aus der Ruhepause danach. Die Wahrnehmung der Rahmenbedingungen, wo und wie die Misteltherapie verabreicht wird ist Teil der Zufriedenheit mit der Misteltherapie.236
Die ausführlichen Äußerungen sind in Tabelle 78 in der Unterkategorie „Erfahrungen mit und Wahrnehmung der Misteltherapie“ beschrieben (Abschnitt 5.3.7.10.1).
Zwei Studien, eine quantitative von Hübner et al. (2014) 234, mit 80 Patientinnen und eine qualitative von Konitzer et al. (2001)236 berichten Ergebnisse zur Zufriedenheit mit KAM beziehungsweise der Misteltherapie aus Patientinnenperspektive. Die Patientinnen wurden bei Hübner et al. direkt nach deren Zufriedenheit mit der angewandten komplementären Methode befragt. In der Querschnittstudie wurden die Zahlen zur Zufriedenheit mit dem verwendeten KAM-Verfahren über eine Skala von 1 (sehr zufrieden) bis 6 (überhaupt nicht zufrieden) erhoben und berichtet. Mit der Misteltherapie waren, bezogen auf die 15 Anwenderinnen, 50 % zufrieden, 10 % waren indifferent und 40 % waren nicht zufrieden. Gründe für die Unzufriedenheit sind nicht beschrieben. Im Vergleich zu den anderen KAM-Verfahren in der Studie, wie beispielsweise die Gabe von Selen, Enzymen oder Vitaminen, Meditation, Beten, Yoga oder Akupunktur, war die Zufriedenheit mit der Misteltherapie am niedrigsten und die Unzufriedenheit am höchsten.
Die qualitative Studie236, beschreibt eine durchwegs zufriedene Grundhaltung der Patientinnen gegenüber der Misteltherapie. Alle Befragten wenden die Misteltherapie bereits seit mehreren Monaten an und kommen großteils (mehrmals) wöchentlich in eine Allgemeinarztpraxis. Einzelne Patientinnen berichten, dass sie die Misteltherapie genießen und dass ihnen die Mistel hilft, im Alltag zu Hause wieder mehr tun zu können. Dadurch wurden die Anwenderinnen auch wieder selbstständiger zu Hause. Patientinnen beschreiben, dass sie sich nach einer Mistelinfusion zu Hause erholen müssen, aber generell bestärkte die Mistel das Lebensgefühl und gab Kraft. Diese Bestärkung wird auch empfunden, wenn die Mistel nicht mehr im Kopf präsent ist, weil die Misteltherapie schon Teil des Alltags geworden ist. Die Mistel wird auch als „vitales Zentrum des Baums” beschrieben.236 Patientinnen schätzen auch die Rahmenbedingungen, die mit der Misteltherapie verbunden sind. Sie nehmen den Behandlungsraum als besonders positiv wahr, als „gemütlichen Raum des Rückzugs“ und „geschützten Raum“.236
Die Codes zu dieser Zielgröße, befinden sich in Tabelle 78 in der Unterkategorie „Erfahrungen mit und Wahrnehmung der Misteltherapie“. Weitere Ausführungen zu den Ergebnissen der qualitativen Inhaltsanalyse mit Ankerbeispielen sind in Abschnitt 5.3.7.10.1 zu finden.
-
5,3.7.8 Art, Umfang und Bewertung der Patientinneninformation zur begleitenden
In drei Studien230, 234, 235 werden Ergebnisse zur Bewertung der Patientinneninformation berichtet, davon eine quantitative Studie234 zur Patientinnenperspektive mit 80 Patientinnen, einer Studie als der Perspektive des behandelnden Fachpersonals235 mit 104 Ärztinnen und Ärzten sowie einer qualitativen Studie230 mit vier Patientinnen.
Tabelle 76: Ergebnisse zur Patientinneninformation
|
Studie, Jahr |
Beschreibung |
Patientinnenperspektive
|
Hübner (2014) |
Wer erklärt den Patientinnen die Misteltherapie oder hat mit ihnen darüber gesprochen?
Hat sich die/der behandelnde Onkologin/Onkologe ausreichend Zeit für die Beratung genommen?
Onkologin/Onkologe ausreichend Zeit für die Beratung genommen hat
ausreichend war. |
Behandelndenperspektive
|
Klein (2017) |
Wer führt regelmäßig Beratungen zu integrativen Therapiemöglichkeiten durch? (Mehrfachnennungen möglich):
Die Teilnehmenden gaben an, dass für die Auswahl der beratenden Person die erforderliche Qualifikation beziehungsweise das Wissen zum Thema ausschlaggebend ist. Zusatzqualifikationen, die auch von der Ärztekammer anerkannt sind:
|
KAM = Komplementäre und alternative Medizin.
Patientinnenperspektive – quantitative Studien
In der Studie von Hübner et al.234 zu 80 Patientinnen, berichten die meisten Patientinnen, mit 39 %, dass ihnen das komplementäre Verfahren von einer behandelnden Person aus der Gruppe des nichtmedizinischen Fachpersonals vorgeschlagen und erklärt wurde. Das sind mehr nicht-medizinische Beratende als Onkologinnen und Onkologen (mit 33 %) sowie Allgemeinmedizinerinnen und Allgemeinmediziner (mit 28 %). 70 % der Patientinnen waren der Meinung, dass die Beratungszeit zu komplementären Methoden nicht ausreichend war und hätten sich eine Beratung in größerem Umfang gewünscht.
Studien aus der Perspektive des behandelnden Fachpersonals
Die Behandelnden aus der Studie von Klein et al. (2017) 235 gaben an, vor allem in der Follow-up-Phase, nach der Standardtherapie, integrative Therapieformen anzuwenden. Eine Beratung zu integrativer Medizin erfolgte vor allem während der Chemotherapie. In dieser Studie waren die häufigsten integrativen Therapieformen jedoch Sport, Ernährungsberatung, Nahrungsergänzungsmittel und Meditation. Die Misteltherapie liegt bei 36 % der empfohlenen integrativen Therapieformen.235
Die Stichprobe aus der AGO, die zum überwiegenden Teil aus im Krankenhaus tätigen gynäkologischen Onkologinnen und Onkologen besteht, gibt an, dass eine Beratung zu integrativer Medizin zu 92 % durch die Ärztinnen und Ärzte selbst erfolgt. Weitere Gruppen werden in die Beratung, entsprechend erforderlicher beruflicher Qualifikation, einbezogen: Ernährungsberater, Brustkrebspflegekräfte oder Kooperationspartner, wie Heilpraktiker oder spezialisierte Beratungszentren.235 Die in Tabelle 76 genannten Qualifikationen, wie zu Naturheilkunde, Ernährungsmedizin, Akupunktur und weiteren, müssen offiziell von der Ärztekammer anerkannt sein, um im klinischen Setting verordnet zu werden.
Patientinnenperspektive – qualitative Studien
Eine qualitative Studie von Gschwendtner et al. (2016)233 adressiert die Zielgröße Bewertung der Patientinneninformation. Eine Patientin war verärgert über die schlechte Informations- und Beratungslage zur Misteltherapie, da sie interessiert ist, aber sie sich selbst die Informationen nicht beschaffen kann und sie ihr Arzt beziehungsweise ihre Ärztin noch nicht aktiv dazu beraten hatte (siehe Tabelle 80).
In zwei Studien, einer quantitativen Studie234 mit 80 Patientinnen und einer qualitativen Studie233 mit 30 Patientinnen, werden Angaben zur Bewertung der Arzt-Patienten-Kommunikation aus Sicht der Patientinnen gemacht.
Tabelle 77: Ergebnisse zur Bewertung der Arzt-Patienten-Kommunikation aus Sicht der Patientinnen
Studie, Jahr Beschreibung
Patientinnenperspektive
Hübner (2014) Haben Patientinnen in Bezug auf die Fachexpertise Vertrauen in die
behandelnde Person?
-
- Patientinnen, die denken, dass ihre Ärztin oder ihr Arzt gut über KAM informiert ist (53 %)
Die Fachrichtungen der Personen, die von den Patientinnen für kompetent gehalten werden:
-
- Onkologie (12 %)
-
- Allgemeinmedizin (20 %)
-
- Andere ärztliche Fachgebiete (14 %)
-
- Naturheilkunde (19 %)
-
- Nicht-medizinische Fächer (16 %)
-
- Sonstige (18 %)
-
- Kein (14 %)
KAM = Komplementäre und alternative Medizin.
Patientinnenperspektive – quantitative Studien
Die Studie von Hübner et al.234 zu 80 Patientinnen adressiert die Wahrnehmung der Fachkompetenz des behandelnden Fachpersonals bezüglich KAM durch die Patientinnen. Onkologen und andere spezialisierte Fachärzte werden mit zwölf beziehungsweise 14 % für weniger informiert gehalten als Naturheilkundler (19 %) und sogar nicht-medizinisches Fachpersonal (16 %). Die Expertise zu KAM-Verfahren wird in allen Fachrichtungen von eher wenigen Patientinnen als gut beurteilt. 14 % der Patientinnen sind der Meinung, dass sie gar keine Fachrichtung beziehungsweise behandelnde Person kennen, die sich für kompetent in Bezug auf KAM-Verfahren halten. 91 % der Patientinnen (29 von 32), die Nicht-Mediziner/innen (z. B. Heilpraktiker/innen) beziehungsweise deren Fachkompetenz höher als die der behandelnden Ärztin oder des behandelnden Arztes bewerteten, verwenden häufiger komplementäre Medizin.
Studien aus der Perspektive des behandelnden Fachpersonals
Die Arzt-Patienten-Kommunikation aus Sicht der Behandelnden wurde nicht bewertet beziehungsweise nicht berichtet.65, 235, 238 Informationen dazu, wer die Beratung durchführt und welche Qualifikationen die Personen in der Studie von Klein et al. (2017)235 vorweisen, ist in Tabelle 76 beschrieben. Hinweise darauf, dass die Ärzte bei der Kommunikation mit Patientinnen versuchen, entgegenkommend zu sein und die Patientin nach Möglichkeit zu unterstützen, kommen aus der Publikation von Münstedt et al.238, in der beschrieben wird, dass Ärzte die Misteltherapie verordnen, weil Patientinnen diese wünschen (siehe auch Abschnitt 5.3.7.2 zur Akzeptanz der Misteltherapie).
Patientinnenperspektive – qualitative Studien
Nach Angaben der befragten Patientinnen aus der Studie von Gschwendtner et al. (2016)233 findet bei vielen der Patientinnen zumindest eine Arzt-Patienten-Kommunikation statt. Aus den Aussagen der Patientinnen wurden drei Codes abgeleitet. Alle Ankerbeispiele sind in Tabelle 80 in der Unterkategorie „Arzt-Patienten-Kommunikation/Rolle des Arztes für die Therapieentscheidung“ beschrieben. Im Patientinnenkollektiv gaben alle 18 Anwender an, die Mistelinjektionen mit mindestens einer Ärztin oder einem Arzt abgesprochen zu haben. Die Empfehlung der Misteltherapie durch eine behandelnde Person, die sie für kompetent halten, ist für Patientinnen ein wichtiger Grund für die Anwendung, auch wenn die Empfehlung nicht aus dem schulmedizinischen Bereich, sondern von Heilpraktikern kam (siehe Tabelle 80, Code „Kompetenz der beratenden Person). Wenn behandelnde Personen die Misteltherapie nicht direkt ansprechen, kann dies von Patientinnen als Abraten interpretiert werden. Nicht nur das aktive Abraten durch Fachpersonal spielte eine Rolle — auch wenn Fachpersonal die Misteltherapie nicht von sich aus vorschlug, hielt dies Patientinnen von der Inanspruchnahme einer Misteltherapie ab. Patientinnen erklärten, dass sie ihren Ärztinnen oder Ärzten oder dem/der Heilpraktiker/in vertrauten und davon ausgingen, dass diese ihnen empfehlen, was notwendig und hilfreich ist. Dieses Vertrauen war besonders dann groß, wenn sich mehrere Ärztinen und Ärzte z.B. in einem Tumorboard über die Behandlung berieten (siehe Tabelle 80, Code „Vertrauen in behandelndes Fachpersonal“). Patientinnen berichten, dass ihnen teilweise von der Misteltherapie abgeraten wurde, weil sie das Risiko von Wechselwirkungen mit der Standardtherapie als zu hoch einstuften oder weil sie der Meinung sind, dass die Misteltherapie erst im palliativen Setting Sinn macht. Manche Ärzte empfahlen auch andere komplementäre Verfahren anstatt der Misteltherapie, denen sie positiver gegenüber standen (siehe Tabelle 80, Code „Entscheidung gegen die Misteltherapie“).
5.3.7.10 Identifizierte Aspekte aus der qualitativen Inhaltsanalyse
In der Darstellung der Ergebnisse der qualitativen Inhaltsanalyse werden im vorliegenden Bericht drei Ebenen verwendet. Die drei Bereiche auf der obersten Ebene werden als „Hauptkategorien“ bezeichnet, die aus verschiedenen „Unterkategorien“ bestehen, und jeweils in einer eigenen Tabelle dargestellt sind. Jede der Unterkategorien, die in der jeweils ersten beziehungsweise linken Spalte genannt sind, leitet sich aus den kleinsten thematischen Einheiten ab, den „Codes“. Ein Code entspricht einer thematischen Sinneinheit und hat eine konkrete Definition und Beschreibung (2. Spalte, z. B. in Tabelle 78). Die genaue Vorgehensweise im Kodierungsprozess ist im Methodenteil (Abschnitt 3.3.6) beschrieben.
Durch die qualitative Inhaltsanalyse ist ein neues, umfassenderes Codesystem entstanden, das dem ursprünglichen, aus dem EUnetHTA HTA Core Model® abgeleiteten Kodierleitfaden (siehe Tabelle 19) sehr ähnlich ist. Die drei Hauptkategorien „Patientenaspekte“, „gesellschaftliche Aspekte“ und „Kommunikationsaspekte“ wurden beibehalten, aber in der Wortwahl an den Inhalt angepasst. Die gefundenen Inhalte (Kategorien und Codes), die für Patientinnen oder behandelnde Personen in Bezug auf Verwendung der begleitenden Misteltherapie bei Brustkrebs relevant sein können, werden in den drei Tabellen dargestellt: Aspekte bezogen auf die Patientinnenperspektive in Tabelle 78, gesellschaftliche Aspekte in Tabelle 79 und Kommunikationsaspekte in Tabelle 80.
Die drei Hauptkategorien sind getrennt voneinander in Tabelle 78, Tabelle 79 und Tabelle 80 dargestellt. Alle Unterkategorien (in der linken Spalte der jeweiligen Tabelle) bestehen aus mindestens einem Code (fett formatiert), der mit einem Ankerbeispiel beschrieben ist (rechte Spalte). Die kursiv-gedruckten Zitate sind Ankerbeispiele, aus denen die Codes abgeleitet wurden. Für Codes und Zitate, die selbsterklärend sind, wird auf eine zusätzliche Erklärung verzichtet. Für alle anderen Codes wird eine kurze Beschreibung zur Bedeutung des Codes ergänzt. Wenn bestimmte Aspekte stark miteinander verlinkt und aus verschiedenen Perspektiven relevant sind, wird in den Tabellen auch auf bereits vorhandene Codes verwiesen.
Alle Codes aus dem vorläufigen Kodierleitfaden (siehe Tabelle 19) sind in den Publikationen adressiert worden, jedoch wurden manche Codes in einer hierarchischen Struktur zu Unterkategorien zusammengefasst. Andere Codes wurden zu Unterkategorien, weil die Aussagen der Patientinnen beziehungsweise Behandelnden differenzierter waren als der ursprüngliche Ausgangscode.
5.3.7.10.1 Ergebnisse zur Hauptkategorie Patientenaspekte
In Tabelle 78 sind die Unterkategorien und Codes gelistet, die sich aus der Patientinnenperspektive als relevant ergeben haben, zusammengefasst unter der Kategorie „Patientenaspekte“.
Tabelle 78: Ergebnisse zur Hauptkategorie Patientenaspekte
|
Unterkategorie |
Code und Beschreibung (mit Ankerbeispiel) Quelle |
|
Einstellung und Akzeptanz |
Generell kein Interesse an der Misteltherapie Gschwendtner „Nichtanwender gaben zum Teil an, generell kein Interesse an Misteltherapie oder ihr gegenüber eine eher negative Haltung zu haben. Dies war bei manchen Patienten verbunden mit einem generellen Desinteresse an KM-Verfahren, andere hingegen hatten zwar kein Interesse an der Misteltherapie, setzten aber andere KM-Verfahren ein, da sie diese höher bewerteten als die Misteltherapie.’ (S. 218) Neutrale bis positive Haltung Gschwendtner
Unterstützung durch behandelnde Personen und Integration in Gschwendtner Standardtherapie ist wichtig für die Akzeptanz gegenüber der Mistelherapie aus Sicht von Patientinnen „Patienten erklärten, dass sie ihren Ärzten oder dem Heilpraktiker vertrauten und davon ausgingen, dass diese ihnen empfehlen, was notwendig und hilfreich ist. Dieses Vertrauen war besonders dann groß, wenn sich mehrere Ärzte z. B. in einem Tumorboard über die Behandlung berieten/ (S. 219) siehe hierzu auch „Kompetenz der beratenden Person“ in Tabelle 80 KIM bevorzugt vor Schulmedizin Brandenberger „Diese Patientin (F63) sprach ein differenziertes Stufenschema in Bezug auf ihre chronische Arthritis an; dementsprechend würden zunächst komplementäre Therapien zur Anwendung kommen- und wenn es nicht mehr anders geht die konventionellen Behandlungen. (S. 98) Einstellung abhängig vom Gesundheitszustand Gschwendtner „Patienten [gaben] auch an, dass sie möglicherweise ihre Haltung gegenüber KM-Verfahren allgemein und Mistel im Speziellen verändern würden, falls sich ihre Krankheitssituation verschlechtern sollte“ (S. 219) Selbstinjektion Gschwendtner „Fnr einen Teil der Patienten war die Injektion ein Grund für die Nichtanwendung. Die Vorstellung, sich selbst möglicherweise über längere Zeiträume und täglich Injektionen zu setzen, bezeichneten sie als abschreckend:Interview 17: «Und ich glaube, von der Misteltherapie bin ich abgekommen, weil man sich das selber spritzen muss. Und das kann ich, glaube ich, nicht» (Anwenderin).“ (S. 219) Zufriedenheit mit der Standardtherapie mindert das Interesse an weiteren Gschwendtner Therapiemöglichkeiten „Andere sahen hingegen keinen Grund dafür, da die schulmedizinische Behandlung abgeschlossen war bzw. eine Chemotherapie oder Nebenwirkungen nicht gegeben waren“; Ge Gegensatz dazu zeigte sich bei den Nichtanwendern, dass sie schlicht kein Interesse hatten, da sie mit dem Ist-Zustand ihrer Erkrankung und Behandlung zufrieden waren oder davon ausgingen, dass die Misteltherapie in ihrer spezifischen Situation nicht hilfreich sei. “ (S. 218) |
Gründe für die Verwendung der Misteltherapie Gschwendtner
-
- Aktiv etwas tun
„Wunneb, aktiv neben der biomedizinischen Therapie den Heilungsprozess zu unterstützen, trat als Grund hervor, sich für eine Misteltherapie zu entscheiden: Interview 19: «Ich habe so das Gefühl, dass die [Mistel] mich so ein bisschen trägt. Dass die mir so ein bisschen, dass die mich so ein bisschen […] unterstützt» (Anwenderin).“; „In2e«iiew 82: «Ich hatte nur das Gefühl, ich muss was mitmachen» (Anwenderin).“ (S. 218)
-
- Misteltherapie als letzte Option
Bei einer Patientin, die eine systemische Therapie abbrechen musste, unterstützte die MT die Krankheitsbewältigung der Patientin als letzte Hoffnung: „da unter der konventionellen Behandlung in Form einer Chemotherapie Komplikationen auftraten, sodass sich die Patientin zum Abbruch der Chemotherapie entschied“ (S. 218)
Erwartungen an Wohlbefinden erhöhen Brandenberger,
die Misteltherapie - „Neben der Beeinflussung des Tumors, waren aber auch der die* Gschwendtner
Wünsche, mithilfe der Misteltherapie das eigene Wohlbefinden zu erhöhen bzw. sich für die biomedizinische Therapie zu stärken und Nebenwirkungen dieser Therapien zu lindern, wichtige Beweggründe für die Anwendung der Misteltherapie“ (Gschwendtner, S. 218)
-
- Für eine Patientin ist die MT Ausdruck für das komplementärmedizinische Therapie-Setting, in dem sie sich wohl fühlt.
„bestimmte Erwartungen an das komplementärmedizinische Behandlungssetting, das sie im Zusammenhang mit dem MT-Angebot als befriedigend empfand, nach Gesprächen/hinterlegtem Menschenbild, zeitlicher Ausdehnung des Angebotes.“ (Brandenberger, S. 99)
Beeinflussung des Tumorwachstums durch Stärkung des Gschwendtner
Immunsystems
„Manche Patienten wollten über die Misteltherapie den* Tumorwachstum stoppen oder verlangsamen bzw. einem Rezidiv Vorbeugen. Zum Teil gingen die Patienten davon aus, dass dies über eine Stärkung des Immunsystems gelingen könnte“ (S. 218)
Erwartete Sicherheit und Natürlichkeit der Misteltherapie Gschwendtner
„Pättenten wägten die Anwendung einer Misteltherapie hinsichtlich der Anwendungssicherheit des Verfahrens ab. Anwender schätzten die Misteltherapie als sicher ein, da sie diese als ein pflanzliches Verfahren verstanden: Interview 53: «Aber es is’ schon die Schiene, wo ich sag’, wenn möglich, mit Natur arbeiten oder naturähnlichen Stoffen>(S. 219)
Zweifel an der Wirksamkeit der Misteltherapie Gschwendtner
„Patiented nahmen die Misteltherapie nicht in Anspruch, da sie nicht glaubten, dass sie Einfluss auf das Tumorwachstum hat. Manche Patienten führten dafür die unsichere Studienlage an, andere berichteten von Bekannten, die die Misteltherapie verwendet hatten, erneut erkrankt oder «trotz der Misteltherapie» gestorben waren (S. 218)
Mögliche Wechsel- und Nebenwirkungen Gschwendtner
„Nichtanwender hingegen befürchteten Neben- oder Wechselwirkungen der Misteltherapie. Hier wurden z. B. Allergien als Grund angegeben, wobei nicht klar wurde, ob eine allergische Reaktion befürchtet wurde oder unter einer Misteltherapie eine allergische Reaktion aufgetreten war. “ (S. 219)
Befürchtete Förderung des Tumorwachstums Gschwendtner
„Patienten befürchteten mögliche Neben- oder Wechselwirkungen mit schulmedizinischen Therapien; dabei wurden die möglichen Nebenwirkungen nicht immer konkret benannt. Befürchtet wurde aber z. B. auch eine mögliche Förderung des Tumorwachstums.“ (S. 219)
|
Erfahrungen mit |
Unterstützung der eigenen Bewältigungsstrategie Brandenberger |
|
und |
Die Patientinnen erleben die Misteltherapie als eine Unterstützung in |
|
Wahrnehmung |
verschiedenen Bereichen des Lebens, die über das medizinisch belegbare |
|
der |
Wirkspektrum eines Medikaments weit hinausgehen. Patientinnen äußern |
|
Misteltherapie |
folgende Verbesserungen: |
-
- Mehr Autonomie: JD/e Patientin äußert], dass sie diese Behandlung «wider» den Arzt aufgenommen habe, was als Autonomieschritt verstanden werden kann. “ (S. 98)
-
- Ausdruck bewusster Selbstfürsorge: „intensiver Versuch, die therapeutische Strategie mit dem subjektiven Krankheitsmodell (Krebs als Ausdruck eines Traumas, bewusste Selbstfürsorge) in einen logischen Zusammenhang zu bringen.“ (S. 98)
-
- Nutzung einer Chance für das eigene Leben: „Hinweis, etwas in ihrem Leben zu verbessern, häufig im Sinne einer mehr bedürfnisorientierten Abgrenzung (F42: «Ich probiere, mich nicht mehr hetzen zu lassen. Ich probiere, eines nach dem anderen zu machen.»)“ (S. 98)
-
- Entspanntere Haltung und weniger Depression: z. B. „F63 erwähnte, dass sie Dinge nicht mehr so ernst nehme wie zuvor. Sie könne besser zwischen wichtigen und weniger wichtigen Dingen unterscheiden. “ (S.98)
-
- Bessere Akzeptanz der Krebserkrankung
Das Erleben einer guten Krankheitsbewältigung – körperlich und psychisch – wird von Patienten als Wirkung der Misteltherapie interpretiert.
“[Patientinnen erleben] eine neue Art von Akzeptanz/einen adaptierten Umgang mit ihrer Erkrankung/eine regenerative Kräftigung, Vitalisierung (F56: «Ich merke jetzt, dass ich viel näher bin zu meiner Krankheit»;
F56: «Ich spüre mich etwas kräftiger innerlich»; F63: «Ich bin im Moment überzeugt, dass ich gesund bin» sowie «Manchmal denke ich mir, ich fühle mich überhaupt gesund… für was mache ich das alles, es geht mir so gut…»“ (S.98)
|
Aktivierung - Wirkung gegen die Müdigkeit “im Gegensatz zu von vor vier Jahren war das wesentlich müder. Jetzt hat ich die Mistel jetzt war ich schnell wieder auf’n Beinen.”(Konitzer S. 75) |
Brandenberger, Konitzer |
Mistel hilft aus dem „Loch“
“ich kann’s sagen [dass das mit der Mistel zusammenhängt], weil ich gar nicht anderes gekriegt habe, nur Mistel. Ich hab’s wirklich gemerkt und ich war einem fürchterlichen Loch damals und kam überhaupt nich wieder hoch und ja das hat mich also richtig wiederaufgerichtet” (Konitzer S. 75)
Stärkere Vitalität:
„Stärkere Vitalität [bei] F56, F63 [und] F69 siehe Tabelle 2 in der Publikation (Brandenberger S. 98)
Konitzer
Zufriedenheit der Wirkung der Mistel auf das Alltagsleben
-
- „Mistel als vitales Zentrum des Baums”
-
- Genießen der Misteltherapie
„hier hab ich das genonossen […] danach hab ich mich allerdings zuhause nochmal n bisschen hingelegt” (S. 75)
-
- Lebensgefühl
„Eben ja, das äh Lebensgefühl ist wieder da und […] soll sich nur verstärken, also ja, die Mistel is eigentlich schon gar nich mehr zu sehn’ die wirkt schon im Geäst” (S. 74)
-
- Selbstständigkeit
„und: ähm hab dann auch wieder zu Hause mehr tun können” (S. 72)
Erleben der Wirksamkeit der Mistel:
-
- „die erste Reaktion war wie ich abends heim kam so nach ein zwei Stunden, ich hatte immer so einen knallroten Kopf, fühlte mich ganz warm und war eigentlich – ja, ich fühle mich warm und gleichzeitig war ich aber auch angestrengt” (S. 73)
-
- Milderung der Nebenwirkung der Chemotherapie/stoppt Haarausfall
„Gesundhettsbegletter. Ich fühle mich ruhig und entspannt, wenn die goldene Mistel in meinen Körper fliesst. Der Haarausfall stoppte! Die Begleiterscheinungen der Chemo wurden gemildert. Es ging (geht) mir gut!” (S. 76)
-
- Wohlbefinden erhöht sich durch Erleichterung:
„Settdem ich jetzt die Mistel hab […] mein Wohlbefinden ist irgendwie besser geworden, es ist alles wieder heller geworden, lichter. Damit verbunden auch Fröhlichkeit und auch die Seele, … da hab ich mich dann auch langsam wohler gefühlt“ (S. 72)
-
- Wohlbefinden erhöht sich durch Bewältigung:
„ich war in so ein ziemliches Loch gefallen, aber durch diese Mistel, denk ich mal, die hat mir also zumal ich seit drei Monaten, also zwei Monaten eigentlich durch die Pause ja, das hat mir alles unheimlich viel gebracht. Äh, ich denke mal, ich schaff das auch in meinem Alltag schon wieder n bisschen besser, ähm, dass einfach das ganze Wohlbefinden” (S. 73)
-
- Kräftigung
„Dann leg ich mich hin und ähm ruh mich danach aus und fühle mich eigentlich damit ganz stark und so dass mich das dann […] kräftigt, ja ich fühl mich da sicher mit” (S. 74)
-
- Angst nehmen
„denk ich schon, dass die dazu beigetragen äh Angst zu nehmen, ne und was ich noch schmecke auch die Mistel, wo wie ich die Mistel angesetzt kriege hab ich – es gab doch früher diese dicken Himbeer. So schmeckt das, sofort geht das los, hab sofort den Geschmack auf der Zunge […] ich krieg mehr Luft” (S. 75)
Wahrnehmung der Mistel
Konitzer
Konitzer
-
- Mistel als Krebs und Schmarotzer
„ die Mistel, die sieht bei mir so aus wie der Krebs selbst, wenn man manchmal den Krebs abgebildet sieht ist es immer so, so zusammen, so so’n Gewusele und Mistel ’n Baum auch, das sieht fast aus wie Krebs im Baum, und da hab ich gedacht vielleicht wird ja Gleiches mit Gleichem, das sagt an ja manchmal dass das hilft, und ich denke mir wenn die Mistel genauso aggressiv ist wie der Krebs, dann ist es ja nur gut. […] ich habe äh das Gefühl, dass die Mistel irgendson Verbündeter ist, und äh ich eben um den Krebs” (S. 73)
-
- Aufhellung des Wohlbefindens
„Soll die Sonne sein. Seitdem ich die Mistel habe […] mein Wohlbefinden ist irgendwie besser geworden, es ist alles wieder heller (S. 72)
-
- Ausbruch aus Teufelskreis
Die Mistel sei außerdem „wie so’n Retter ausm Teufelskreis” (S. 74)
Ritual
Konitzer
„Ritual führt zur Stärkung”; “spritze mir das selber, mach das auch weiter. [ich mache da] so’n kleines Ritual dann auch immer daraus wenn ich es mir spritze. Dann leg ich mich hin und ähm ruh mich danach aus und fühle mich eigentlich damit ganz stark und so dass mich das dann […] kräftigt, ja ich fühl mich da sicher mit” (S. 74)
|
Mistel als gemütlichen Raum des Rückzugs Die Misteltherapie stellt einen geschützten Raum dar. Auch der Raum, in dem die Misteltherapie verabreicht wird, wird gerne aufgesucht. „den [Raum] find ich sehr schön, als ich den zum ersten mal gesehn hab da, ich hab gar nich die Schläuche gesehn. Ich hab nur gesehen wie gemütlich das hier ist […] ich hab mich sehr wohl hierdrin gefühlt.” (S. 75) |
Konitzer |
Hohe Akzeptanz gegenüber Nebenwirkungen Brandenberger
Patientinnen, die aufgrund der Misteltherapie Rötungen hatten, interpretierten diese nur teilweise als unerwünschte Nebenwirkungen, sondern vor allem wurde dadurch deren Erwartung erfüllt.
„Analygen [..] zeigten auf, dass es in manchen Fällen zu Reaktionen unter Misteltherapie kam, die einerseits als Nebenwirkungen gedeutet werden können, anderseits als Bestandteil von erwarteten Reaktionen der subkutanen Misteltherapie aufzufassen sind“ (S. 98)
„Ke/ne der Patientinnen unterbrach die Misteltherapie aufgrund der
FSeaktionen yS 98)__________________________________________________________________
Reflektierter Zugang Brandenberger
Abwägung der Patientin vor der Inanspruchnahme der Misteltherapie „Anlässlich sehr differenzierter Rückmeldungen zur Wirkung/Nebenwirkung der Misteltherapie zeigte sich eine sehr bewusst geführte
Auseinandersetzung mit verschiedenen (herapeutisehen Optionen” (S. 98)
*Das Zitat ist korrekt, aber die Grammatik im Originaltext in der Publikation ist fehlerhaft.
-
**Zur besseren Verständlichkeit wird bei Zitaten zu Konitzer et al. (2001) auf Interpunktionszeichen und Schriftsprache, die in der Transkription der Tonaufnahmen verwendet wurden zum Zweck der Beschreibung zusätzlicher Informationen, verzichtet. Der Text wird dennoch in Anführungszeichen gesetzt, um deutlich zu machen, dass der Text aus der Publikation zitiert wird.
KIM = Komplementäre und integrative Medizin. KM = Komplementärmedizin.
Gesellschaftliche Aspekte sind sämtliche Gesichtspunkte, die übergeordnet sind und sich auf die Rahmenbedingungen innerhalb des Gesundheitssystems beziehungsweise innerhalb der Gesellschaft beziehen. Diese Hauptkategorie deckt vor allem den Bereich ab, der nicht vom Handeln der Patientin beeinflusst werden kann, z. B. die Infrastruktur, dass die Misteltherapie nicht angeboten oder nicht vergütet wird. Auch ein mangelnder Zugang zu Informationen fällt in den Bereich der gesellschaftlichen Aspekte, nicht jedoch, wie die Arzt-Patienten-Kommunikation und Patientinneninformation gestaltet ist (siehe hierzu Abschnitt 5.3.7.10.3 zur Hauptkategorie „Kommunikation und Information“).
Tabelle 79: Ergebnisse zur Hauptkategorie gesellschaftliche Aspekte
|
Unterkategorie |
Code und Beschreibung |
Quelle |
|
Zugang |
Zugang über anthroposophische Klinik Das Therapie-Setting, in dem sich die Patientin befindet, kann den Zugang zur Misteltherapie beeinflussen daa.] dann hab’ ich’s halt abgebrochen und bin in diese [anthroposophische Klinik] 5 Wochen, da wurde ausgetestet, was für Mistel für mich infrage kommt, hab’ ich Mistelspritze bekommen» (Anwenderin/“ (S. 218) |
Gschwendtner |
|
Wertschätzung erfüllter sozialer Bedürfnisse |
Beeinflussung der Therapiewahl Patientinnen haben soziale Bedürfnisse, deren Erfüllung die Therapiewahl beeinflussen können: „bestimmte Erwartungen an das komplementärmedizinische Behandlungssetting, das sie im Zusammenhang mit dem MT-Angebot als befriedigend empfand, nach Gesprächen/hinterlegtem Menschenbild, zeitlicher Ausdehnung des Angebotes. Auch versuchte sie eine neue Gestaltung und Orientierung ihrer Ausrichtung an die Arbeit und berichtete über ein Gefühl der Befreiung («… ich merke jetzt auch in Bezug auf Beziehungen, … ich muss jetzt nicht mehr überall dabei sein. Ich darf mich abgrenzen. Für mich ist das fast etwas wie eine kleine Erleichterung.»).“ (S. 99) |
Brandenberger |
MT = Misteltherapie.
Die Hauptkategorie „Kommunikation und Information“ bezieht sich auf die Arzt-PatientenKommunikation und Patientienteninformation. Relevante Aspekte sind, welche Möglichkeiten und Informationsquellen den Patientinnen zur Verfügung stehen, um sich über mögliche KIM-Interventionen, insbesondere zur Misteltherapie, zu informieren und wie Patientinnen zur Misteltherapie beraten werden.
Tabelle 80: Ergebnisse zur Hauptkategorie „Kommunikation und Information
|
Unterkategorie |
Code und Beschreibung |
Quelle |
|
Arzt-PatientenKommunikation – Rolle der Ärztin oder des Arztes für die Therapieentscheidung |
Kompetenz der beratenden Person Mit wem sprechen die Patientinnen und wer erklärt den Betroffenen die Wirkweise von KAM beziehungsweise der Misteltherapie? „Die Empfehlung durch Fachpersonal war für die meisten Patienten ein wichtiger Aspekt bei der Entscheidung für oder gegen eine Misteltherapie. Vielen Anwendern war die Misteltherapie z.B. in einer anthroposophischen Klinik oder von nichtärztlichen Gesundheitsdienstleistern, z.B. Heilpraktikern, empfohlen worden. Auch Ärzte empfahlen die Misteltherapie, zum Teil von sich aus und zum Teil nachdem Patienten sich danach erkundigt hatten. Alle 18 Anwender haben den Gebrauch der Misteltherapie mit einem oder mehreren Ärzten verschiedener Fachrichtungen abgesprochen. “ (S. 219) |
Gschwendtner |
|
Vertrauen in behandelndes Fachpersonal „Nicht nur das aktive Abraten durch Fachpersonal spielte eine Rolle – auch wenn Fachpersonal die Misteltherapie nicht von sich aus vorschlug, hielt dies Patienten von der Inanspruchnahme einer Misteltherapie ab. Patienten erklärten, dass sie ihren Ärzten oder dem Heilpraktiker vertrauten und davon ausgingen, dass diese ihnen empfehlen, was notwendig und hilfreich ist. Dieses Vertrauen war besonders dann groß, wenn sich mehrere Ärzte z.B. in einem Tumorboard über die Behandlung berieten“; „Interview 11: «Ich habe … wissen Sie, ist doch ganz einfach … wenn das [die Misteltherapie] bewiesen wäre, dann hätte mein Onkologe doch müssen sagen, … und ich war ja nicht nur bei ihm, da in der Ambulanz» (Nichtanwenderin).“ (S. 219) |
Gschwendtner |
|
|
Entscheidung gegen die Misteltherapie Die Arzt-Patienten-Kommunikation ist stark gekoppelt an die Gründe für und gegen die Verwendung der Misteltherapie aus Arztsicht, z. B. die Einschätzung, dass die Misteltherapie erst im palliativen Setting sinnvoll ist; „Patienten [wurde] von Ärzten aus verschiedenen Gründen davon abgeraten. Für manche Ärzte war es ein Verfahren, das erst in der Palliativsituation zum Tragen kommt, andere befürchteten Wechselwirkungen mit schulmedizinischen Therapien. Manchmal wurden stattdessen andere Verfahren, wie z.B. eine Selengabe, empfohlen: Interview 2: «Hm, ich habe mit meinem Hausarzt wohl da drüber gesprochen. Der fand es auch nicht so doll» (Anwenderin).“ (S. 219) |
Gschwendtner |
|
|
Patientinneninformation |
Informations- und Beratungslage zur Misteltherapie nicht ausreichend „[Etne Patientin hat] Verärgerung darüber geäußert, dass die Informations- und Beratungslage zur Misteltherapie nicht ausreichend sei: Interview 18: «Und das [die Misteltherapie] möchte ich jetzt eigentlich morgen dann bei der Visite mit dem Arzt hier besprechen, wie es aussieht. Ob es auch für mich, für mein Immunsystem, gut ist. Ob es was bringt» Nichtanwenderin).“ (S. 220) |
Gschwendtner |
KAM = Komplementäre und alternative Medizin.
In der Auswertung der 17 Fachartikel konnten 22 ethische Aspekte herausgearbeitet werden. Durch die ergänzende theoretische Reflexion wurden vier weitere ethische Aspekte identifiziert, die nicht in der eingeschlossenen Literatur abgebildet waren. Ebenso hat die Literaturrecherche keine spezifischen Beiträge zu berufsethischen Aspekten geliefert. Aus den anderen Domänen sind keine weiteren Aspekte ergänzt worden. Dadurch konnten insgesamt 26 ethische Aspekte identifiziert werden, die für die begleitende Misteltherapie bei Brustkrebs potenziell relevant sein können.
Die 26 ethischen Aspekte wurden in sechs Hauptkategorien eingeteilt. Diese entsprechen den verwendeten ethischen Prinzipien (Nutzen, Schaden, Selbstbestimmung, Gerechtigkeit, Effizienz (Kosten), Legitimität). Für die Prinzipien „Gerechtigkeit“ und „Legitimität“ ließen sich keine ethischen Aspekte zuordnen. Zur konkreteren thematischen Einteilung der Aspekte wurden ferner acht Unterkategorien gebildet. Von den 26 Aspekten wurden 21 als ethische Risiken (Gefahr, ein ethisches Prinzip unzureichend zu berücksichtigen) und fünf als ethische Herausforderungen (Abwägung zwischen ethischen Prinzipien erforderlich) klassifiziert (siehe Tabelle 81).
Tabelle 81 führt die gefundenen ethischen Aspekte mitsamt Haupt- und Unterkategorie sowie der Quelle (Literatur, theoretische Reflexion) auf, Das erste Wort in der Bezeichnung des konkreten ethischen Aspekts verdeutlicht, ob es sich um ein ethisches Risiko oder eine ethische Herausforderung handelt.
Tabelle 81: Ethische Aspekte bei der begleitenden Misteltherapie bei Brustkrebs
|
Unterkategorie |
Konkreter ethischer Aspekt |
Quelle |
|
Nutzen |
||
|
Realisierung von Nutzenpotenzialen durch Intervention |
Risiko, dass Patientinnen/Patienten den medizinischen Nutzen von KIM überschätzen |
Adams |
|
Beurteilung des Outcomes/der Evidenz |
Risiko, dass Ärztinnen/Ärzte das Outcome/die Evidenz spezifischer KIM-Interventionen unzureichend prüfen (z. B. aufgrund von Voreingenommenheit) |
Adams, Tilburt/Miller |
|
Risiko, bei der Beurteilung der Outcomes nur medizinische krebsspezifische Effekte zu berücksichtigen |
Braun, Cohen, Tilburt/Miller |
|
|
Herausforderung, aufgrund uneindeutiger Evidenz oder divergierender Expertenmeinungen das Outcome beziehungsweise den Nutzen einer Intervention ausreichend abzuschätzen |
Cohen, Ernst |
|
|
Schaden |
||
|
Einschränkungen und Schadenspotenziale für die/den Patientin/Patienten durch Nicht-Realisieren der KIM- |
Risiko, unter mit KIM behandelbaren Nebenwirkungen der konventionellen Therapie zu leiden |
Adams, Mertz, Smith |
|
Herausforderung, den Zeitpunkt der situationsadäquaten Anwendung der KIM-Intervention zu bestimmen |
Cohen |
|
|
Intervention (und deren möglichen Nutzenpotenzialen) |
Risiko, durch Nicht-Realisierung der KIM-Intervention psychischen Schaden zu nehmen (z. B. Verlust von wahrgenommener Handlungswirksamkeit) |
Adams, Ben-Arye et al., Sugarman |
|
Outcome-bezogene Schadenspotenziale |
Risiko, durch die KIM-Intervention eine (nützliche) konventionelle Behandlung zu behindern oder zu verhindern |
Adams, Ben-Arye et al, Braun, Mertz, Sade, Verhoef |
|
Risiko der schlechten Kommunikation zwischen Ärztinnen/Ärzten und KIM-Behandelnden und daraus resultierenden Informationslücken bezüglich der Behandlungsmodalitäten |
Braun |
|
|
Herausforderung, KIM-Interventionen mit voraussichtlich nur einem Placebo-Effekt anzubieten oder durchzuführen |
Lynoe, Smith, Torcello |
|
|
Herausforderung, einen Nocebo-Effekt zu riskieren bei vollständiger Aufklärung über einen möglicherweise geringen oder ausbleibenden Nutzen der KIM-Intervention |
Theoretische Reflexion |
|
|
Negative Begleiteffekte und Schadenspotenziale durch die KIM-Intervention |
Risiko, möglichen Schaden durch Wechselwirkungen zwischen konventioneller Therapie und KIM-Intervention zu erleiden |
Braun, Fletcher, Sugarman, Tilburt und Miller, Verhoef |
|
Risiko, dass die möglichen Nebenwirkungen und Lebenseinschränkungen einer KIM-Intervention unterschätzt werden |
Sugarman, Verhoef |
|
|
Risiko, dass die Verwendung wissenschaftlich nicht gestützter oder sogar dem Stand wissenschaftlichen Wissens widersprechender Interventionen die Qualität der Medizin beziehungsweise der medizinischen Versorgung tangiert |
Theoretische Reflexion |
|
|
Selbstbestimmung |
||
|
Informierung über die möglichen KIM-Interventionen und über die Erkrankung |
Risiko, dass Fachpersonal unzureichende Kenntnis der KIM-Interventionen hat und Patientinnen/Patienten nicht adäquat informieren kann |
Adams, Lynoe, Verhoef et al., Ben-Arye et al., |
|
Risiko, dass die Ärztin/der Arzt ihre/seine medizinische Rolle überbetont sowie Werte und Überzeugungen der Patientinnen/Patienten nicht berücksichtigt |
Adams, Lynoe, Tilburt und Miller, Sade |
|
|
Risiko, dass Patientinnen/Patienten nicht ausreichend aufgeklärt werden können aufgrund möglicher fehlender/unklarer Evidenz der Wirksamkeit und der Wirksamkeitsmechanismen einer KIM-Intervention |
Ernst, Gruner, Sade, Shahvisi, Verhoef |
|
|
Risiko, dass KIM-Behandelnde nicht-ausreichendes medizinisches Wissen haben, um Patientinnen/Patienten adäquat über eine KIM-Intervention aufzuklären (vor allem Nutzen/Schaden) |
Gruner, Lynoe |
|
|
Risiko, dass KIM-Behandelnde aus Eigeninteressen nicht ausreichend über KIM-Intervention und/oder konventionelle Intervention aufklären |
Mertz, Tyreman |
|
|
Risiko eines Missverständnisses auf der Patientenseite, dass die KIM-Intervention der Behandlung der Haupterkrankung dient, obwohl die Intervention nur der Steigerung der Lebensqualität dient |
Theoretische Reflexion |
|
|
Herausforderung, zu bestimmen, welche Informationen in welchem Detailgrad für eine informierte Einwilligung bei einer KIM-Intervention erforderlich sind (z. B. auch Informationen über eine damit verbundene Weltanschauung, Überzeugungen etc.) |
Theoretische Reflexion |
|
|
Arzt-Patienten-Verhältnis |
Risiko, arztseitig durch Ablehnung einer gewünschten KIM-Intervention ein langjähriges (gutes) Arzt-Patienten-Verhältnis zu beeinträchtigen |
Ben-Arye et al., Lynoe, Verhoef et al. |
|
Risiko, dass Patientinnen/Patienten ihre Ärztin/ihren Arzt nicht über (zusätzliche) KIM-Interventionen informieren (z. B. https://web.archive.org/web/20150316155306/http://www.rtog.org/LinkClick.aspx?fileticket=GEJNxEAm7VA%3D&tabid=118 aus Angst vor Ablehnung) |
Braun, Lynoe, Sade, Verhoef |
|
|
Einschränkungen der Performanz der Selbstbestimmung |
Risiko, dass Patientinnen/Patienten in ihren Entscheidungen über eine KIM-Intervention stark von außen (z. B. durch Medien, Familie, Freunde) beeinflusst werden |
Braun |
|
Risiko, aufgrund bestimmter weltanschaulicher (z. B. metaphysischer) Annahmen bei der Entscheidungsfindung über eine KIM-Intervention unter Druck gesetzt zu werden |
Tyreman |
|
|
Gerechtigkeit |
||
|
- |
Kein ethischer Aspekt zuordenbar |
|
|
Effizienz (Kosten) |
||
|
- |
Risiko, dass für die Patientin/den Patienten hohe Kosten für (zusätzliche) KIM-Interventionen entstehen können (insbesondere, wenn deren Nutzen unklar ist) |
Braun, Ernst |
|
Legitimität |
||
|
- |
Kein ethischer Aspekt zuordenbar |
|
KIM = Komplementäre und integrative Medizin.
Auf Grundlage der oben dargestellten ethischen Aspekte können folgende Kriterien für die begleitende Misteltherapie bei Brustkrebs konkretisiert werden:
Tabelle 82: Ethische Kriterien für den Einsatz einer begleitenden Misteltherapie bei Brustkrebs
Ein ethisch vertretbarer Einsatz einer begleitenden (palliativen/adjuvanten) Misteltherapie bei Brustkrebs erfordert, …
|
a) |
… dass der medizinische bzw. nicht-medizinische und/oder nicht-krebsspezifische (z. B. psychische) Nutzen der Misteltherapie respektive die dazu vorliegende Evidenz ausreichend und unvoreingenommen geprüft wird und von keiner der Beteiligten (Ärztinnen/Ärzte, Patientin, KIM-Behandler) unter- oder überschätzt wird. |
|
b) |
… dass der Patientin mögliche gesundheitliche Vorteile (inklusive psychischer, aber auch behandelbare Nebenwirkungen der konventionellen Therapie) durch eine begleitende Misteltherapie nicht unnötig oder willkürlich vorenthalten werden; eine zulässige Begründung können anderweitige, schwerer zu gewichtende gesundheitliche negative Effekte aufgrund der Durchführung der Misteltherapie und/oder positive Effekte aufgrund ihrer Unterlassung sein (z. B. Wechselwirkungen, mögliche Nebenwirkungen der Misteltherapie, mögliche Lebenseinschränkungen). |
|
c) |
… dass sichergestellt wird, dass die beteiligten Ärztinnen/Ärzte und KIM-Behandelnde sowohl hinsichtlich der begleitenden Misteltherapie kompetent sind als auch hinsichtlich medizinischen Wissens bzw. hinsichtlich der konventionellen Therapie (z. B. Nutzen/Schaden, Ablauf der Therapie), um vor allem Patientinnen adäquat aufklären/informieren zu können. |
|
d) |
… dass Patientinnen auch neutral über mögliche fehlende oder unklare Evidenz zur Wirksamkeit der begleitenden Misteltherapie aufgeklärt/informiert werden, aber auch über mögliche fehlende oder kontroverse Theorien der Wirksamkeitsmechanismen; diese Verpfichtung gilt sowohl für Ärztinnen/Ärzte als auch für KIM-Behandelnde. |
|
e) |
… dass sichergestellt wird, dass die (z. B. weltanschaulichen) Überzeugungen und Werte der Patientin bei einer Informierung über die Misteltherapie auch dann berücksichtigt werden, wenn die Ärztin/der Arzt eine andere Haltung dazu einnimmt, um so unter anderem ein gutes Arzt-Patientenverhältnis aufrechtzuerhalten und zu verhindern, dass die Patientin sich nicht über eine anderweitig durchgeführte Misteltherapie informiert. |
|
f) |
… dass sichergestellt wird, dass die Patientin verstanden hat, dass die begleitende Misteltherapie nur der Steigerung der Lebensqualität dient (z. B. durch Linderung von Nebenwirkungen) und nicht der Behandlung des Brustkrebs. |
|
g) |
… dass sowohl Ärztinnen/Ärzte als auch KIM-Behandelnde beachten sollten, dass bei einer Patientin auch ein innerer oder äußerer Druck dazu bestehen könnte, die Misteltherapie zu wählen (z. B. bestimmte metaphysische/spirituelle Annahmen, aber auch das Familienumfeld, Freunde, Vereine usw.), diese Entscheidung daher möglicherweise nicht ausreichend autonom getroffen worden ist. |
|
h) |
… dass Patientinnen, die eine adjuvante (nicht-alliative) Misteltherapie wünschen, mit den allfälligen Kosten nicht überfordert werden (diese z. B. erstattet werden können), insbesondere wenn der Nutzen der Misteltherapie für die Patientin im Einzelfall fraglich ist. |
KIM = Komplementäre und integrative Medizin.
Folgende Konflikte sind darüber hinaus zu beachten:
Tabelle 83: Ethische Konflikte beim Einsatz einer begleitenden Misteltherapie bei Brustkrebs
Ein ethisch vertretbarer Einsatz einer begleitenden (palliativen/adjuvanten) Misteltherapie bei Brustkrebs muss abwägen, …
|
a) |
… ob die Misteltherapie bei uneindeutiger/fraglicher Evidenz oder divergierenden Expertenmeinungen hinsichtlich der Wirksamkeit oder aber einem voraussichtlich nur als Placebo-Effekt aufzufassenden Nutzen überhaupt angeboten und/oder vor llem bei Wunsch der Patientin durchgeführt werden soll. |
|
b) |
… wann der Einsatz der Misteltherapie situationsadäquat bei der jeweiligen konkreten BrustkrebsErkrankung und Patientin ist (Wahl des Zeitpunkts). |
|
c) |
… welche medizinischen, lebenspraktischen und weltanschaulichen Informationen über die Misteltherapie für die jeweilige Patientin erforderlich sind, damit diese eine ausreichend informierte Entscheidung (Zustimmung/Ablehnung) treffen kann. |
|
d) |
o. ob eine vollständige Aufklärung über einen möglicherweise geringen Nutzen der Misteltherapie für die Patientin oder über einen Placebo-Effekt auch das Risiko eines Nocebo-Effekte mit sich bringt, der die Lebensqualität der Patientin verschlechtert. |
Die Kriterien und die Konflikte wurden auf Kohärenz und Konsistenz mit den Ergebnissen der anderen Domänen geprüft.
Es wurde ein HTA-Bericht zur medizinischen Wirksamkeit und Sicherheit der begleitenden Misteltherapie bei Patientinnen mit Brustkrebs durchgeführt. Darüber hinaus wurden gesundheitsökonomische, Patienten- und soziale sowie ethische Aspekte untersucht. Die Ergebnisse werden in den folgenden Abschnitten zusammengefasst und diskutiert.
Es wurden im Rahmen dieses HTA-Berichts ein RCT142, 144 mit kleiner Stichprobengröße identifiziert, das den Effekt einer begleitenden Misteltherapie auf das progressionsfreie Überleben nach fünf Jahren untersuchte. Die Studie hatte drei Behandlungsarme, davon zwei mit verschiedenen Mistelpräparaten (Iscador® und Helixor®). Beide Studiengruppen mit Mistelpräparaten wiesen keinen Unterschied im krankheitsfreien Überleben, definiert als ohne Rezidive oder Metastasen, gegenüber der Kontrollgruppe auf. Das krankheitsfreie Überleben nach fünf Jahren betrug 72,4 % in der Iscador®-, 67,9 % in der Helixor®- und 78,6 % in der Kontrollgruppe. Der Unterschied zwischen den Interventionsgruppen und der Kontrollgruppe war nicht statistisch signifikant (p‑Wert: 0,551 beziehungsweise 0,746).
Geeignete Studien, die das Gesamtüberleben bei Patientinnen mit Brustkrebs untersuchen, wurden nicht gefunden. Deshalb kann die Frage, ob eine begleitende Misteltherapie das Gesamtüberleben von Patientinnen mit Brustkrebs verlängert oder verkürzt, nicht beantwortet werden.
Hingegen wurden drei randomisierte Studien139–141, 143 mit insgesamt 719 Patientinnen mit Brustkrebs gefunden, die die Frage untersuchten, ob die zusätzliche Gabe von Mistelextrakten zur Chemotherapie und gegebenenfalls weiteren Therapieformen, die im Rahmen der Standardtherapie erfolgen, die HRQOL der Patientinnen und das Auftreten unerwünschter Nebenwirkungen der Krebstherapie beeinflussen.
Zwei der Studien139, 140 wurden unter einer Studienleitung als Dosisfindungsstudie und als konfirmatorische Studie hinsichtlich der HRQOL durchgeführt und weisen deshalb, abgesehen vom Wechsel des Messinstruments für die primäre Zielgröße, ein nahezu identisches Studiendesign auf. Die dritte Studie, von Tröger et al.141, 143, ist dreiarmig und untersucht zwei verschiedene Mistelpräparate begleitend zur Standardtherapie im Vergleich zu einer Kontrollgruppe, die nur die Standardtherapie erhält. Die Beobachtungsdauer in den Studien betrug zwischen 15 und 18 Wochen.141, 143
Die Veränderung der HRQOL und von unerwünschten Symptomen der Standardtherapie in den drei RCT wurde mit vier verschiedenen validierten Lebensqualitätsmessinstrumenten (EORTC-QLQ-C30, FACT‑G, GLQ‑8, Spitzer-Analogskala) gemessen, drei davon (FACT‑G, GLQ‑8, Spitzer-Analogskala) wurden in den zwei Studien von Semiglazov et al.139, 140 verwendet , das vierte Instrument, der EORTC QLQ-C30 in der Studie von Tröger et al.141, 143. Für zwei der Messinstrumente, die mehrere Subskalen besitzen, wird ein Gesamtpunktwert angegeben (FACT‑G, GLQ‑8), für EORTC-QLQ-C30, FACT‑G, GLQ‑8 werden auch Ergebnisse zu Subskalen berichtet.
Die Veränderung des Gesamtwerts des FACT‑G Fragebogens zur HRQOL (theoretische Spannweite: 0 bis 80 Punkte) nach 15 Wochen unterschied sich in der konfirmatorischen Studie von Semiglazov et al. (2006)140 um 9,51 Punkte (p < 0,0001) zugunsten der Mistelgruppe.140 Nach Adjustierung für den Gruppenunterschied zu Studienbeginn betrug die Differenz noch vier Punkte (p < 0,0001). Der Gesamtwert lag zu Studienbeginn in der Placebogruppe bei circa 50 Punkten. Auch die Subskalen zur körperlichen, emotionalen und funktionalen Lebensqualität zeigten nicht-adjustiert Unterschiede von 4,36 (p < 0,0001), 2,6 (p < 0,0001) und 2,55 (p < 0,0001) Punkten zugunsten der Mistelgruppe. Nach Adjustierung für den Gruppenunterschied zu Studienbeginn verringerten sich diese auf circa 1,5 (p < 0,001), 1 (p < 0,01) und 1,5 (p < 0,001) Punkte. Die durchschnittlichen Werte zu Studienbeginn lagen in der Placebogruppe bei circa 20,1; 16,3 und 13,1 Punkten. Zu einem Schwellenwert für die klinische Relevanz des Unterschieds von Gesamtfragebogen und der Unterskalen wird keine Aussage getroffen.286
Die Veränderung des Gesamtwerts der GLQ-8-Symptomskalen (theoretische Spannweite 0–800 mm) nach 15 Wochen unterschied sich in den beiden RCT von Semiglazov et al. (2004)139, (2006)140 statistisch signifikant zugunsten der Misteltherapiegruppe (bei der mittleren Dosis/30 ng(ML)/ml) um 60,8 (p = 0,07) beziehungsweise 123,7 (p < 0,0001) mm. Die durchschnittlichen Werte zu Studienbeginn lagen bei Semiglazov et al. 2004139 zwischen 128,9 und 171,5 mm in vier Studienarmen und wiesen dabei deutlich niedrigere Werte und damit eine bessere Lebensqualität in der Placebogruppe auf. In einer für die Gruppenunterschiede zu Studienbeginn adjustierten Analyse reduzierte sich der Unterschied auf circa 30 mm (p = 0,0121) Unterschied. Bei Semiglazov et al. (2006) betrug der Gesamt-GLQ-8-Wert zu Studienbeginn 150 mm, Werte der Misteltherapiegruppe wurden nicht berichtet, jedoch eine Inhomogenität zwischen den Gruppen genannt, aufgrund der ebenfalls eine Adjustierung für Kovariablen vorgenommen wurde. Die Adjustierung reduzierte den Unterschied in der Veränderung zwischen den Gruppen auf circa 40 mm (p‑Wert < 0,01). Bei Semiglazov et al. (2004) wurde der unadjustierte Effekt von circa 60 mm von den Autoren als relevant betrachtet ohne eine vorherige Festlegung eines klinisch wichtigen Mindestunterschieds (MCID). In der Dosisfindungsstudie wiesen alle Subskalen in der nicht-adjustierten Analyse einen Unterschied der Veränderung gegenüber dem Studienbeginn zugunsten der Misteltherapiegruppe zwischen 2,5 und 12,5 mm (theoretische Spannweite 0–100 mm) auf, davon drei Subskalen statistisch signifikant. In der konfirmatorischen Studie zeigten angesichts einer größeren Fallzahl sieben der acht Subskalen in der nicht-adjustierten Analyse statistisch signifikante Unterschiede zwischen 5,2 und 24,9 mm (Median 17,6). Für Kovariablen adjustierte Ergebnisse für die einzelnen Subskalen werden nicht berichtet.
Der Spitzer-Analogskala-Fragebogen zu HRQOL (theoretisch mögliche Spannweite 0–100) wies in den beiden Studien von Semiglazov et al. nach 15 Wochen eine Veränderung zugunsten der Mistelgruppe auf. Der Unterschied betrug 16,4 (p = 0,0016)139 beziehungsweise 23 mm (p < 0,0001)140 und für Kovariablen adjustiert 5,8 beziehungsweise circa 5,0 mm. Die Werte zu Studienbeginn variierten in den vier Studienarmen zwischen 35,1 und 46,4 mm in der Dosisfindungsstudie139. In der konfirmatorischen Studie betrug der Wert in der Placebogruppe 29 mm. Auch in dieser Studie gibt es keine Aussage zu einem MCID.
Der EORTC-QLQ-C30-Fragebogen besteht aus 30 Fragen mit fünf Funktionsskalen sowie einer Subskala für die Gesamtgesundheit, in denen ein höherer Punktwert einen besseren Gesundheitszustand repräsentiert, und neun Symptomskalen, bei denen ein höherer Punktwert eine stärkere Symptomausprägung und damit einen schlechteren Gesundheitszustand repräsentiert. Die theoretisch mögliche Spannweite innerhalb jeder Skala reicht von 0 bis 100 Punkten. Nach King et al. (1996)272, Osoba et al. (1998) und Tröger et al. (2009)141 wird ein Unterschied von mindestens fünf Punkten als klinisch relevant betrachtet. In der dreiarmigen Studie von Tröger et al.141,143 betrug der Unterschied in der Veränderung nach 18 Wochen zwischen Kontroll- und Iscador®-Mistelgruppe bei den Funktionsskalen 14,09 Punkte (p < 0,001) für die Rollenfunktion, 7,74 Punkte (p < 0,001) für die soziale Funktion, 6,35 Punkte (p = 0,001) für die emotionale Funktion. Unterhalb des Schwellenwerts von fünf Punkten lagen die Unterschiede von 3,56 Punkte für die körperliche (p = 0,014), 4,1 Punkte (p = 0,0076) für die kognitive Funktion und 2,92 Punkte (p = 0,393) für die Gesamtlebensqualität immer jeweils zugunsten der Iscador®-Mistelgruppe. Für die Gesamtlebensqualität war der Unterschied nicht statistisch signifikant. Bei den Symptomskalen reduzierten sich die Punktwerte gegenüber der Kontrollgruppe. Eine Veränderung von mehr als fünf Punkten Unterschied seit Studienbeginn zeigte sich mit ‑12,47 Punkten (p < 0,001) für Schmerzen, ‑8,25 Punkten (p = 0,001) für Schlaflosigkeit, ‑7,58 Punkten (p = 0,001) für Übelkeit und Erbrechen, ‑6,64 Punkten (p = 0,017) für Appetitlosigkeit, und mit ‑6,11 Punkten (p < 0,001) für Durchfall. Unterschiede unterhalb der Schwelle von fünf Punkten zeigten sich mit ‑4,92 Punkten (p = 0,009) für Müdigkeit, ‑3,70 Punkten (p = 0,015) für Kurzatmigkeit, ‑1,12 Punkten (p = 1,000) für Verstopfung stets zugunsten der Iscador-Mistelgruppe. Der Wert für Verstopfung war nicht statistisch signifikant. Es reduzierten sich auch die Punktwerte für „finanzielle Sorgen“ in der Iscador®- um ‑8,94 Punkte (p < 0,001) stärker als in der Kontrollgruppe.
Vergleichbar sind die Effekte auch für das andere Mistelpräparat Helixor®: Einen klinisch relevanten Unterschied gegenüber der Kontrollgruppe zeigte die Rollenfunktion mit 10,5 Punkten (p < 0,001), die emotionale Funktion mit 6,9 Punkten (p < 0,001) und die soziale Funktion mit 6,2 Punkten (p < 0,05). Etwas unter dem Schwellenwert lag die kognitive Funktion mit 4,8 Punkten (p < 0,01). Gesamtlebensqualität und körperliche Funktion zeigten nur minimale, statistisch nicht-signifikante Unterschiede von 1,3 und 1,0 Punkten. Bei den Symptomskalen reduzierten sich die Punktwerte ebenfalls zugunsten des Helixor®-Mistelgruppe: Klinisch relevant sind die Werte mit ‑10,81 Punkten (p < 0,001) für Schmerzen, ‑8,3 Punkten (p < 0,001) für Appetitlosigkeit, ‑7,05 Punkten (p < 0,001) für Durchfall, ‑6,01 Punkten (p < 0,05) für Schlaflosigkeit und ‑5,77 Punkten (p < 0,001) für Übelkeit und Erbrechen. Ein Unterschied unterhalb des Schwellenwerts zeigte sich mit ‑4,03 Punkten (p < 0,05) für Verstopfung. Minimale, statistisch nicht-signifikante Unterschiede zeigten sich für Müdigkeit, Kurzatmigkeit und finanzielle Probleme.
Die eingeschlossenen Studien zur medizinischen Wirksamkeit der begleitenden Misteltherapie haben, wie oben dargestellt, vor allem auch untersucht, inwiefern die Misteltherapie die unerwünschten Nebenwirkungen der Chemo- oder Strahlentherapie abmildert und dadurch eine Verbesserung der HRQOL bewirkt. Unerwünschte Nebenwirkungen, die durch die Misteltherapie verursacht werden, sind Gegenstand der Frage zur Sicherheit der Misteltherapie. Die Abgrenzung, welcher Therapie die UAW zuzurechnen sind, erfolgt in den Studien durch Expertenurteil der Studienärzte und ‑ärztinnen.
Zur Frage der Sicherheit der begleitenden Misteltherapie wurden insgesamt sieben Studien129,131,139–141,143,145–149 mit 1.951 Patientinnen eingeschlossen, drei davon sind die bereits für die Fragestellung zur Wirksamkeit identifizierten RCT. Darüber hinaus haben wir vier weitere nicht-randomisierte Studien eingeschlossen, eine Interventionsstudie, zwei retrospektive Kohortenstudien und eine prospektive einarmige Studie. Eine schwergradige (Otitis) und zwei sehr schwergradige unerwünschte Nebenwirkungen (nekrotisierende Kolitis), die insgesamt auftraten, wurden nicht der Misteltherapie zugerechnet. Leichtgradige und moderate (Grad 1 und 2) Lokalreaktionen traten in den meisten Studien häufig auf. Tröger et al. 2014 berichten 1,8 % schwere Lokalreaktionen an der Einstichstelle bei 1.527 Injektionen eines der beiden verwendeten Mistelextrakte.
Der Median aus sechs Studien mit acht Interventionsarmen, die den Anteil der Personen mit UAW berichteten, beträgt 25,2 % mit einer Spannweite von 4,6 bis 94 %. Das ist zum Teil durch verschiedene Definitionen bedingt. So definieren Tröger et al. erst Lokalreaktionen über 5 cm Durchmesser als unerwünschtes Ereignis, während andere auch Lokalreaktionen unter 5 cm Durchmesser berichten. Systemische Reaktionen sind in den meisten Studien seltener. In vier Studien traten leichte oder moderate systemische Reaktionen von 1,95 % im Median mit einer Spannweite von 0 bis 8,2 % auf. In einer Studie147 wurden jedoch häufig systemische Reaktionen wie Abgeschlagenheit (32,8 %), Kopfschmerzen (24,1 %) und Unwohlsein (18,9 %) genannt. Eine andere Studie141, 143, die den Anteil UAW pro Injektionen maß, berichtete je nach Art des Mistelextrakts 0,49 beziehungsweise 0,9 % leichte und moderate Lokalreaktionen sowie 0 beziehungsweise 3,4 % leichte oder moderate systemische Reaktionen. Der Anteil der Studienabbrecher aufgrund der UAW der Misteltherapie lag in sieben Studien im Median bei 1,3 % mit einer Spannweite von 0 bis 6,3 %. In den fünf Studien, die quantitative Angaben zur Behandlung der UAW machten, erfolgte eine Spontanheilung im Median bei 76,3 % mit einer Spannweite von 12 bis 100 %. Die Spontanheilung unterstützend wurden teilweise bei Lokalreaktionen Salben verabreicht. Weitere Maßnahmen waren Dosisanpassungen und kurzfristige Unterbrechung der Injektionen. Bei einer Studie131, 148, in der bei 88 % der Patientinnen Dosisanpassungen oder Unterbrechungen vorgenommen werden mussten, beurteilten die behandelnden Ärztinnen und Ärzte die vom Hersteller empfohlene Dosis als zu hoch.
Andere SR haben in der Regel den Effekt der begleitenden Misteltherapie nicht nur bei Patientinnen mit Brustkrebs, sondern auch bei mehreren anderen Krebskrankheiten untersucht (Horneber (2008)82, Melzer (2009)287, Ostermann (2009)135, Kienle (2010)138, Büssing (2012)288, Freuding (2019)289, 290, Ostermann (2020)291. Nur bei Horneber et al.82 und Freuding et al.289, 290 waren die Ergebnisse zu Brustkrebs auf ausschließlicher Evidenzbasis von RCT separat entnehmbar.
Die Anzahl der eingeschlossenen Studien mit Patientinnen mit Brustkrebs unterscheiden sich, sowohl zwischen diesen SR als auch gegenüber dem vorliegenden HTA-Bericht. Horneber et al. haben im Unterschied zu Freuding et al. (2019) und dem vorliegenden HTA-Bericht zusätzlich drei ältere, sehr kleine Studien mit sehr schlechter Berichtsqualität (Heiny (1991)292, Borelli (2001)293, Auerbach (2005)125) eingeschlossen sowie eine Studie von Grossarth-Maticek et al. (2001)294, 295. Dabei handelt es sich um eine retrospektive Kohortenstudie mit gematchten Paaren, in die dann eine randomisierte Studie eingebettet wurde. Eine Person des Paars wurde gefragt, ob sie ihren Therapeuten um eine begleitende Misteltherapie bitten wolle. Diese Person wurde zufällig ausgewählt. Bei Freuding et al. sind wiederum zusätzliche Studien eingeschlossen, die erst nach dem Recherchezeitraum des Reviews von Horneber et al. publiziert worden waren: zwei Publikationen von Grossarth-Maticek (2006)296, 297, die auf der gleichen Studie wie Grossarth-Maticek (2001) basieren, sowie die vier Publikationen von Tröger et al.141–144 zu einer dreiarmigen randomisierten Studie. Im vorliegenden HTA wurde die Studie von Grossarth-Maticek sowohl für die Zielgröße Überlebenszeit als auch HRQOL ausgeschlossen, weil dort die Berechnung der Überlebenszeit mit dem Diagnosezeitpunkt und nicht dem Randomisierungszeitpunkt beginnt, wie das bei RCT üblich ist. Dies geschieht, um Verzerrungen durch Verlust von Personen oder eine unterschiedlich lange Zeit zwischen Diagnose und Behandlungsbeginn, ab dem erst ein kausaler Effekt der Behandlung angenommen werden kann, zu verhindern. Speziell im Fall der Studie von Grossarth-Maticek et al. waren genaue Diagnose- und Behandlungstermine nicht bekannt. Auch das Matching-Verfahren der Paare bietet Raum für systematische Verzerrungen. Eine ausführlichere Analyse dazu findet sich bei Edler (2004)298. Zum Einschluss in die Evidenzsynthese zur HRQOL erschien uns die Studie auch aufgrund des verwendeten Messinstruments der Selbstregulation nicht geeignet. Der Fragebogen enthält keine körperliche Dimension der Lebensqualität, die geeignet wäre, die Reduktion von Symptomen durch die Chemotherapie abzubilden.
Trotz des unterschiedlichen Studienpools kommen beide Übersichtsarbeiten zu einem ähnlichen Ergebnis wie der vorliegende Bericht: Es gibt zwar eine höhere HRQOL in den Misteltherapiegruppen in den eingeschlossenen Studien. Ob dies jedoch ein kausaler Effekt der Misteltherapie oder Resultat von systematischen Verzerrungen ist, bleibt unsicher. Horneber et al. kommen zu dem Schluss, dass für keine der betrachteten Krebserkrankungen ein konsistenter Effekt der begleitenden Misteltherapie auf das Gesamtüberleben oder progressionsfreie Überleben nachgewiesen werden konnte. Freuding et al. schließen, dass die Mehrheit der Studien keinen Effekt der Misteltherapie auf das Überleben zeigt. Dies gilt auch, wenn man nur die Studien zu Brustkrebs betrachtet.
Hinsichtlich der Sicherheit der Misteltherapie ziehen Horneber et al. das Fazit, dass es Evidenz mittlerer Qualität gibt, dass die Misteltherapie in der Regel gut toleriert wird und nur wenige UAW wie Lokalreaktionen an der Einstichstelle mit Rötung und Quaddeln oder systemische Reaktionen wie leichtes Fieber und grippe-ähnliche Symptome auftreten. Freuding et al.289 stellen ebenfalls fest, dass in den Studien nur wenige und geringfügige Nebenwirkungen der Misteltherapie berichtet werden. Sie verweisen jedoch auf das Problem, dass bisher nur Nebenwirkungen, die bekanntermaßen auf die Misteltherapie zurückzuführen sind, in Studien erfasst werden. Wechselwirkungen der Misteltherapie mit der Standardtherapie, die auf Immunstimulation beruhen könnten, wie z. B. die Verstärkung allergischer und immunologischer Reaktionen durch Krebsmedikamente, würden vermutlich jedoch nicht ausreichend erfasst. Da vielen Ärzten die Verwendung komplementärer Behandlungsmethoden durch ihre Patienten gar nicht bekannt sei oder nicht als riskant eingeschätzt würde, sei hier mit einer Untererfassung solcher Nebenwirkungen zu rechnen. Es gäbe Hinweise aus in vitro-Studien, dass Mistellektine das Tumorwachstum bei Lymphomen, Nierenzellkarzinomen und Melanomen anregen könnten. Dementsprechend rieten einige Expertinnen und Experten von der Verwendung der Misteltherapie bei „immunologischen“ Krebsarten ab. Zu Brustkrebs gibt es keine Aussagen hierzu.
Von Horneber et al.82 werden neue Studien mit besserer Qualität gefordert. Insbesondere wird auf einige Herausforderungen durch die Heterogenität der Intervention Misteltherapie verwiesen: die schlechte Vergleichbarkeit verschiedener Mistelextrakte, die durch Messung des Lektingehalts verbessert werden könnte, des Weiteren die Notwendigkeit der Berücksichtigung des verschiedenen Umfelds wie anthroposophischer Medizin oder Phytotherapie, innerhalb derer die Misteltherapie angewendet wird. Auch das Problem der Kontamination der Kontrollgruppe durch gleichzeitige Verwendung von Mistelextrakten wird angesprochen und der Einsatz von Lektinantikörpern zur Identifizierung einer solchen Kontamination wird angeregt. Horneber et al.82 empfehlen, in Ermangelung ausreichender Evidenz für einen positiven Effekt der Misteltherapie auf Symptomkontrolle der Nebenwirkungen der Chemotherapie, Lebensqualitätsverbesserung und Überleben, die Entscheidung, ob im Einzelfall die Misteltherapie eine positive Wirkung haben könnte, dem Expertenurteil, das heißt dem ärztlichen Urteil, zu überlassen. Freuding et al.289, 290 hingegen kommen zum Schluss, dass die systematische Bewertung der Literatur keinen Hinweis dafür liefere, Patienten mit Krebs eine Misteltherapie zu verschreiben.
Zur Übersichtsarbeit von Freuding et al. erschien 2020 eine Veröffentlichung von Matthes et al. (2020)299, die die methodische Qualität dieser Arbeit teilweise in Zweifel zieht. Zum einen wird kritisiert, dass die Literaturrecherche vor allem, was unerwünschte Nebenwirkungen beträfe, nicht umfassend genug sei, zum anderen wird zum Teil eine fehlerhafte Bewertung des RoB bei einer Reihe von Studien bemängelt. Von dieser Kritik ist auch die dreiarmige Studie zu Brustkrebs mit zwei verschiedenen Analysezeitpunkten (18 Wochen, fünf Jahre) zu zwei verschiedenen Endpunkten (HRQOL und krankheitsfreies Überleben) betroffen.141–144 Matthes et al. halten eine Bewertung als „Hohes Biasrisiko“ für unvollständige Analyse der Zielgrößen entsprechend der Cochrane-Kriterien für unangebracht. Wir haben in diesem Fall das Verzerrungspotenzial ebenfalls als je nach Studienarm und Nachverfolgungszeitpunkt als unklar beziehungsweise überwiegend als niedrig eingeschätzt. Da das Hauptproblem dieser und auch der anderen Studien die fehlende Verblindung beziehungsweise das Aufrechterhalten der Verblindung ist, ändert sich insgesamt unserer Meinung nach nichts an der Gesamteinschätzung der Ergebnisse zu den Studien bei Patientinnen mit Brustkrebs. Als methodischen Mangel bei der Bewertung des Verzerrungspotenzials mit Cochranes RoB-Checkliste sehen wir bei den bisher erschienenen Übersichtsarbeiten vor allem, dass auf eine endpunktspezifische Betrachtung verzichtet wurde. Subjektiv erhobene Zielgrößen wie die HRQOL unterliegen in der Regel einem höheren Verzerrungsrisiko als objektiv erhobene Zielgrößen wie das Überleben. Im vorliegenden Fall führt die Bewertung der Studien zur begleitenden Misteltherapie jedoch zu keiner anderen Gesamteinschätzung der Evidenz.
Die identifizierten Leitlinien medizinischer Fachgesellschaften geben zum Teil sicher auch wegen der unterschiedlichen Veröffentlichungszeitpunkte und damit anderen Evidenzlage etwas unterschiedliche Empfehlungen ab: In der „Interdisziplinäre^] S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms“ der AWMF9 aus Deutschland von 2017 lautet das auf Expertenkonsens gestützte Statement: „Eine Misteltherapie verlängert das Überleben von Patientinnen mit Mammakarzinom nicht, eine Verbesserung der Lebensqualität ist nach derzeitiger Datenlage fraglich.“9 Zwar gäbe es Hinweise auf eine Steigerung der Lebensqualität durch die Misteltherapie, aber die Qualität der zugrundeliegenden Studien sei zu gering. Diese Formulierung wurde auch in der aktualisierten Form von Februar 202036 beibehalten. Generell für komplementärmedizinische Verfahren wird auch hier wie in der Version von 2017 die auf Expertenkonsens (starker Konsens) basierende Empfehlung gegeben: „Alle Patientinnen sollten befragt werden, ob sie komplementäre und/oder alternative Therapien in Anspruch nehmen. Patientinnen, die solche Verfahren einsetzen, sollen auf mögliche Risiken und ggf. auf Interaktionen mit Standardtherapien hingewiesen werden.“
Bei der AWMF wird eine Leitlinie zur „Komplementärmedizin in der Behandlung von onkologischen Patientinnen” erstellt, die Anfang 2021 erscheinen soll.50 Derzeit (seit November 2020) ist eine Konsultationsfassung veröffentlicht, die nicht mehr in die Evidenzsynthese dieses Berichts einbezogen werden konnte. Diese Leitlinie wurde anhand der gleichen Methoden erarbeitet wie die AWMF-Leitlinie zum Mammakarzinom von 2017120, 300 und konnte aktuellere Übersichtsarbeiten und Studien einbeziehen. Während sich die Leitlinie zum Mammakarzinom noch auf ein Konsensusstatement stützte, sind die beiden neuen Empfehlungen in der Konsultationsfassung nun als auf hohem Niveau (Klasse 1a SR von RCT) als evidenzbasiert klassifiziert. Der Einfluss der begleitenden Misteltherapie auf das Gesamtüberleben wird nun als unklar eingeschätzt: „Die Daten reichen für eine klare abschließende Bewertung nicht aus. Es kann keine Empfehlung für oder gegen eine Verordnung von Mistelgesamtextrakt (Viscum album L.) enthaltenden Präparaten mit dem Ziel der Verlängerung der Überlebenszeit gegeben werden.“50 (S. 441) Zum Einsatz der begleitenden Misteltherapie zur Verbesserung der HRQOL bei soliden Tumoren wird eine offene Empfehlung (das heißt Empfehlungsgrad 0) abgegeben: „Die subkutane Gabe von Mistelgesamtextrakt (Viscum album L.) kann für den therapeutischen Einsatz zur Verbesserung der Lebensqualität bei Patienten mit soliden Tumoren erwogen werden/’ Der Evidenzgrad dieser Empfehlung wird ebenfalls mit 1a angegeben. Begründet wird dies mit der heterogenen Datenlage aus den SR. Zu bedenken ist bei dem Vergleich beider Leitlinien, dass sich die eine nur auf Brustkrebs bezieht, die andere auf eine Vielzahl von Tumorentitäten.
Die Leitlinie der Society for Integrative Oncology (Greenlee et al. 2017) “Clinical Practice Guidelines on the Evidence-Based Use of Integrative Therapies Düring and After Breast Cancer Treatment”268 aus den USA von 2017 empfiehlt, die Misteltherapie nur ausgewählten Patienten basierend auf ärztlichem Urteil und Patientenpräferenzen anzubieten und sie in Erwägung zu ziehen, um die Lebensqualität auf kurze Sicht zu erhöhen. Aufgrund der nicht-ausreichenden Evidenz zu Interaktionen der Misteltherapie mit der Standardtherapie und zu Langzeiteffekten oder Toxizität war der Empfehlungsgrad gegenüber der Vorgängerversion von 2014301 von Grad B (empfiehlt die Maßnahme anzubieten) auf Grad C (nur für ausgewählte Patienten) herabgestuft worden.
Dieser HTA-Bericht unterliegt verschiedenen Limitationen im Hinblick auf die Bewertung der medizinischen Wirksamkeit und Sicherheit. Im vorliegenden Bericht konnten zwei in früheren Übersichtsarbeiten bereits identifizierte RCT292, 293, 296 nicht dargestellt werden, weil die Volltexte nicht verfügbar waren. Soweit den SR82, 289, 290, in die diese Studien aufgenommen wurden292, 293, 296, 297, zu entnehmen ist, handelt es sich bei diesen Studien um Studien mit kleinen Fallzahlen zwischen 17 und 46 Patientinnen, schlechter Berichtsqualität und hohem Verzerrungsrisiko82,289. Dementsprechend würde sich durch Ein- oder Ausschluss dieser Studien das Ergebnis der Bewertung nicht ändern.
Der letzte Stand der systematischen Literaturrecherche unseres Berichts in mehreren Datenbanken ist April 2017 und liegt damit schon drei Jahre zurück. Automatisch aktualisierte PubMed-Benachrichtigungen wurden bis Oktober 2020 nachverfolgt. Hierdurch wurden neuere Literaturreviews zum Thema identifiziert, deren eingeschlossene Studien dann ebenfalls durchgesehen wurden. Ein neueres SR289, 290 mit aktueller Literaturrecherche konnte jedoch auch keine weiteren publizierten RCT zur begleitenden Misteltherapie identifizieren.
Da eine systematische Analyse von Beobachtungsstudien zur Untersuchung von UAW in den Übersichtsarbeiten nicht erfolgte, lässt sich hier nicht abschätzen, ob eventuell relevante Literatur zu UAW nicht erfasst wurde.
Aufgrund der geringen Anzahl und der Heterogenität der Studien erschien es uns nicht sinnvoll, eine Metaanalyse für Zielgrößen zur Wirksamkeit oder Sicherheit durchzuführen. Beispielsweise wurden in den identifizierten Studien unterschiedliche Messinstrumente für die HRQOL verwendet. Die verwendeten Definitionen der UAW und die zu ihrer Erhebung verwendeten Studientypen waren ebenfalls unterschiedlich. Wie im folgenden Abschnitt gezeigt wird, war die statistische Unsicherheit, die durch eine Metaanalyse verringert werden kann, nicht die wesentliche Limitation, sondern das hohe Potenzial für systematische Verzerrung der Effektgrößen und zu deren Abschätzung kann eine Metaanalyse mit drei Studien nichts beitragen.
Die drei eingeschlossenen randomisierten Studien, die den Einfluss der begleitenden Misteltherapie auf die Lebensqualität von Patientinnen mit Brustkrebs untersuchen, verwendeten adäquate Methoden zur Randomisierung, eine verdeckte Zuweisung der Intervention zu den Studienarmen ist nur in einer Studie141, 281 beschrieben und bleibt für die anderen beiden Studien139, 140 unklar. Das Risiko für eine Verzerrung durch Verlust von Patientinnen bei der Auswertung ist für einen der Studienarme bei Tröger et al.143 unklar und ansonsten gering. Ob selektiv berichtet wurde, ist unklar, da keine Studienprotokolle publiziert sind, anhand derer dies überprüft werden könnte. Ein hohes Risiko für eine Verzerrung besteht jedoch dadurch, dass die Studien entweder nicht verblindet sind141, 281 oder durch die Lokalreaktionen an der Einstichstelle sowie Fieber und Grippe-ähnliche Symptome leicht entblindet werden können.143 In den eingeschlossenen sieben Studien zur Sicherheit traten im Median in circa 25 % (Spannweite: 4,6 bis 94 %) Lokalreaktionen auf. Die primäre Zielgröße zur Wirksamkeit in den drei randomisierten Studien139, 141, 281 ist die HRQOL.
HRQOL ist ein subjektiv berichteter Endpunkt, der durch die Kenntnis der erhaltenen Therapie maßgeblich beeinflusst werden kann. Eine Überschätzung positiver Effekte im Zusammenhang mit
einer fehlenden Verblindung insbesondere bei subjektiven Endpunkten wurde in metaepidemiologischen Studien berichtet. Eine Untersuchung, in der 1.057 randomisierte Studien aus 104 Metaanalysen analysiert worden waren, berichtete eine durchschnittliche 22-prozentige Effektüberschätzung (Relative OR: 0,78; 95 %-Bayes’KI: 0,65 bis 0,92). Auch in der neuesten Studie zum Einfluss von Verblindung im Studiendesign, ergibt sich insbesondere bei subjektiven Endpunkten eine Effektüberschätzung, wenn die Verblindung fehlt.302, 303 Durch die fehlende beziehungsweise wegen der Lokalreaktionen an der Einstichstelle schwierig aufrechtzuerhaltende Verblindung können Patientinnen beeinflusst sein. Aber auch das behandelnde Fachpersonal könnte die Therapiegruppen unterschiedlich behandeln. Auch liegen keine so großen Effekte vor, um ausschließen zu können, dass sie auf systematischer Verzerrung durch fehlende Verblindung zurückzuführen sind. Ein Hinweis darauf, dass die Größenordnung der Veränderung durch die Misteltherapie zumindest beim EORTC auch zufällig erreicht werden kann, ist die statistisch signifikante Verbesserung in der Iscador®-Mistelgruppe um fast neun Punkte in der Subskala „finanzielle Sorgen“. Ein kausaler Zusammenhang ist hier kaum plausibel und für das andere Mistelpräparat in der Studie Helixor® gab es auch keinerlei statistische Assoziation zu dieser Subskala.
Ein weiterer Schwachpunkt ist, dass nur für eines der verwendeten Messinstrumente in einer Stu-die141, 281 ein klinisch relevanter Mindestunterschied genannt wird. So lässt sich die klinische Relevanz der relativ geringen bis moderaten Unterschiede nicht einordnen.
Ob die Studienergebnisse auf die gegenwärtigen Verhältnisse im deutschsprachigen Raum vollständig übertragbar sind, erscheint unklar. Die Studien von Semiglazov et al. wurden vor 2004 und die Studie von Tröger zwischen 2005 und 2007 durchgeführt. Alle Studien fanden im ost- beziehungsweise südosteuropäischen Raum statt. Sowohl die mittlerweile fortentwickelte Brustkrebstherapie als auch Unterschiede in der Gesundheitsversorgung sowie kulturelle Unterschiede des deutschsprachigen Raums im Vergleich zu diesen Ländern könnten einen Einfluss auf die Übertragbarkeit der Studienergebnisse haben.
Insgesamt besteht große Unsicherheit, ob die vorgestellten kleinen bis moderaten Verbesserungen der HRQOL beziehungsweise die Verminderung der durch die Chemotherapie und Krankheit verursachten Symptome tatsächlich ursächlich der Misteltherapie zugeschrieben werden können, und ob, die Ergebnisse der Studien auf die gegenwärtigen Verhältnisse im deutschsprachigen Raum übertragbar sind. Neue Studien könnten also wahrscheinlich zu einer Veränderung der Gesamteinschätzung der Evidenz führen.
Eine der eingeschlossenen Studien142, 144 analysierte auch das krankheitsfreie Überleben ohne Rezidive oder Metastasen nach fünf Jahren und fand keine statistisch signifikanten Unterschiede. Die Studie war mit circa 30 Patientinnen pro Studienarm klein.
Ungeklärt bleibt außerdem, ob eine begleitende Misteltherapie Auswirkungen auf das Gesamtüberleben hat, weil hierzu keine aussagekräftigen randomisierten Studien gefunden wurden.
Da insbesondere schwergradige UAW in der Regel selten sind, haben wir die Datenbasis für mögliche UAW durch die Misteltherapie neben den eingeschlossenen RCT auf Beobachtungsstudien zur begleitenden Misteltherapie, die Nebenwirkungen berichten, erweitert. Insgesamt waren damit 1.951 Patientinnen eingeschlossen. Sehr seltene Nebenwirkungen könnten bei dieser Stichprobengröße auch nicht nachgewiesen werden. Innerhalb der eingeschlossenen Studien traten jedoch keine schwergradige UAW, die der Misteltherapie zugeordnet wurden, auf. Noch unbekannte UAW, falls es sich um seltene beziehungsweise nicht um große Effekte handelt, lassen sich in der Regel nur durch Pharmakovigilanz-Studien mit langem Beobachtungszeitraum und großen Fallzahlen entdecken und durch größere randomisierte Studien ursächlich einer Therapie zuordnen. Abgesehen von der insgesamt geringen Fallzahl haben die hier eingeschlossenen randomisierten Studien das methodische Problem, dass zwischen den UAW der Brustkrebstherapie – also Chemotherapie oder weiteren Behandlungen – und den UAW der begleitenden Misteltherapie unterschieden werden muss. In der größten randomisierten Studie, von Semiglazov et al. (2006)140, wurden per Definition nur Reaktionen an der Einstichstelle und die Veränderung sicherheitsrelevanter Laborparameter als mögliche UAW der Misteltherapie definiert. Das schränkt die Erfassung unbekannter UAW weiter ein. Wie die zum Teil als möglich angenommenen Wechselwirkungen einer Misteltherapie mit Krebsmedikamenten289 erfasst werden könnten, erscheint unklar.
Es fehlen aussagekräftige randomisierte Studien zum Gesamtüberleben, zum progressionsfreien Überleben und zur HRQOL nach begleitender Misteltherapie bei Patientinnen mit Brustkrebs.
Ein zentrales methodisches Problem insbesondere bei der Untersuchung der HRQOL ist es, trotz der Lokalreaktionen eine doppelte Verblindung aufrechtzuerhalten und damit eine Verzerrung der Ergebnisse auszuschließen. Bei anderen Therapien gibt es vergleichbare methodische Probleme. So treten bei verschiedenen Immuntherapien bei allergischen Erkrankungen häufig allergische Lokalreaktionen auf, anhand derer der Therapiearm erkannt werden kann. Hier empfiehlt die European Medicines Agency (EMA) in ihrer „Guideline on the clinical development of products for specific immunotherapy for the treatment of allergic diseases”304 dem Placebo Histamin beizumischen, damit die Verblindung aufrechterhalten werden kann. Ob dies auch eine geeignete Option für eine Placebopräparation für den Vergleich zur Misteltherapie bei Patientinnen mit Brustkrebs sein könnte, kann hier nicht beurteilt werden. Bevor neue Studien durchgeführt werden, sollte jedoch eine Literaturübersicht angefertigt werden, die gezielt nach Möglichkeiten, einer Entblindung vorzubeugen suchen. Ein solches Literaturreview sollte zum einen die Kritik an den Schwächen bisheriger randomisierter Studien zur begleitenden Misteltherapie, aber auch weitere Qualitätskriterien für gutes Studiendesign bei „patient-reported outcomes“ (PRO) Zusammentragen. Hier wären beispielsweise auch die Empfehlungen der EMA zu Studiendesigns für PRO bei Krebserkrankungen305 sowie die Empfehlungen von CONSORT PRO für das Berichten von randomisierten Studien zu PRO306 einzuschließen. Hier sind unter anderem die Verwendung validierter Messinstrumente und die Angabe von minimalen relevanten klinischen Unterschieden genannt.
Eine solche Übersichtsarbeit speziell zu den methodischen Herausforderungen von randomisierten Studien zur Misteltherapie und entsprechenden Lösungsansätzen, könnte dann verwendet werden, um das Studiendesign zu entwickeln.
Auch für Studien zum Gesamtüberleben oder progressionsfreien Überleben in der Onkologie gibt es erhebliche methodische Herausforderungen. So ist es häufig erforderlich weitere therapeutische Maßnahmen nach Anwendung der begleitenden Misteltherapie beziehungsweise der Behandlung in der Kontrollgruppe durchzuführen, die ebenfalls einen Einfluss auf diese Zielgrößen haben. Dies stellt im Rahmen einer Intention-to-treat-Analyse kein Problem dar. Will man allerdings die Effekte der einzelnen Maßnahmen getrennt ermitteln, sind Methoden der Kausalinferenz anzuwenden. Dieser Aspekt muss bei der Konzeption der klinischen Studie und der Erfassung der Variablen im Follow-up berücksichtigt werden.
Im vorliegenden HTA-Bericht sollte auch untersucht werden wie hoch die Kosten der Standardtherapie mit begleitender Misteltherapie im Vergleich zur Standardtherapie allein bei Patientinnen mit Brustkrebs im deutschsprachigen Raum sind.
Es wurde eine vergleichende Kostenanalyse zu dieser Fragestellung identifiziert152, die auf Daten von vor 15 bis 20 Jahren gestützt ist. In dieser Studie wurden die Kosten der Therapien zwischen Diagnose und bis zum Abschluss der Operation und Standardtherapie nicht betrachtet. Schöffski et al. (2009)152 haben aus volkswirtschaftlicher Perspektive eine vergleichende Kostenanalyse über einen Fünf-JahresHorizont durchgeführt. Die zugrundeliegende multizentrische, retrospektive Kohortenstudie128 untersuchte die Wirksamkeit und Sicherheit der komplementären Misteltherapie bei Patientinnen mit Brustkrebs während der routinemäßigen Nachsorge in 53 zufällig ausgewählten Krankenhäusern und Arztpraxen in Deutschland. Direkte medizinische Kosten im stationären und ambulanten Bereich sowie indirekte Kosten für einen Produktivitätsausfall von bis zu maximal 90 Tagen wurden nach der Operation und dem Abschluss der adjuvanten Chemo- oder Radiotherapie erhoben. Die durchschnittlichen Gesamtkosten innerhalb von fünf Jahren für eine Patientin mit begleitender Misteltherapie lagen bei 4.504 Euro, verglichen mit 9.996 Euro für eine Patientin mit Standardtherapie. Der Unterschied war hauptsächlich auf die stationären Kosten und die Kosten für den Produktivitätsverlust zurückzuführen. Angaben zur statistischen Unsicherheit wurden nicht berichtet. Die Autoren der Studie selbst bezweifeln, dass der große Unterschied auf einen kausalen Effekt der Misteltherapie zurückzuführen sei, da die Daten auf einer Beobachtungsstudie ohne jegliche Kontrolle für systematische Effektverzerrung durch Störgrößen (Confounder) basieren. Als mögliche Störgrößen wurden beispielsweise ein unterschiedlicher Schweregrad der Krankheit zu Studienbeginn und soziodemografische Faktoren genannt, die sowohl Komorbidität als auch Coping-Strategien beeinflussen könnten. Wie Studien zur Frage der Inanspruchnahme der begleitenden Misteltherapie zeigen62,65,230–235,237,238,240–242, wird die Misteltherapie häufiger von Menschen mit höherem Bildungsabschluss in Anspruch genommen. Dass ein höherer Bildungsabschluss in der Regel mit einer besseren Gesundheitsprognose einhergeht, ist durch sozialmedizinische Untersuchungen auch für Brustkrebs gut belegt. Zum Beispiel zeigt eine Studie aus Schweden, in der Geburtskohorten von circa 1,5 Millionen Frauen nach Bildungsniveau stratifiziert wurden, dass das Überleben bei Brustkrebs mit dem Bildungsniveau deutlich steigt. So war die Sterberate der Frauen mit Universitätsabschluss um 32 % geringer als die der Frauen mit einer Schulbildung unter neun Jahren (Hazard Ratio 0,68, 95%-KI: 0,62 bis 0,76). Deshalb könnten besser gebildete Frauen mit Brustkrebs völlig unabhängig von der Misteltherapie günstigere Behandlungsergebnisse haben. Daten zum Bildungsstand sowie auch anderer prognostischer Faktoren wurden in der Studie aber nicht erhoben. Es bleibt also unklar, ob eine begleitende Misteltherapie die Krankheitskosten in der Nachsorge von Brustkrebs verringern kann.
Zur Frage der Kosteneffektivität einer begleitenden Misteltherapie im Vergleich zur Standardtherapie bei Patientinnen mit Brustkrebs wurden keine Studien identifiziert, deshalb kann hierzu keine Aussage getroffen werden.
Grundsätzlich ist es möglich, dass unserer Suche Studien entgangen sind, obwohl unsere Suche eine sensitive Strategie ohne Einschränkung auf Studientypen verfolgte. Solange die Frage der medizinischen Wirksamkeit einer begleitenden Misteltherapie unsicher ist, lässt sich jedoch auch die Frage der Kosteneffektivität nicht beantworten.
Gegenstand der Domäne Patienten- und soziale Aspekte ist die Beantwortung der Forschungsfragen zu verschiedenen Zielgrößen, die für Patientinnen mit Brustkrebs oder Angehörige des Fachpersonals, die diese Patientinnen behandeln, relevant sind.
Es wurden 15 Publikationen62, 65, 230–242 mit 4.088 Teilnehmerinnen und Teilnehmern in die Analyse und Synthese eingeschlossen. Neun der Studien sind quantitative Studien aus Patientinnen-perspektive62, 231, 232, 234, 237, 239–242 mit 3.391 Patientinnen mit Brustkrebs, drei Studien sind qualitative Studien aus Patientinnenperspektive230, 233, 236 mit 43 Patientinnen mit Brustkrebs und drei Studien sind quantitative Studien aus der Perspektive des behandelnden Fachpersonals65, 235, 238 mit insgesamt 654 Teilnehmenden. Angehörige wurden in keiner der Studien befragt. Alle quantitativen Studien sind Querschnittstudien.
Wie häufig nehmen Patientinnen und das behandelnde Fachpersonal die begleitende Misteltherapie in Anspruch, welche Einstellung haben sie zur begleitenden Misteltherapie und welchen Gewinn erwarten sie sich von ihr?
In diesem SR nehmen etwa 25 % der Patientinnen mit Brustkrebs die Misteltherapie in Anspruch. Insbesondere jüngere, gebildete Patientinnen mit einem schweren Verlauf der Brustkrebserkrankung erhoffen sich von der begleitenden Misteltherapie, dass sich die Verträglichkeit und Wirksamkeit der Chemotherapie verbessert und sie ihren Körper im Kampf gegen den Krebs unterstützen können. Aus Sicht der Anbietenden sind Gründe für und gegen eine Misteltherapie meistens nicht direkt mit der medizinischen Wirksamkeit verbunden, sondern darin begründet, die Wünsche der Patientin zu berücksichtigen.
Im Median wenden 24,9 % (Spannweite: 7,3 bis 46,3 %) der Patientinnen mit Brustkrebs eine Misteltherapie an. Die Häufigkeit der Inanspruchnahme der begleitenden Misteltherapie wurde von den 3.421 Patientinnen mit Brustkrebs selbst angegeben62, 231, 232, 234, 237, 240–242. Zum Vergleich, die Inanspruchnahme von KIM-Verfahren im Allgemeinen liegt in denselben Studien im Median bei 53,25 % (Spannweite: 26,7 bis 78 %). Da sich die Definitionen von KIM-Verfahren erheblich voneinander unterscheiden, sind die Zahlen zur Inanspruchnahme von KIM-Verfahren nur bedingt vergleichbar. Von den 654 Personen aus den drei Studien65, 235, 238 aus der Perspektive des behandelnden Fachpersonals geben im Median 23,9 % (Spannweite: 28,8 bis 79,2 %) der Befragten an, dass sie bei onkologischen Patientinnen und Patienten grundsätzlich die Misteltherapie verordnen.
Neben der Häufigkeit wurden in den Studien auch uni- und multivariate statistische Analysen zu Merkmalen durchgeführt, die mit der Anwendung von KIM-Verfahren beziehungsweise der Misteltherapie statistisch signifikant assoziiert sind. Die multivariaten Regressionsanalysen für Merkmale von Patientinnen ergeben jeweils in mindestens zwei der vier Studien einen statistisch signifikanten Einfluss der drei Prädiktoren: (jüngeres) Alter62, 231, 242, ein höherer Bildungsstand232, 242 und ein schwererer Krankheitsverlauf62, 231, 232. Diese drei Variablen korrelieren auch in den univariaten Analysen mit der Inanspruchnahme der integrativen Misteltherapie.240, 241
Die univariaten Analysen (Chi2-Tests) der Studien aus der Perspektive des behandelnden Fachpersonals zeigen eine statistisch signifikante Assoziation zwischen dem Alter der behandelnden Person (über 50) und dem des Anbietens von KIM-Verfahren.65, 238 Zusätzlich waren die Anbietenden bei Kalder et al. eher männlich (p = 0,027) und arbeiteten eher im niedergelassenen Bereich (p‑Wert nicht beschrieben). Sofern die Ärztinnen und Ärzte im Krankenhaus tätig waren, ist ein höherer hierarchischer Status assoziiert mit einer höheren Anwendung von KIM-Verfahren (p = 0,013).65 Münstedt et al.238 fanden eine Assoziation der Häufigkeit der Verordnung von Mistelpräparaten mit der Fachrichtung Allgemeinmedizin (p = 0,035).
Acht Studien beschreiben die Einstellung der Befragten zur begleitenden Misteltherapie und welchen Gewinn sie sich von der Anwendung erwarten: zwei quantitative Studien234, 237 mit 197 Patientinnen, drei quantitative Studien65, 235, 238 mit 654 behandelnden Personen und drei qualitative Studien230, 233, 236 mit 43 Patientinnen mit Brustkrebs. Für 90 % der KAM-Anwenderinnen in der Studie von Hübner et al.234 war das Vertrauen zur beratenden Person und die wahrgenommene Kompetenz bezüglich KIM wichtig, weil sie dadurch das Gefühl hatten, dass das KIM-Verfahren gut für sie sei.234 In der Studie von Moschen et al.237 wollen Patientinnen nichts unversucht lassen (47 %), wünschen sich eine aktivere Rolle in der Behandlung (47 %) oder wollen die Standardtherapie entweder ergänzen (31 %) oder sanfter ohne Nebenwirkungen gestalten (18 %). Bei 3,6 % ist die konventionelle Therapie wirkungslos und die Misteltherapie stellt die letzte Option dar.237
Die Gründe für oder gegen die Misteltherapie beziehen sich auch aus Sicht der behandelnden Fachpersonen nicht direkt auf die Wirksamkeit der Misteltherapie beziehungsweise der komplementären Verfahren, sondern auf sonstige Aspekte. Gründe für die Anwendung der Misteltherapie sind in den zwei Studien von Kalder et al.(2001)65 und Münstedt et al. (2000)238, mit 550 Ärztinnen und Ärzten, der Wunsch der Patientin, die Erweiterung des eigenen Angebotsspektrums, die eigene Überzeugung oder der Glaube an die Unwirksamkeit der konventionellen Therapie. Die drei häufigsten Gründe gegen die Anwendung waren bei Kalder et al.65, dass Zeit verloren geht (32,9 %), unkonventionelle Methoden zu teuer sind (30,4 %) und die Anwendung konventioneller Methoden verhindert wird (27,3 %). Bezogen auf das Krankenhaus-Setting berichten Klein et al.235, dass komplementäre Verfahren bisher nicht zur klinischen Routine gehören (66,7 %) und im stationären Setting nicht erstattungsfähig sind (55,5 %). Zudem fehlten spezifisches Fachwissen und Personal.
Eine Patientin in einer qualitativen Studie berichtet als Grund gegen die Misteltherapie die unangenehmen Selbstinjektionen.233 Patientinnen, die mit der Standardtherapie zufrieden waren, waren nicht an der Misteltherapie interessiert. Diese Aussage unterstreicht das Ergebnis der statistischen Analysen der quantitativen Studien, die zeigen konnten, dass vor allem Patientinnen, die (sehr) unter den Nebenwirkungen leiden, eher dazu neigten, die Misteltherapie in Anspruch zu nehmen.
Zahlen zu den Zielen und Erwartungen für die Anwendung von KAM-Verfahren sind in den quantitativen Studien aus Patientinnenperspektive (Hübner et al. (2014); Moschen et al. (2001))234, 237 mit 197 Patientinnen beschrieben. Die wichtigsten Ziele für die Anwendung von KAM sind in beiden Studien die Stärkung des Immunsystems (beide über 80 %), eine Reduktion von Nebenwirkungen (81 %)234, Aktivwerden (80 %)234, die Verbesserung des Allgemeinzustands (53 %)237 und die Ergänzung der Standardtherapie (31 %)237. Sowohl Patientinnen als auch Personen des behandelnden Fachpersonals sehen die Misteltherapie als Option, um aktiv etwas zu tun, die somit Hoffnung gibt und infolge dessen die Krankheitsbewältigung fördert.230, 233
Qualitative Studien230, 233 bestätigen die Erwartungen und Therapieziele der quantitativen Studien und ergänzen, dass sich Patientinnen eine Verlangsamung des Tumorwachstums durch die Misteltherapie so erklären, dass dies durch die Stärkung des Immunsystems möglich sei.233 Eine Motivation für die Misteltherapie ist auch die Erhöhung des Wohlbefindens durch das anthroposophische BehandlungsSetting, in dem die Mistelextrakte verabreicht werden.233
In zwei der qualitativen Studien230, 233 wird auch ein breites Spektrum an Einstellungen zur Misteltherapie beschrieben, von einer grundsätzlichen Ablehnung komplementärer Methoden bis hin zu einer Bevorzugung der Misteltherapie gegenüber der konventionellen Medizin. Anwenderinnen erwarten, dass die Misteltherapie ein sicheres und natürliches Verfahren ist. Negative Erwartungen beziehen sich auf eine befürchtete Förderung des Tumorwachstums und dass die Misteltherapie wirkungslos ist233.
Aus Sicht des behandelnden Fachpersonals werden einige weitere Erwartungen berichtet. Kalder et al. (2001)65 berichten die Einschätzung von 186 Ärztinnen und Ärzten zum positiven Einfluss der Misteltherapie auf partielle Remissionen des Tumors (im Median 10 %), auf eine Stabilisierung der Erkrankung (im Median 25 %) und auf das Fortschreiten der Erkrankung (im Median 27 %), teilweise mit Spannweiten von null bis 100 %. Den Beitrag der Misteltherapie auf eine gleichbleibende oder verbesserte Lebensqualität schätzen die Ärztinnen und Ärzte auf im Median 25 % beziehungsweise 32 % (Spannweite jeweils null bis 100 %).65 Die große Spannweite zeigt, dass die Einschätzung bei den Ärztinnen und Ärzten weit auseinander geht. Zwei der Studien (Münstedt, Kalder) berichten Motivationsfaktoren seitens der Ärztinnen und Ärzte, die Misteltherapie anzubieten. Diese sind: eine Verbesserung der Lebensqualität, eine Verstärkung der Effekte der konventionellen Behandlung und eine Reduktion der Nebenwirkungen.
Den Wissensstand zu KAM-Verfahren beschreiben zwei quantitative Studien, eine aus Patientinnen-und eine aus Behandelndenperspektive. In der Studie von Hübner et al.234 mit 80 Patientinnen haben 81 % der Patientinnen, die angaben, die Wirkweise des verwendeten KIM-Verfahrens verstanden zu haben, das KIM-Verfahren auch angewendet. Von den Patientinnen, die angaben, die Wirkweise eines KIM-Verfahrens nicht verstanden zu haben (20 %), wendeten 56 % das Verfahren trotzdem an.234 Insgesamt haben 80 % der Patientinnen angegeben, dass sie die Wirkweise des angebotenen KIM-Verfahrens verstanden haben und 20 % haben angegeben, sie nicht verstanden zu haben.
Nach Angabe der 104 Fachpersonen aus dem Krankenhausbereich in der Studie von Klein et al.235 stellen fehlendes Fachwissen, fehlende Qualifikationen und fehlende Evidenz zur Wirksamkeit der Misteltherapie beziehungsweise des KAM-Verfahrens wichtige Hindernisse für eine Anwendung von KIM im stationären Bereich dar.235
Wie nehmen Patientinnen und das behandelnde Fachpersonal die Therapie wahr?
Patientinnen, die eine Misteltherapie anwenden, nehmen die Misteltherapie durchweg als positiv wahr und sind bereit, auch Lokalreaktionen zu tolerieren. Patientinnen, die einer Misteltherapie neutral gegenüberstehen oder diese ablehnen, wenden diese in der Regel auch nicht an. Die wahrgenommene Wirkung der Misteltherapie durch die Patientinnen bezieht sich unter anderem auf die Verbesserung der eigenen Lebensqualität durch Stärkung und Aktivierung des eigenen Körpers. Beim behandelnden Fachpersonal gehen die Meinungen zur Misteltherapie auseinander, jedoch gibt es auch einige Anwendende der Misteltherapie, die selbst nicht von der medizinischen Wirksamkeit überzeugt sind.
Die Wahrnehmung der Misteltherapie beruht auf Erfahrungen von Patientinnen und behandelndem Fachpersonal mit der begleitenden Misteltherapie und der Zufriedenheit mit der Misteltherapie im Alltagsleben. Erfahrungswerte der behandelnden Personen65,235,238 spiegeln die Gründe für und gegen die Verordnung der Misteltherapie wider, die im vorhergehenden Abschnitt beschrieben sind. Ein Grund für die Anwendung der Misteltherapie ist die Erwartung, dass die Lebensqualität verbessert wird. Konkrete Zahlen zur subjektiv wahrgenommenen Verbesserung der Lebensqualität durch Fachpersonen, die eine Misteltherapie bei Patientinnen anwenden, berichten Münstedt et al.238. Eine deutliche Verbesserung der Lebensqualität erlebten weniger Misteltherapeuten/innen (27 %) als UKT-Anbietende im Allgemeinen (38 %). Eine leichte Verbesserung nehmen mehr Misteltherapeuten/innen (32 %) als UKT-Anbietende (25 %) wahr.
Die subjektive Wahrnehmung der Misteltherapie wird in zwei qualitativen Studien230, 236 mit 13 Patientinnen mit Brustkrebs berichtet. Die wahrgenommene Wirksamkeit der Misteltherapie wird als deutlich weitreichender beschrieben als über quantitativ auswertbare Fragebögen erhoben wurde. Die Patientinnen berichten von einer stärkeren Vitalität und Aktivität230, 236, einer Unterstützung der eigenen Bewältigungsstrategie in Form von mehr Autonomie230, einer bewussteren Selbstfürsorge und dem Gefühl „eine Chance zu nutzen“, etwas im eigenen Leben besserzu machen230 und dem eigenen Körper Kraft zu geben236. Die Misteltherapie half den Patientinnen auch bei der Krankheitsbewältigung, indem sie seit der Anwendung entspannter seien und die Krankheit besser akzeptieren könnten. Die Mistelanwenderinnen schätzten die Misteltherapie und waren sehr tolerant gegenüber lokalen oder systemischen Nebenwirkungen, da sie darin eine Bestätigung für die Wirkung der Injektionen sahen.230 Die Patientinnen bei Konitzer et al.236 sprechen von der „goldenen Mistel“, die als „Sonne“, „Retter aus dem Teufelskreis“ und als eine „Gesundheitsbringerin“ wahrgenommen wird. Eine Patientin sieht auch den Krebs in der Mistel, die ähnlich aggressiv und fordernd sei wie der Krebs selbst und so die Patientin beim Kampf gegen den Tumor unterstütze. Auch die Rahmenbedingungen, in denen die Misteltherapie verabreicht wird, wie beispielsweise der ansprechende, gemütliche Infusionsraum oder das Ritual der Mistelinjektion mit anschließender Ruhephase, werden als sehr positiv wahrgenommen.236
Die Zufriedenheit mit der Misteltherapie lag in der quantitativen Studie von Hübner et al.234 bei 50 % der 15 Anwenderinnen. Zehn % waren indifferent und 40 % waren nicht zufrieden. Von den bewerteten KAM-Verfahren war die Zufriedenheit mit der Misteltherapie im Vergleich am niedrigsten.
Gibt es Faktoren, die eine Gruppe von Patientinnen daran hindern, Zugang zur begleitenden Misteltherapie zu erhalten, falls sich die Technologie als wirksam und sicher erweist? Wenn ja, welches sind die Faktoren?
Es wurden verschiedene Faktoren aus Sicht der behandelnden Personen berichtet, die im Krankenhaus-Setting eine Zugangsbarriere zur begleitenden Misteltherapie darstellen. In der Studie von Klein et al. (2017)235 beschreiben zwei Drittel der gynäkologischen Onkologinnen und Onkologen, dass integrative Medizin schlichtweg nicht Teil der Routineversorgung sei, jedoch scheitere die Einführung meistens daran, dass es für integrative Behandlungsmethoden im stationären Sektor keine Finanzierungsmöglichkeit gebe, wodurch der Anreiz fehle. Zudem herrsche ein Fachkräftemangel.
Für den ambulanten Bereich berichten weder Patientinnen noch das behandelnde Fachpersonal von Faktoren, die interessierten Patientinnen den Zugang zur Misteltherapie versperren. Es gibt Patientinnen, die davon berichten, dass einzelne Ärztinnen und Ärzte eine ablehnende Haltung gegenüber der Misteltherapie hatten, aber nicht, dass es sie davon abgehalten hätte, diese Therapieform anzuwenden.
Von einer fehlenden Infrastruktur oder möglichen finanziellen Problemen durch die Kosten der Misteltherapie berichtet keine der Patientinnen. Auch in den qualitativen Studien wurden weder die Kosten noch die Nebenwirkungen der Misteltherapie als Kritikpunkt oder Herausforderung erwähnt.
Wie werden Patientinnen über die Therapiemöglichkeiten im Zusammenhang mit der begleitenden Misteltherapie informiert und wie werden sie ihnen erläutert? Wie beurteilen Patientinnen die Information und Kommunikation?
Die Patientinnen werden häufig nach eigener Angabe zu wenig über die Misteltherapie informiert und wünschen sich mehr und längere persönliche Beratung durch eine kompetente Fachperson, bevorzugt aus der Onkologie oder der Allgemeinmedizin. Dieser Wunsch besteht unabhängig davon, ob die Patientinnen auch im Internet Informationen zur Misteltherapie finden.
Den Bereich der Kommunikation und Information behandelten vier Studien, eine quantitative Studie234 mit 80 Patientinnen, zwei Studien aus der Perspektive des behandelnden Fachpersonals235 mit 104 Ärztinnen und Ärzten und eine qualitative Studie230 mit 30 Patientinnen und Patienten.
Von den Patientinnen in der quantitativen Studie, von Hübner et al. (2014)234 mit 80 Patientinnen, berichten 39 %, dass ihnen das komplementäre Verfahren von einer behandelnden Person aus der Gruppe des nicht-medizinischen Fachpersonals erklärt wurde, seltener jedoch von Ärztinnen und Ärzten aus der Onkologie (33 %) und der Allgemeinmedizin (28 %). 70 % der Patientinnen waren der Meinung, dass die Beratungszeit zu komplementären Methoden nicht ausreichend war und hätten sich eine Beratung in größerem Umfang gewünscht. Die Patientinnen verfügen bereits über eine gewisse Medienkompetenz, da die Befragung in der Studie online über krebskompass.de durchgeführt wurde und hatten das Internet als wichtige Informationsquelle eingestuft, um Informationen und Hilfestellungen zu bekommen. Dennoch besteht der Wunsch nach persönlicher Beratung. Auch eine Patientin aus der qualitativen Studie, von Gschwendtner et al. (2016)233 ist verärgert über die schlechte Informations- und Beratungslage zur Misteltherapie, weil sie ihre Ärztin beziehungsweise ihr Arzt noch nicht aktiv dazu beraten hat.233 Bei der Beratung steht für die Patientinnen vor allem die Fachkompetenz der beratenden Person, in der Regel des behandelnden Arztes oder der behandelnden Ärztin, im Vordergrund. Onkologinnen beziehungsweise Onkologen und andere spezialisierte Fachärztinnen/-ärzte werden mit 12 beziehungsweise 14 % für weniger informiert gehalten als Naturheilkundler/innen (19 %) und sogar nicht-medizinisches Fachpersonal (16 %)234. Die Expertise zu KIM-Verfahren wird von Patientinnen für Ärztinnen und Ärzte aller Fachrichtungen selten als gut beurteilt. 14 % der Patientinnen sind der Meinung, dass sie gar keine Fachrichtung beziehungsweise behandelnde Person kennen, die sie für kompetent in Bezug auf KIM-Verfahren halten234. Die Kompetenz der beratenden Person, gepaart mit Vertrauen zu der Person, steht auch für die Patientinnen aus der qualitativen Studie233 im Vordergrund. Vertrauenspersonen werden als wichtiger und höher eingestuft als die verfügbare Evidenz.
Die Ärztinnen und Ärzte aus der Studie von Klein et al. (2017)235 hingegen geben an, dass bei 92 % der befragten Medizinerinnen und Mediziner bereits die behandelnde Ärztin beziehungsweise der behandelnde Arzt selbst die Beratung übernimmt. Nur in manchen Fällen würden spezialisierte Zentren oder sonstige Fachdisziplinen aufgrund des besseren Fachwissens die Beratung übernehmen. Es besteht die Möglichkeit, dass die Stichprobe der Ärztinnen und Ärzte, die an der Umfrage zu KAM-Verfahren teilgenommen haben, bereits in besonderer Weise für das Thema sensibilisiert war und nicht repräsentativ ist für Medizinerinnen und Mediziner im deutschsprachigen Raum. Unklar ist, zu welchen KAM-Verfahren die Ärztinnen und Ärzte beraten.
Hübner et al.234, haben eine Online-Befragung dazu über krebskompass.de durchgeführt. Das Internet wurde als wichtige Informationsquelle eingestuft, das Informationen und Hilfestellungen für Krebspatientinnen mit Brustkrebs bietet.
Die Bedeutung der Kommunikation mit dem Behandelnden oder einem vertrauenswürdigen Beratungszentrum gewinnt dadurch an Bedeutung. Diese Haltung bestätigen Patientinnen in der Studie von Münstedt et al. (2014)187, die berichtet, dass Patientinnen und Patienten am liebsten von dem/der behandelnden Onkologen/Onkologin, dem/der sie auch die höchste Glaubwürdigkeit zuordneten, zu KIM beraten werden wollen und dass der Onkologe/die Onkologin die Therapie selbst durchführt.187
Die Limitationen der Analyse zu Patienten- und sozialen Aspekten ergeben sich vor allem aus der Literatursuche sowie der Quantität und Qualität der Studien.
Die Literatursuche zu Publikationen mit relevanten Ergebnissen zu Patienten- und sozialen Aspekten gestaltete sich schwierig, da es keine einheitliche Verschlagwortung relevanter Suchbegriffe zu Patienten- und sozialen Aspekten gibt, sondern die relevanten Themen über eine große Bandbreite an Formulierungen oder Begriffen ausgedrückt werden können. Patienten- und soziale Aspekte werden fachübergreifend in verschiedenen Disziplinen adressiert, wie beispielsweise in der Psychologie, in den Sozialwissenschaften und in der Medizin. Zudem ist ein Teil der Literatur, die für den deutschsprachigen Raum relevant ist, nur auf Deutsch veröffentlicht und nicht in den großen medizinischen Datenbanken zu finden, die beispielsweise in der allgemeinen Datenbanksuche (beschrieben in Abschnitt 3.1.2.1) verwendet wurden.
Um dieser Herausforderung zu begegnen, haben wir folgende Maßnahmen getroffen:
-
(1) Datenbanken aus verschiedenen Fachdisziplinen (Ökonomie, Psychologie, Medizin) und eine fachübergreifende Datenbank (Web of Science) wurden für die Suche ausgewählt.
-
(2) Eine umfassende Suche nach grauer Literatur wurde durchgeführt, z. B. über die Checkliste „Grey Matters“ und eine umfassende Internetsuche (siehe Tabelle 90).
-
(3) Die Titel und Zusammenfassungen (Abstracts) der umfassenden bibliografischen Datenbanksuche (Abschnitt 3.1.2.1), die für die Bewertung der medizinischen Wirksamkeit und Sicherheit durchgeführt wurde, wurden zusätzlich nach möglicherweise relevanten Referenzen zur Patienten- und sozialen Aspekten durchgesehen.
-
(4) Suchterme in der Internetsuche wurden nur auf die gesuchte Erkrankung, Brustkrebs, und die gesuchte Intervention, die Misteltherapie, beschränkt (Tabelle 90).
-
(5) Nur in Datenbanken, in denen die Anzahl der Treffer ohne weitere Einschränkung nicht mehr überschaubar gewesen wäre, wurden weitere Suchbegriffe mit Bezug zu Patienten- und sozialen Aspekten verwendet, jedoch sehr umfassend (siehe Tabelle 91, Tabelle 92 und Tabelle 94).
Nachdem wir großzügig möglicherweise relevante Referenzen in die Durchsicht der Titel und Zusammenfassungen (Abstracts) eingeschlossen hatten, erfolgte die Hauptselektion der Literatur durch die Autorinnen (CS und PSI).
Nachdem ein externes Gutachten den Hinweis geliefert hatte, dass die relevante Datenbank AMED in der Suchstrategie fehlte und weitere relevante Literatur nicht gefunden wurde, wurde nachträglich eine zusätzliche Datenbanksuche in den für anthroposophische Behandlungsmethoden einschlägigen Datenbanken AMED und Alt HealthWatch durchgeführt (beschrieben in Tabelle 95). Auch sämtliche im Gutachten genannten Publikationen208, 219–221, 236 wurden im Volltext durchgesehen und auf ihre Eignung geprüft. Vier der fünf Publikationen erwiesen sich als nicht geeignet für die Analyse der Patienten- und sozialen Aspekte, aber die qualitative Studie von Konitzer et al. (2001) wurde nachträglich in die Analyse eingeschlossen und ergänzt. Dennoch besteht die Möglichkeit, dass relevante Publikationen nicht gefunden wurden.
Die zweite große Limitation der Analyse der Patienten- und sozialen Aspekte ergibt sich aus der Quantität und Qualität der eingeschlossenen Studien. Nur zur Frage der Häufigkeit der Inanspruchnahme der Misteltherapie liegen mit zehn Studien mit 3.421 Patientinnen und drei Studien mit 654 Teilnehmern aus dem Fachpersonal etwas umfangreichere Daten zur Verfügung. Für die anderen Zielgrößen liegen aus Patientinnensicht nur Daten aus maximal zwei Querschnittstudien mit 197 Patientinnen und aus drei qualitativen Studien mit 43 Patientinnen vor. Hier ist die Evidenzlage als sehr gering zu bewerten. Auch die drei Querschnittstudien aus der Sicht des Fachpersonals umfassen nur 654 Teilnehmende und zwei dieser Studien wurden vor 20 Jahren durchgeführt und es ist fraglich, ob sich die gegenwärtigen Verhältnisse nicht unterscheiden.
Eine weitere Limitation in der Analyse der Patienten- und sozialen Aspekte ist die Tatsache, dass in den eingeschlossenen Studien, mit Ausnahme der qualitativen Studien230, 233, 236 und der Studie von Münstedt et al. (2000)238, Aussagen zu komplementären Methoden im Allgemeinen gemacht wurden, von denen die Misteltherapie nur eine Untergruppe darstellt. Insofern ist unklar, ob die gewonnenen Ergebnisse vollkommen auf die Misteltherapie übertragbar sind.
Die Begriffe „komplementäre Medizin“ beziehungsweise „KAM“ oder „KIM“ sind nicht klar definiert, sondern ein Sammelbegriff für unterstützende beziehungsweise ergänzende Verfahren, die unter anderem in der Onkologie zusätzlich zur Standardtherapie angewendet werden. Daher unterscheidet sich die Definition von KIM von Studie zu Studie. Obwohl mittlerweile der Begriff „integrative Medizin“ beziehungsweise „KIM“ von Fachmedizinern, die diese Verfahren anwenden, als treffender angesehen wird, ist in englischsprachigen Publikationen „CAM“ immer noch sehr stark verbreitet. Dementsprechend ist auch die Benennung im Ergebnisteil unterschiedlich und könnte verwirrend sein. Auch die Definition von KIM-Verfahren ist in den eingeschlossenen Publikationen und in der Literatur unterschiedlich und schwer vergleichbar.
Insgesamt sind unter den in die Analyse eingeschlossenen Studien kaum repräsentative Studien zu finden. Weder bei der Inanspruchnahme noch bei allen anderen Zielgrößen wird angenommen, dass die Ergebnisse auf die Population der Patientinnen mit Brustkrebs im deutschsprachigen Raum übertragbar sind. Es ist stets mit Selbstselektion der Studienteilnehmenden und einem Einfluss der Studien-Settings zu rechnen, beispielsweise ob die Studie in einem zertifizierten Brustkrebs-zentrum235, 239 oder online234 durchgeführt wurde. Deshalb ist nicht davon auszugehen, dass die Ergebnisse repräsentativ für die Gesamtheit aller Patientinnen mit Brustkrebs sind, aber für einzelne Settings erscheinen die Teilergebnisse der Analyse zu Patienten- und sozialen Aspekte durchaus übertragbar.
Die Übertragbarkeit von Ergebnissen aus Studien ausschließlich zur Misteltherapie sind generell eine Herausforderung, denn die Misteltherapie ist in der Regel nicht die einzige medizinische Intervention in der anthroposophischen Behandlung, sondern stellt im ganzheitlichen Setting einen Teil der Therapie dar.307 Die Ergebnisse in diesem SR basieren auf Querschnittstudien und qualitativen Studien, in denen auch andere Therapieformen erlaubt waren.
Den Autorinnen und Autoren des HTA-Berichts ist kein weiteres SR zu Patientenaspekten und sozialen Aspekten von Patientinnen mit Brustkrebs oder behandelnden Fachpersonen mit Bezug zur begleitenden Misteltherapie bekannt.
Die einzige uns bekannte Übersichtsarbeit zu einem ähnlichen Thema ist ein HTA-Bericht zu anthroposophischer Medizin in der Schweiz von Kienle et al. (2005)308, in dem neben der Sicherheit und Wirksamkeit der anthroposophischen Medizin auch deren Zweckmäßigkeit evaluiert wurde. In diesem HTA-Bericht ist definiert, dass „die Zweckmäßigkeit dann gegeben sei, wenn ein Bedarf nachgewiesen und Sicherheit und Unbedenklichkeit gewährleistet sind.“308 Zum Bereich Bedarf gehörten die Inanspruchnahme von anthroposophischen Verfahren, Gründe für die Inanspruchnahme und die Zufriedenheit mit der anthroposophischen Medizin. Die eingeschlossenen Studien wurden in vier Domänen unterteilt: (1) Anthroposophische Medizin als Gesamtsystem, (2) Nicht-pharmakologische Therapien, (3) Behandlung schmerzhafter Erkrankungen oder Wundpflege und (4) Anthroposophische Misteltherapie in der Onkologie. Die Studienpopulationen mussten aus therapeutischen oder prophylaktischen Gründen behandelt worden sein. Zur Zielgröße Bedarf, die auch die Zufriedenheit mit dem anthroposophischen Verfahren beinhaltet, wurden Ergebnisse aus vier Studien anderer Domänen berichtet, aber keine Ergebnisse zur Misteltherapie in der Onkologie. Daher gab es auch keine Übereinstimmung der eingeschlossenen Studien mit den von uns analysierten Studien zur Bewertung der Patienten- und sozialen Aspekte.
Bezüglich der soziodemografischen Charakteristika der Studienpopulationen sind der vorliegende Bericht und der HTA-Bericht von Kienle et al. (2005)308 vergleichbar. Die Patientinnen und Patienten, die anthroposophische Medizin anwenden, sind häufiger weiblich, gut ausgebildet und zwischen 30 und 50 Jahre alt.308 Da in diesem HTA nur Patientinnen mit Brustkrebs eingeschlossen wurden und Krebserkrankungen in der Regel erst in höherem Alter auftreten, ist es plausibel, dass unsere Studienpopulation mit circa 54 bis 60 Jahren etwas älter ist. Die Patientinnen und Patienten, die anthroposophische Verfahren anwendeten, waren insgesamt gut informiert und wollten aktiv an der Behandlung teilnehmen.
Die Misteltherapie war im HTA-Bericht zur anthroposophischen Medizin im deutschsprachigen Raum das am häufigsten verwendete komplementärmedizinische Verfahren in der Onkologie. Die Anzahl der onkologischen Patientinnen und Patienten aller Krebsarten, die eine Misteltherapie in Anspruch genommen haben, lag bei weit über 10.000, mit mehreren Millionen Mistelextraktinjektionen.308 Zusammengefasst bewerteten Kienle et al. den Bedarf an anthroposophischer Medizin, CAM und der Misteltherapie in der mitteleuropäischen Bevölkerung als hoch. Die Anwendung der anthroposophischen Medizin erfolgte in der Regel im Kontext der schulmedizinischen Versorgung oder auf besonderen Wunsch der Patientinnen und Patienten.308 Die Beliebtheit und Zufriedenheit mit anthroposophischer Medizin wurde auf Grundlage von Patientenzufriedenheitsbefragungen in anthroposophischen Krankenhäusern in der Schweiz insgesamt ebenso als hoch bewertet. Insbesondere die Kompetenz und Kommunikationsfähigkeit des medizinischen Fachpersonals werden von den Befragten geschätzt.
Konkrete Gründe, warum Patientinnen und Patienten anthroposophische Medizin angewendet oder eine Person aus dem anthroposophischen Fachpersonal konsultiert hatten, waren unter anderem psychische oder muskoskeletale Beschwerden und eine positive Einstellung zur anthroposophischen Medizin, die den Betroffenen ein besseres Verständnis der eigenen Erkrankung und einen aktiven Beitrag zur Gesunderhaltung ermöglicht. Auch eine Abwendung von der Schulmedizin, die damit begründet wurde, dass die Schulmedizin bei der eigenen Erkrankung nicht effektiv sei und zu viele Nebenwirkungen hätte, wurde als Begründung für anthroposophische Verfahren genannt, aber deutlich seltener und es ist unklar, auf welche Art von Erkrankung sich diese Einstellung bezog.308 Eine Publikation zum Update des HTA-Berichts zur anthroposophischen Medizin berichtete keine weiteren Ergebnisse zu Patienten- oder sozialen Aspekten.309
Einige der Studien, die wir im Zuge der Studienselektion zu Patienten- und sozialen Aspekten von KIM-Verfahren durchgesehen haben, konnten meistens aufgrund zu geringen Anteils an Patientinnen mit Brustkrebs oder Misteltherapie nicht eingeschlossen werden, berichten jedoch zu ähnlichen Aspekten. Aus der Perspektive des behandelnden Fachpersonals wurden vor allem die Gründe gegen die Misteltherapie sowie der Wissensstand zur Misteltherapie und KIM im Allgemeinen auch von anderen adressiert. Hinsichtlich des mangelnden Wissens zu KIM beim Fachpersonal, entsprechen unsere Ergebnisse einer Studie von Conrad et al.163, in der nur 21 % der befragten Palliativmediziner/innen und ‑mediziner in Deutschland angaben, ausreichend über KIM informiert zu sein. In einer weiteren Studie von Dahlhaus et al.164 gaben zehn von zehn Hausärztinnen und – ärzten (100 %) in qualitativen Interviews an, dass sie sich bezüglich KIM-Verfahren unsicher fühlen und Wissenslücken haben. Die Publikation von Fasching et al.232, die nur für die Bewertung der Inanspruchnahme eingeschlossen werden konnte, unterstreicht, dass es trotz der unsicheren Evidenzlage überraschend sei, wie viele Medizinerinnen und Mediziner dennoch KIM-Verfahren anböten und vermuten einen Zusammenhang zu ökonomischen Anreizen, da ein hoher Anteil der Patientinnen mit Brustkrebs zumindest einen Anteil der Kosten von der Krankenkasse erstattet bekäme.
Diese Publikation232 liefert auch eine mögliche Begründung dafür, dass die Kosten der Misteltherapie von keiner der Patientinnen erwähnt wurden, weder als Hindernis noch als finanzielle Belastung, obwohl Ärztinnen und Ärzte in einer Studie65 angeben, dass sie die Misteltherapie nicht anwenden, weil diese zu teuer sei. Fasching et al.232 befragten die Studienteilnehmerinnen auch zu finanziellen Aspekten in Bezug zu KIM. In der Studie beschreiben circa 50 % der KIM-Anwenderinnen, dass die Kosten von der Krankenkasse übernommen werden. Bei weiteren 32 % übernimmt die Kasse einen Teil der Kosten. In wie weit die Kostenübernahme auf die Misteltherapie übertragbar ist, ist unklar.
Aus der Perspektive der Patientinnen wurde besonders häufig der Bereich Kommunikation und Information adressiert, insbesondere der offene Beratungsbedarf und die Bewertung der Arzt-PatientenKommunikation. So berichtete eine der im vorliegenden HTA-Bericht eingeschlossenen Studien234, dass 70 % der Patientinnen der Meinung waren, dass die Beratungszeit zu KIM-Verfahren nicht ausreichend war und sie sich wünschen würden, dass die Beratung in einem größeren Umfang stattfindet. Die Ergebnisse einer Umfrage bei der Ersten Offenen Krebskonferenz in Berlin von Theobald et al. (2005)66 zum Beratungsbedarf und der Beratungsqualität aus der Sicht von Patienten mit Krebs zeigen, dass die Beratung in der Arzt-Patienten-Kommunikation vor allem zur Diagnose (85 %), Diagnostik (94 %), Operation (87 %), Standardtherapie (61 bis 62 %) und Nachsorge (93 %) stattfindet, aber zur Misteltherapie eher seltener (30 %). Die Beratungsqualität wird von den Patientinnen vor allem in den Bereichen als sehr gut angesehen, bei denen häufig eine Beratung stattfindet. Die Beratung zur Misteltherapie wird von 46 % der Patientinnen als sehr gut oder gut angesehen, aber auch von 24 % als mangelhaft oder ungenügend. Zu Gründen, warum KIM-Anwenderinnen nicht mit der behandelnden Ärztin beziehungsweise dem behandelnden Arzt darüber gesprochen hatten, berichten Tautz et. al. (2012)241, dass sie nicht nach KIM gefragt wurden (25 %), dass sie das Krankenhaus-Setting nicht für den richtigen Ort halten würden, um sich über KIM zu unterhalten (11 %) oder sie hätten Bedenken, dass die Spezialistin oder der Spezialist in der Klinik KIM nicht befürwortet.
Als Informationsquelle wünschten sich Patientinnen in der im vorliegenden Bericht eingeschlossenen Studie von Moschen et al. eine direkte Beratung durch behandelnde Ärztinnen und Ärzte und Online-Informationsmöglichkeiten.237 Diese Studie ist bereits 20 Jahre alt. Diese Haltung bestätigen Patientinnen in einer später durchgeführten Studie von Münstedt et al. (2014)187, in der Patientinnen und Patienten am liebsten von der/dem behandelnden Onkologin/Onkologen, der/dem sie auch die höchste Glaubwürdigkeit zuordneten, zu KIM beraten werden wollen. Die Onkologin beziehungsweise der Onkologe sollte die Therapie am besten auch selbst durchführen.187
Die interdisziplinäre S3-Leitlinie der AWMF für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms in den Fassungen von 20179 und 202036 gibt zur Patientinnenaufklärung und ‑information zu Methoden der Komplementärmedizin eine konsensbasierte Expertenempfehlung ab: „Alle Patientinnen sollten befragt werden, ob sie komplementäre und/oder alternative Therapien in Anspruch nehmen. Patientinnen, die solche Verfahren einsetzen, sollen auf mögliche Risiken und ggf. auf Interaktionen mit Standardtherapien hingewiesen werden. In der Konsultationsfassung der S3-Leitlinie Komplementärmedizin in der Behandlung von onkologischen PatientInnen50 gibt es einen eigenen fünf Seiten umfassenden Abschnitt (3.1.) zur Patientinneninformation und ‑aufklärung und sechs auf Expertenkonsens basierenden Empfehlungen rund um dieses Thema. Im Unterschied zur „Kann“-Empfehlung in der organspezifischen S3-Leitlinie „alle Patientinnen sollten befragt werden, ob sie eine komplementäre […] Therapie in Anspruch nehmen“ wird in der S‑3 Leitlinie zur Komplementärmedizin eine starke Empfehlung (3.1) gegeben: „Alle Patienten sollen frühestmöglich und im Verlauf wiederholt zur aktuellen und geplanten Anwendung von komplementären Maßnahmen befragt werden und gezielt auf mögliche Interaktionen zwischen diesen Anwendungen und der Krebstherapie hingewiesen werden.“ Dieser Empfehlung folgt eine analoge Empfehlung (3.2) zur Befragung der Patienten beziehungsweise Patientinnen zu ihrem Interesse an Informationen zu komplementärmedizinischen Maßnahmen „und bei Interesse soll auf verlässliche Informationsquellen verwiesen werden“. Eine weitere Empfehlung (3.3) für den Fall, dass Ärzte und Ärztinnen komplementärmedizinische Verfahren empfehlen, ist, dass sie die Patientinnen und Patienten auf mögliche Qualitätskriterien für Anbietende hinweisen, und unseriöse Methoden zum Schutz der Patientin oder des Patienten klar benennen sollen. In einer vierten Empfehlung (3.5) zur Gesprächsführung wird aufgefordert: „Die Beratung zu komplementärmedizinischen Maßnahmen soll einer systematischen, auf die Bedürfnisse der Patienten ausgerichteten Gesprächsführung folgen, sowie die aktuelle Evidenz berücksichtigen.“ In weiteren Ausführungen umfasst diese Empfehlung zwölf Punkte, die bei einem solchen Gespräch berücksichtigt werden sollen: Setting der Beratung, Qualifikation der Beratenden, Gesprächsvorbereitung, Einbeziehung von Begleitpersonen, Ablauf, Vorwissen sowie die persönliche Einstellung der Patientinnen beziehungsweise Patienten, evidenzbasierte Beantwortung der Fragen der Patientinnen oder Patienten, Orientierung an den individuellen Bedürfnissen, Fähigkeiten und Ressourcen der Patientinnen oder Patienten, Spektrum von KAM-Verfahren und supportiven Maßnahmen, Bedarf an psychologischer Unterstützung bei den Patientinnen und Patienten, Zusammenfassung in schriftlicher Form und Follow-up-Angebot. Des Weiteren gibt es zwei Empfehlungen zum Kenntnisstand der Beratenden und zur Aus- und Weiterbildung des medizinischen Fachpersonals. Empfehlung (3.4): „Ärztliche und nichtärztliche Anbieter und Berater zu komplementärmedizinischen Maßnahmen sollen Wissen zu onkologischen Erkrankungen haben, sich zu den entsprechenden Maßnahmen fortgebildet haben, sowie die Wirkweise, Indikationen und Kontraindikationen sowie die Grenzen dieser Maßnahmen bei onkologischen Patienten kennen.“ Empfehlung (3.6) lautet: „Die Leitliniengruppe empfiehlt die verstärkte Aus‑, Weiter- und Fortbildung des medizinischen Fachpersonals zur Komplementärmedizin zur Verbesserung der qualitätsgerechten Anwendung der Komplementärmedizin als Therapie in der Onkologie/ Diese Empfehlungen adressieren sowohl das im vorliegenden Bericht in den eingeschlossenen Studien zum Ausdruck gebrachte Informations- und Kommunikationsbedürfnis der Patientinnen und Patienten als auch den vom medizinischen Fachpersonal geäußerten Mangel der eigenen Kenntnisse.
Die zusätzlichen Informationen aus der Domäne Patienten- und soziale Aspekte ermöglichen, ein umfassenderes Bild zum Einsatz der Misteltherapie zu erhalten. Ein offener Umgang mit der Misteltherapie als begleitender Behandlungsoption und zu versuchen, mehr über die Motivation für und gegen die Anwendung der Misteltherapie zu erfahren, kann aufschlussreich sein für die Therapieplanung und die medizinische Entscheidungsfindung.
Patientinnen, die während einer Therapie zusätzlich eine Misteltherapie oder andere KIM-Verfahren anwenden, sollten sich dessen bewusst sein, dass auch die oft als „natürlich“ und harmlos wahrgenommenen pflanzlichen KIM-Verfahren eine Wirkung auf den Körper haben und das behandelnde Fachpersonal bei der Therapieplanung darüber informiert sein muss. Nur so können Nebenwirkungen eingeordnet werden. Wechselwirkungen zwischen der Misteltherapie und Zytostatika wurden bisher in randomisierten Studien nicht belegt, könnten aber theoretisch mit allen pharmakologisch aktiven Substanzen vorkommen. Behandelnde Personen sollten sich dessen bewusst sein, dass Patientinnen auch dann eine Misteltherapie oder andere KIM-Verfahren anwenden könnten, wenn sie nichts davon wissen und diese nicht von ihnen verordnet wurde(n). Patientinnen in der Studie von Moschen et al. beschrieben, dass sie das Thema komplementäre Verfahren von sich aus nicht ansprechen würden, auch aus Angst vor Konfrontationen mit den behandelnden Ärztinnen/Ärzten.237 Hierzu schließen wir uns den Empfehlungen aus der S‑3-Leitlinie zur Komplementärmedizin50 an und empfehlen behandelnden Fachpersonen, bei den Patientinnen proaktiv nachzufragen. Sowohl Patientinnen als auch das Fachpersonal sollten für das Thema sensibilisiert werden. Patientinnen sollte grundsätzlich die Möglichkeit angeboten werden, sich von einer kompetenten Person des medizinischen Fachpersonals beraten zu lassen.
Um eine informierte gemeinsame Therapieentscheidung für oder gegen die Misteltherapie treffen zu können, muss der Beratungsbedarf auf beiden Seiten, sowohl für Patientinnen als auch für das behandelnde Fachpersonal, abgedeckt worden sein. Daher sollten wissenschaftliche Informationen zur Misteltherapie leicht zugänglich sein und idealerweise aus zwei Teilen bestehen: aus wissenschaftlicher Evidenz und aus einer wissenschaftlich fundierten persönlichen Beratungsmöglichkeit. Hier kann ebenfalls auf die detaillierten Ausführungen zur Gesprächsführung der S‑3-Leitlinie zur Komplementärmedizin verwiesen werden.50 Für Patientinnen bietet sich eine persönliche Beratung durch kompetentes medizinischen Fachpersonal an. Um dem Bedarf nach Informationen zu begegnen, gibt es im klinischen Bereich die vermehrte Errichtung von Beratungszentren zu komplementärer und integrativer Medizin, ähnlich zu den sieben Beratungszentren der Projektpartner im „Kompetenznetz Komplementärmedizin in der Onkologie“ (KOKON) in Nürnberg, Hamburg, Rostock, Berlin, Essen, Hannover und München. Die KOKON-Initiative hat in der zweiten Förderphase bereits den Schwerpunkt auf die Ausbildung von Ärztinnen und Ärzten sowie einen besseren Zugang zu Informationen für Patienten und Angehörige gelegt.310
In welcher Form praktizierende Ärztinnen und Ärzte eine Fortbildung erhalten könnten, wäre näher zu untersuchen. Hier fordert die S‑3-Leitlinie ebenfalls eine verstärkte Aus‑, Fort- und Weiterbildung. Auf KIM-Verfahren und Hinweise zur Beratung sollten vor allem bei den Krebsarten, bei denen diese häufig nachgefragt werden, auch ausführlicher in die organspezifischen S3-Behandlungsleitlinien integriert werden. Sie werden vom Fachpersonal ohnehin verwendet, um sich zum aktuellsten Behandlungsstandard schulmedizinischer Verfahren zu informieren. Die S3-Behandlungsleitlinie zu „Komplementärmedizin in der Behandlung von onkologischen Patientinnen“50, stellt hier eine wichtige Referenz dar.
Qualitativ hochwertige Online-Informationsmöglichkeiten zur Misteltherapie für Interessierte gibt es bereits, beispielsweise auf der Website Medizin transparent von Cochrane Österreich311 oder auf den Webseiten der Deutschen Krebsgesellschaft e. V. (DKG)312, 313 sowie des Krebsinformationsdiensts des Deutschen Krebsforschungszentrums (DKFZ).35 Auf den Webseiten der Bundeszentrale für gesundheitliche Aufklärung314 und im 2020 vom Bundesministerium für Gesundheit gestarteten nationalen Gesundheitsportal315 sollte die Misteltherapie noch aufgenommen werden. Auch Hersteller und Interessensgemeinschaften bieten für Laien und Laiinnen verständliche und großteils seriöse Informationen. Die Herausforderung für Interessierte ist, herauszufinden, welche der zahlreichen Suchergebnisse vertrauenswürdige Quellen sind, deshalb wären hier Hinweise durch Fachpersonal ebenfalls hilfreich.
Eine größere, möglichst repräsentative Erhebung im deutschsprachigen Raum zur tatsächlichen Inanspruchnahme der Misteltherapie mit genaueren Informationen zur Therapieform und Anwendungsdauer, wäre ein wichtiger Schritt, um besser einschätzen zu können, in welchem Rahmen die Anwendung von Mistelpräparaten bei Patientinnen mit Brustkrebs ein aktuelles und relevantes Thema ist.
Es sollten qualitativ hochwertige quantitative Studien aus der Perspektive von Patientinnen zu Erfahrungen, Wissen, Zugang, Zufriedenheit, insbesondere aber zur Art, Umfang und Bewertung von Patientinneninformation und der Arzt-Patienten-Kommunikation zur Misteltherapie, genauso wie aus Perspektive des behandelnden Fachpersonals durchgeführt werden. Diese könnten dann Grundlage für verbesserte Patientinneninformationen und Kommunikationsprozesse darstellen.
Die geringe Anzahl der qualitativen Studien230, 233, 236 zu insgesamt 43 Patientinnen mit Brustkrebs, die jeweils nur eine Teilmenge der interviewten Personen in der Studie darstellen, gibt Grund zur Vermutung, dass es noch nicht erfasste Aspekte gibt. Bei Brandenberger et al. wurden die Ergebnisse für die vier Patientinnen mit Brustkrebs getrennt veröffentlicht, jedoch wären Studien hilfreich gewesen, in denen klarer beschrieben ist, welche Aussagen von Patientinnen mit Brustkrebs kamen und ob die Befragungen bis zur theoretischen Sättigung durchgeführt wurden, das heißt, es würden erst dann keine weiteren Patientinnen mehr befragt werden, wenn keine neuen Aspekte mehr genannt werden, sondern sich die Aussagen wiederholen. Qualitative Studien zur Perspektive des behandelnden Fachpersonals im deutschsprachigen Raum fehlen ebenso, nur aus der Perspektive verschiedener europäischer Länder gibt es Befragungen von erfahrenen Misteltherapeuten/innen.123, 214
Die Ethik-Domäne versuchte die Frage zu beantworten, welche ethischen Aspekte auf individueller und berufsethischer Ebene bei der palliativen Misteltherapie bei Patientinnen mit Brustkrebs relevant sind. Hierfür wurden explorativ Leitlinien oder Empfehlungen und systematisch Fachartikel gesucht. Zusätzlich wurden weitere Aspekte über die Anwendung von ethischer Theorie (Reflexion) identifiziert. Die Suche nach ethischen Leitlinien oder Empfehlungen zur (palliativen) Misteltherapie bei verschiedenen Fachgesellschaften und Vereinen der Komplementär‑, Alternativ- oder Integrativmedizin führte zu keinen Ergebnissen, die im Rahmen dieses HTA-Berichts sinnvoll verarbeitet werden konnten. Durch die systematische Suche in PubMed, Sowiport und Ethicsweb konnten hingegen 17 Fachartikel gefunden beziehungsweise ausgewählt werden (vgl. Kapitel 4.4), die für die Identifizierung von ethischen Aspekten bei der palliativen Misteltherapie bei Brustkrebs als hinreichend relevant eingestuft wurden. Zusammen mit einer zusätzlichen theoretischen Reflexion mittels des verwendeten ethischen Rahmengerüstes mit sechs Prinzipien „mittlerer Reichweite“ (Nutzen, Schaden, Selbstbestimmung, Gerechtigkeit, Effizienz (Kosten), Legitimität) (vgl. Abschnitt 1.5) konnten dadurch insgesamt 26 ethische Aspekte identifiziert werden (vgl. Kapitel 5.4), Die meisten der Aspekte (n = 21) wurden als ethische Risiken klassifiziert (Gefahr, ein ethisches Prinzip unzureichend zu berücksichtigen), die restlichen als ethische Herausforderungen (Abwägung zwischen ethischen Prinzipien erforderlich). Auf Grundlage dieser ethischen Aspekte, die oft allgemeinere Aspekte der Komplementär- oder Integrativmedizin (KIM) wiedergaben (vgl. Kapitel 1.5), konnten acht konkrete Kriterien und vier konkrete Konflikte für die palliative Misteltherapie bei Brustkrebs herausgearbeitet werden, die vor dem Hintergrund der Ergebnisse der anderen Domänen auf ihre Kohärenz und Konsistenz geprüft wurden.
Zusammenfassend lassen sich sechs übergreifende Themen anhand der ethischen Aspekte beziehungsweise deren Konkretisierungen festhalten:
Als allgemeine(re) Themen, die grundsätzlich auch bei anderen KIM-Therapien oder auch bei konventionellen Therapien zutreffend sein können, sind zu nennen:
-
1. Schwierigkeiten bei der informierten Einwilligung in die Therapie (z. B. welche Inhalte erforderlich sind, um eine ausreichende Informierung zu gewährleisten, oder wie die Freiheit der Einwilligung vor zu starker Beeinflussung von vor allem Außen sichergestellt werden kann);
-
2. damit verbunden eine mögliche Gefahr eines „therapeutischen Missverständnisses“, das heißt einer fehlerhaften Überzeugung einer Patientin, dass eine nur palliativ eingesetzte Therapie Teil einer kausalen Therapie sei (hier also zur Behandlung des Brustkrebses diene);
-
3. Schwierigkeiten bei der Abwägung von Schadens- und Nutzenpotenzialen der Therapie (inklusive Wechsel- und Nebenwirkungen) oder deren Unterlassung.
Hinzu kommen spezifischere Themen, die bei der palliativen Misteltherapie besonders auftreten (jedoch keineswegs nur bei ihr auftreten müssen):
-
4. Probleme der quantitativ und/oder qualitativ nicht ausreichenden Evidenz, um Nutzen-und Schadenspotenziale abschätzen zu können, sowie zugrundeliegende Probleme der Evidenzgenerierung für die Misteltherapie;
-
5. die mögliche mangelnde Kommunikation oder Informierung zwischen Ärztinnen/Ärzten, KIM-Behandelnden und/oder Patientinnen, ob eine Misteltherapie begonnen wird oder wurde und mit welchen Modalitäten;
-
6. Schwierigkeiten mit dem Umgang von allfälligen Placebo‑, aber auch Nocebo-Effekten bei der Misteltherapie.
Ein Dreh- und Angelpunkt der ethischen Bewertung palliativer (und auch adjuvanter) Misteltherapie bei Brustkrebs dürfte die problematische Evidenzlage vor allem hinsichtlich der Wirksamkeit darstellen. Zum einen beziehen sich manche ethischen Aspekte beziehungsweise Kriterien/Konflikte unmittelbar auf diese, so beispielsweise all jene, die mit der Abschätzung und Abwägung von Nutzen- und Schadenspotenzialen zu tun haben. Zum anderen sind aber auch weitere ethische Aspekte beziehungsweise Kriterien/Konflikte von der Evidenzlage abhängig so beispielsweise Die Bedingungen einer erfolgreichen informierten Einwilligung in eine Therapie (Aufklärung über Nutzen- und Schadenspotenziale, Informierung über die Evidenzlage beziehungsweise den Stand der Wissenschaft) oder die Kommunikation zwischen Ärztinnen beziehungsweise Ärzten und KIM-Behandelnden aufgrund möglicher Diskrepanzen bei der Einschätzung der Wirksamkeit. Es handelt sich daher bei der palliativen Misteltherapie oft um Entscheidungen unter Unsicherheit. Bei diesen Entscheidungen wird – zumindest, solange Schadenspotenziale als minimal eingeschätzt werden und die Finanzierung unproblematisch ist – im konkreten Einzelfall voraussichtlich im besonderen Maße die Selbstbestimmung der Patientinnen ethisch maßgeblich sein, das heißt, ob diese die Therapie haben möchten oder nicht. Darüber hinaus könnten sich bei einer gegebenenfalls adjuvanten (nicht-palliativen) Misteltherapie, die ausschließlich von den Patientinnen privat zu bezahlen ist, zusätzliche Fragen hinsichtlich der Gerechtigkeit der rechtlichen Regelung stellen, da Krankenkassen Misteltherapie nur als palliative, nicht aber als adjuvante Therapie erstatten.
Über den Einzelfall hinaus müssen auch Entscheidungen auf der politischen Ebene dahingehend getroffen werden, ob die Kostenerstattung der palliativen Misteltherapie bei Brustkrebs angesichts der Unsicherheiten bei der Wirksamkeit weiterhin erfolgen soll. Auf institutioneller Ebene ist unklar, ob diese Unsicherheit mittel- und langfristig durch mehrere neue und/oder bessere Studien aufgehoben werden kann, da aufwändige Studien kostspielig sind und die Hersteller der Produkte komplementärmedizinischer Präparate möglicherweise die dafür erforderlichen Ressourcen nicht stellen können. Erschwerend kann hinzukommen, dass Studien zur Wirksamkeit keine rechtliche Bedingung für Misteltherapieprodukte darstellen, wie das bei Arzneimitteln, die unter die Zulassungsbedingungen des Arzneimittelgesetzes (AMG) fallen, zutreffend wäre. Homöopathische Arzneimittel (auch wenn als Teil anthroposophischer Medizin genutzt, vgl. Kap. 1.3 sowie AMG § 4 Abs. 33) und phytotherapeutische Arzneimittel beispielsweise sind zwar registrierungsfähig, aber von der sonst zwingenden Pflicht der Zulassungsbedingungen enthoben, oder folgen speziellen Zulassungsverfahren (vgl. AMG § 38 sowie auch § 25 Abs. 2 und § 105 Abs. 4). Dies gilt auch dann, wenn die homöopathischen Arzneimittel komplementär oder integrativ, das heißt nicht alternativ eingesetzt werden. Dieser Umstand könnte die Motivation der Hersteller, Studien durchzuführen, daher zusätzlich reduzieren. Ein möglicher Einwand hier ist allerdings, dass bei Registrierungsfähigkeit das Zulassungsverfahren und das Registrierungsverfahren alternativ zur Verfügung stehen, und für die Registrierung „im Wesentlichen die ebenso in einem Zulassungsverfahren vorzulegenden Unterlagen und Gutachten beizufügen sind“ (Pannenbecker (2016))316. Deshalb „kann es für den Antragsteller erstrebenswert sein, für ein bereits im Verkehr befindliches registriertes Arzneimittel die weitergehende Zulassung zu beantragen, um dieses sodann mit der Angabe von Indikationen in den Verkehr bringen zu können“ (Pannenbecker 2016)316; das heißt, es könnte durchaus auch einen Anreiz für Hersteller geben, therapeutische Studien durchzuführen.
Die weiteren identifizierten ethischen Aspekte beziehungsweise Kriterien/Konflikte bewegen sich meistens auf der Ebene allgemeiner medizinethischer Anforderungen (in der Regel ungeachtet der Evidenzlage hinsichtlich Wirksamkeit und Sicherheit), weshalb es auch insgesamt nicht überraschend ist, dass mehr ethische Risiken als Herausforderungen, die eine Abwägung erforderlich machen, identifiziert werden konnten. Dementsprechend wurden auch mehr Kriterien formuliert, die für einen ethisch vertretbaren Einsatz der palliativen Misteltherapie einzuhalten sind, als Konflikte, die zu beachten und im Einzel- oder Regelfall zu lösen sind.
Besonders zu betonen bleibt bei der (palliativen, aber auch adjuvanten) Misteltherapie bei Brustkrebs aber die Gefahr, aufgrund von Vorurteilen basierend auf ihrer Zugehörigkeit zur Komplementär- oder Integrativmedizin sowohl eine unfaire Einschätzung der Nutzen- und Schadenspotenziale und/oder eine nicht ausreichend neutrale Aufklärung über die Therapie durchzuführen. Dabei sind sowohl mögliche negative als auch positive Vorurteile (unter andrem aufgrund weltanschaulicher Überzeugungen) gleichermaßen zu beachten, da eine unkritische und über-optimistische Einschätzung der Nutzenpotenziale mit einer dann hinsichtlich des Nutzens systematisch verzerrten Aufklärung einer Patientin ebenfalls als ethisch problematisch zu beurteilen wäre. Hier sind daher berufsethisch nicht nur die Ärztinnen und Ärzte einer konventionellen Therapie in der Pflicht, sondern auch die Ärztinnen und Ärzte sowie KIM-Behandelnden, die die palliative Misteltherapie anbieten und durchführen. Nicht zuletzt müssen alle professionellen Beteiligten bei der Aufklärung oder Durchführung einer palliativen Misteltherapie bei Brustkrebs neben der konventionellen Therapie die Wünsche, Überzeugungen und angestrebten Therapieziele der Patientinnen zugunsten einer tragfähigen Arzt-Patienten-Beziehung (oder Behandler-Klienten-Beziehung) anerkennen, selbst wenn sie insbesondere die individuellen Krankheitskonzepte und weltanschaulichen Überzeugungen nicht teilen.
Es stellt sich bei den ethischen Aspekten im Rahmen eines HTA-Berichts oftmals die Frage, wie allgemein oder spezifisch die ethischen Aspekte, die gesucht werden, sein sollen. Ein zu spezifisches Suchen kann oft dazu führen, dass nichts gefunden wird (zum Beispiel auch schon auf der Ebene der Literatursuche), da ethische Aspekte selten so hochspezifisch für eine Gesundheitstechnologie ausfallen, dass sie nicht auch für andere Technologien zutreffend sein könnten. Ein zu allgemeines Suchen hingegen kann dazu führen, dass zu viel gefunden wird und zum Beispiel die Treffermenge an Literatur nicht mehr zu bewältigen ist. So wäre es auch bei der palliativen Misteltherapie denkbar gewesen, noch weitere allgemeinere Aspekte zu finden und aufzuführen. Es wurde aber versucht, bei der Such- und Selektionsstrategie einen „mittleren“ Weg zwischen unvermeidbarer Allgemeinheit und angestrebter Spezifität zu finden und dann insbesondere bei der Analyse der Texte und der Extraktion ethischer Aspekte jene zu identifizieren, die für die palliative Misteltherapie im Prinzip relevant sein können. Es kann aber aufgrund dieses „Mittelwegs“ nicht ausgeschlossen werden, dass es in nicht gesuchter beziehungsweise nicht eingeschlossener Literatur noch weitere ethische Aspekte geben könnte, die zu berücksichtigen wären. Deshalb erwies sich die zusätzlich durchgeführte Reflexion als sinnvoll, um theoretisch naheliegende, aber nicht in der eingeschlossenen Literatur gefundene Aspekte noch zu ergänzen.
Die methodische Sinnhaftigkeit einer Suche nach Leitlinien und Empfehlungen kann dagegen kritisch gesehen werden. Obwohl es gerade bei der Medizin-Domäne ein übliches Vorgehen ist, nach bestehenden (klinischen) Leitlinien zu suchen, scheint dieses Vorgehen bei ethischen Aspekten gerade bei einem Thema wie Misteltherapie (oder vielleicht auch KIM-Therapien generell) weniger fruchtbar. Dies liegt daran, dass spezifisch ethische Leitlinien generell, selbst bei konventionellen Therapien, (noch) eher selten sind, und daher auch nicht zu erwarten ist, dass sie bei KIM-Therapien in relevanter Weise verbreitet sind. Auch wird es schwieriger sein, „einschlägige“ Fachgesellschaften und Ähnliche zu identifizieren, die Autor/inn/en einer Leitlinie oder Empfehlung sein könnten, da nicht nur die Organisationsstrukturen, sondern vermutlich auch das Eigenverständnis von komplementär‑, alternativoder integrativmedizinischen Gesellschaften oder Vereinen anders ausfallen wird als jene einer „klassischen“ medizinischen Fachgesellschaft – so zum Beispiel das Schreiben von Leitlinien zu spezifischen Therapien nicht in derselben Weise als eine mögliche Aufgabe anerkannt wird, erst recht nicht das Schreiben von ethischen Leitlinien. Eine denkbare Möglichkeit als Alternative wäre die Sichtung von Lehrmaterialien, in denen eventuell auch ethische Überlegungen zur Umsetzung von Therapien gefunden werden könnten. Eine Prüfung dieser Möglichkeit lag aber außerhalb des zeitlichen und finanziellen Rahmens dieses HTA-Berichts.
Der vorliegende HTA-Bericht beinhaltet eine systematische Literaturübersicht zu Wirksamkeit und Sicherheit, Kosten und Kosteneffektivität, Patienten- und sozialen Aspekten sowie zur ethischen Bewertung.
Im Rahmen dieses HTA-Berichts konnten keine RCT zur medizinischen Wirksamkeit der begleitenden Misteltherapie hinsichtlich des Gesamtüberlebens bei Patientinnen mit Brustkrebs identifiziert werden. Eine Studie mit geringen Patientenzahlen zeigte nach fünf Jahren keinen statistisch signifikanten Unterschied im krankheitsfreien Überleben zwischen Patientinnen mit und ohne begleitender Misteltherapie.
Es gibt Evidenz aus drei randomisierten Studien, dass Nebenwirkungen der Chemotherapie gemessen anhand von Symptomskalen abgemildert und die HRQOL gemessen anhand von Funktionsskalen erhöht wird. Allerdings sind die Effekte eher gering bis moderat. Es ist unsicher, ob diese Effekte durch systematische Verzerrung der nur subjektiv messbaren Zielgrößen aufgrund unzureichender Verblindung in den Studien bedingt sein könnten.
Bekannte Nebenwirkungen der Misteltherapie, wie leichtgradige und moderate Lokalreaktionen, die in diesen und weiteren vier nicht-randomisierten Studien erhoben wurden, sind häufig, aber geringen Ausmaßes. Mögliche Wechselwirkungen zwischen Krebsmedikamenten und Mistelextrakten, die auf der Immunstimulation beruhen könnten, wurden in den eingeschlossenen Studien in diesem HTA-Bericht nicht untersucht.
Zu Kosten und Kosteneffektivität einer begleitenden Misteltherapie gibt es keine ausreichend validen Studien.
Bei dieser insgesamt unsicheren Datenlage kann eine Ausdehnung der Finanzierung der Misteltherapie auf die adjuvante Therapie durch die GKV nicht empfohlen werden. Über den Einzelfall hinaus müssen auch Entscheidungen auf der politischen Ebene dahingehend getroffen werden, ob die Kostenerstattung der palliativen Misteltherapie bei Brustkrebs angesichts der Unsicherheiten bei der Wirksamkeit weiterhin erfolgen soll.
Obwohl die Misteltherapie rezeptfrei zugelassen und verfügbar ist, ist zu hoffen, dass weitere randomisierte Studien durchgeführt werden, um die Unsicherheit hinsichtlich der Wirksamkeit zur Verbesserung der Lebensqualität zu reduzieren und auch mögliche Wechselwirkungen zwischen Krebsmedikamenten und Mistelextrakten als mögliche Nebenwirkungen zu erfassen. Auch die Wirksamkeit hinsichtlich des Gesamtüberlebens und des progressionsfreien Überlebens sollten untersucht werden. Eine Übersichtsarbeit speziell zu den methodischen Herausforderungen von randomisierten Studien zur Misteltherapie und entsprechenden Lösungsansätzen, könnte dann verwendet werden, um ein adäquates Studiendesign zu entwickeln.
Auch zu Wissen, Einstellung, Akzeptanz, Zufriedenheit, Erfahrungen, Erwartungen, Zugang, Art und Umfang der Arzt-Patienten-Kommunikation und Information zur Misteltherapie sollten möglichst repräsentative Befragungen durchgeführt werden.
Die Unsicherheit der bestehenden Datenlage macht es umso wichtiger, die Patientinnen neutral und kompetent zu beraten, unabhängig davon, welche Einstellung die Behandelnden oder Beratenden selbst zur Misteltherapie haben. Die wenigen Studien aus Patientinnensicht mit kleinen Teilnehmerinnenzahlen weisen darauf hin, dass sich die Patientinnen häufig nicht ausreichend durch Fachpersonal beraten fühlen und zum Beispiel bei ablehnender Haltung der Behandelnden diese dann nicht über eine stattfindende Misteltherapie informieren. Ein wichtiger Bestandteil der Patientinnenberatung sollte die verständliche und transparente Übermittlung der Tatsache sein, dass es derzeit keinen wissenschaftlichen Nachweis gibt, ob die Misteltherapie die Überlebenszeit oder das progressionsfreie Überleben bei Patientinnen mit Brustkrebs relevant verbessert, dass eine Verbesserung der HRQOL als eher moderat einzuschätzen ist und ebenfalls nicht als gesichert gelten kann. Außerdem sollte darauf hingewiesen werden, dass aufgrund der Immunstimulation eventuell Wechselwirkungen zwischen Krebsmedikamenten und Misteltherapie auftreten könnten, dazu aber ebenfalls unzureichende Daten vorliegen. Für Patientinnen, die medizinische Informationen aus dem Internet nutzen möchten, sollten Hinweise auf vertrauenswürdige Internetseiten, die Informationen zur begleitenden Misteltherapie enthalten, gegeben werden. Darüber hinaus kann hier auf die sechs Empfehlungen zur Patientinneninformation und ‑aufklärung in der Konsultationsfassung der S‑3-Leitlinie zur Komplementärmedizin in der Behandlung von onkologischen PatientInnen verwiesen werden.50
-
1. Statistisches Bundesamt (DESTATIS). Gestorbene in Deutschland, 2007 – 2017, nach Todesursachen: Bösartige Neubildungen Insgesamt und ICD-10 C‑50 (BN der Brustdrüse), Geschlecht (w/m) 2019 www-genesis.destatis.de/genesis/online/data;sid=9D615D84BA37D990D461FC6433AE6DE0.GO_1_ 2?operation=abruftabelleBearbeiten&levelindex=1&levelid=1555429279783&auswahloperation =abruftabelleAuspraegungAuswaehlen&auswahlverzeichnis=ordnungsstruktur&auswahlziel=we rteabruf&selectionname=23211–0002&auswahltext=&werteabruf=Werteabruf (20.02.2019).
-
2. Zentrum für Krebsregisterdaten. Brustkrebs (Mammakarzinom) ICD-10 C50. Daten zum Jahr 2014. 2017 www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Brustkrebs/brustkrebs_node.html (26.02.2019).
-
3. Robert-Koch-Institut. Krebs in Deutschland für 2015/16. Berlin: Robert Koch-Institut und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg.); 2019.
-
4. Statistisches Bundesamt (DESTATIS). Krankheitskosten: Deutschland, Jahre, Krankheitsdiagnose (ICD-10-C50), Geschlecht, Altersgruppen 2019 www.gbe-bund.de/oowa921-install/servlet/oowa/aw92/WS0100/_XWD_FORMPROC?TARGET=&PAGE=_XWD_2&OPINDE X=2&HANDLER=_XWD_CUBE.SETPGS&DATACUBE=_XWD_30&D.000=3738&D.001=10000 01&D.016=10040&D.003=43&D.022=9991&D.011=44302 (08.02.2019)
-
5. Statistisches Bundesamt (DESTATIS). GENESIS-online Datenbank. Krankheitskosten: Deutschland, Jahre, Krankheitsdiagnosen (ICD-10) 2016 www-genesis.destatis.de/genesis/online/data;jsessionid=B84977B7FC7ECC90A9AB41153F487DAD. tomcat_GO_1_2?operation=abruftabelleBearbeiten&levelindex=2&levelid=1467661955274&au swahloperation=abruftabelleAuspraegungAuswaehlen&auswahlverzeichnis=ordnungsstruktur& auswahlziel=werteabruf&selectionname=23631–0001&auswahltext=%23SICD10Y-ICD10-C50&werteabruf=Werteabruf (28.11.2019).
-
6. Statistisches Bundesamt (DESTATIS). GENESIS-online Datenbank. Krankheitskosten: Deutschland, Jahre, Krankheitsdiagnosen (ICD-10) 2020 www-genesis.destatis.de/genesis/online?operation=previous&levelindex=1&step=1&titel=Ergebnis&le velid=1583330154918&acceptscookies=false (04.03.2020).
-
7. Lange-Lindberg AM, Velasco-Garrido M, Busse R. Misteltherapie als begleitende Behandlung zur Reduktion der Toxizität der Chemotherapie maligner Erkrankungen. 2006.
-
8. Kompetenznetz Komplementärmedizin in der Onkologie (KOKON), Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. Onkopedia Leitlinien. Mistel (Viscum album). 2015 www.onkopedia.com/de/onkopedia/guidelines/mistel-viscum-album/@@view/html/index.html (08.06.2016).
-
9. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V.). Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. 2017.
-
10. Ettl J, Aivazova-Fuchs V, Braun M, Harbeck N, Heinemann V, Jansen H, Klein E, Michl G, Rack B, Rieder B, Stötzer O, Würstlein R. Systemische Therapie des metastasierten Mammakarzinoms. In: Tumorzentrum München (Hrsg.). Manual Mammakarzinome.
Empfehlungen zur Diagnostik, Therapie und Nachsorge. 15. Auflage, München, Wien, New York 2015: 310–335.
-
11. Harbeck N, Aivazova-Fuchs V, Anthuber C, Braun M, Hasmüller S, Lutz L, Michl G, Salat C, Sattler D, Schwoerer M. Adjuvante Systemtherapie. In: Tumorzentrum München (Hrsg.). Manual Mammakarzinome. Empfehlungen zur Diagnostik, Therapie und Nachsorge. 15. Auflage, München, Wien, New York 2015: 173–189.
-
12. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011;144(5): 646–674.
-
13. Kreienberg R, Albert US, Follmann M, Kopp I, Kühn T, Wöckel A, Zemmler T. Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms. Langversion 3.0. Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF); 2012.
-
14. International Medical College. IMC Wiki. Karzinogenese und Tumorwachstum 2016 www.med-college.de/de/wiki/artikel.php?id=43 (11.02.2019).
-
15. Krollner B, Krollner DM. ICD-Code 2016 www.icd-code.de/icd/code/C50.-.html (11.02.2019).
-
16. Mayr D, Sotlar K, Högel W, Permanetter W, Nährig J. Pathologie des Mammakarzinoms. In:
Tumorzentrum München (Hrsg.). Mammakarzinom. Empfehlungen zur Diagnostik, Therapie und Nachsorge. 15. Auflage 2015.
-
17. World Health Organization/ International Agency for Research on Cancer. Manual for Staging. In: Lakhani SR, Ellis IO, Schnitt SJ, Tan PH, van de Vijver MJ (Hrsg.). WHO Classification of Tumours of the Breast, 4. Auflage 2012.
-
18. Cserni G, Chmielik E, Cserni B, Tot T. The new TNM-based staging of breast cancer. Virchows Archiv: an International Journal of Pathology 2018;472(5): 697–703.
-
19. Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP. Toxicity and response criteria of the Eastern Coöperative Oncology Group. American Journal of Clinical Oncology 1982;5(6): 649–655.
-
20. Karnofsky D, Burchenal J. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod C (Hrsg.). Evaluation of Chemotherapeutic Agents, New York 1949: 191–205.
-
21. ECOG-ACRIN Cancer Research Group. ECOG Performance Status 2015 www.ecog-acrin.org/resources/ecog-performance-status.
-
22. De Ruysscher D, Niedermann G, Burnet NG, Siva S, Lee AWM, Hegi-Johnson F. Radiotherapy toxicity. Nature Reviews Disease Primers 2019;5(1): 13.
-
23. Darby SC, Ewertz M, McGale P, Bennet AM, Blom-Goldman U, Bronnum D, Correa C, Cutter D, Gagliardi G, Gigante B, Jensen MB, Nisbet A, Peto R, Rahimi K, Taylor C, Hall P. Risk of ischemic heart disease in women after radiotherapy for breast cancer. The New England Journal of Medicine 2013;368(11): 987–998.
-
24. Goldmann-Posch U, Martin RR. Überlebensbuch Brustkrebs. Die Anleitung zur aktiven Patientin. Stuttgart 2009.
-
25. Kubista E, Seifert M, Singer C. Moderne zielgerichtete Therapien beim Mammakarzinom ‑Wirkprinzip und klinische Anwendung. Bremen 2010.
-
26. Arbeitsgemeinschaft Gynäkologische Onkologie Kommission Mamma in der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe und der Deutschen Krebsgesellschaft. Diagnostik und Therapie von Patientinnen mit primärem und metastasiertem Brustkrebs. München 2016.
-
27. World Health Organization. WHO Definition of Palliative Care 2016 www.who.int/cancer/palliative/definition/en/ (08.06.2016).
-
28. Krebsgesellschaft, Lüftner D. OnkoInternetportal: Die Chemotherapie 2016 www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/therapieformen/chemotherapie.html (11.02.2019).
-
29. Pschyrembel. Stichwort “Chemotherapeutika” 2016 www.pschyrembel.de/#q=Chemotherapeutika&d=kw_4381439&f=&v=doc (26.05.2016).
-
30. DUDEN. Wörterbuch medizinischer Fachbegriffe. Stichwort “Chemotherapie”. Mannheim, Leipzig, Wien, Zürich. 2007.
-
31. Freissmuth M. Chemotherapie von Tumorerkrankungen. In: Freissmuth M, Böhm S, Offermanns S (Hrsg.). Pharmakologie & Toxikologie von den molekularen Grundlagen zur Pharmakotherapie, Heidelberg 2012: 723–764.
-
32. Wolf C, Eiermann W, Rack B, Salat C, Würstlein R. Primär systemische Therapie. In: Tumorzentrum München (Hrsg.). Manual Mammakarzinome. Empfehlungen zur Diagnostik, Therapie und Nachsorge. 15. Auflage, München, Wien, New York 2015: 163–172.
-
33. Deutsches Krebsforschungszentrum. Antikörper in der Krebsmedizin: Krebs erkennen, Krebs behandeln Wichtige Helfer bei der Diagnose und Therapie von Tumorerkrankungen 2019 www.krebsinformationsdienst.de/behandlung/monoklonale-antikoerper.php#inhalt10 (26.05.2006).
-
34. Freissmuth M. Chemotherapie von Tumorerkrankungen. In: Freissmuth M, Böhm S, Offermanns S (Hrsg.). Pharmakologie & Toxikologie von den molekularen Grundlagen zur Pharmakotherapie. 2. Auflage, Berlin/Heidelberg 2016: 786–845.
-
35. Deutsches Krebsforschungszentrum. Misteltherapie gegen Krebs 2019 www.krebsinformationsdienst.de/behandlung/unkonv-methoden/mistel.php (26.03.2020).
-
36. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF). Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. 2020. AWMF-Registernummer: 032–045OL.
-
37. DocCheck Medical Services GmbH. Rote Liste (Stand Arzneimittelinformationen: Januar 2016; Stand Preise: Februar 2016). 2016.
-
38. Pschyrembel. Stichwort “myeloplastisches Syndrom” 2016 www.pschyrembel.de/tf/myelodysplastisches%20Syndrom/K0M37/doc/ (17.06.2016).
-
39. Pschyrembel. Stichwort “Hand- und Fuß-Syndrom” 2016 www.pschyrembel.de/tf/Hand-Fu%C3%9F-Syndrom/K09EX/doc/ (17.06.2016).
-
40. Perry S, Kowalski TL, Chang CH. Quality of life assessment in women with breast cancer: benefits, acceptability and utilization. Health Qual Life Outcomes 2007;5: 24.
-
41. Bitzer E. Perspektiven der Patienten-Lebensqualität und Patientenzufriedenheit. In: Schwartz Fea (Hrsg.). Das Public-Health-Buch Gesundheit und Gesundheitswesen, München 2003: 453460.
-
42. Chopra I, Kamal KM. A systematic review of quality of life instruments in long-term breast cancer survivors. Health Qual Life Outcomes 2012;10: 14.
-
43. Katz JN, Larson MG, Phillips CB, Fossel AH, Liang MH. Comparative measurement sensitivity of short and longer health status instruments. Med Care 1992;30(10): 917–925.
-
44. Garratt AM, Ruta DA, Abdalla MI, Russell IT. SF 36 health survey questionnaire: II. Responsiveness to changes in health status in four common clinical conditions. Quality in Health Care 1994;3(4): 186–192.
-
45. Rammstedt B. Zur Bestimmung der Güte von Multi-Item-Skalen: Eine Einführung. 2004.
-
46. Bullinger M. Erhebungsmethoden. In: Tüchler H, Lutz D (Hrsg.). Lebensqualität und Krankheit auf dem Weg zu einem medizinischen Kriterium Lebensqualität, Köln 1991: 84–95.
-
47. Mokhatri-Hesari P, Montazeri A. Health-related quality of life in breast cancer patients: review of reviews from 2008 to 2018. Health Qual Life Outcomes 2020;18(1): 338.
-
48. Ghislain I, Zikos E, Coens C, Quinten C, Balta V, Tryfonidis K, Piccart M, Zardavas D, Nagele E, Bjelic-Radisic V, Cardoso F, Sprangers MAG, Velikova G, Bottomley A, European Organisation for R, Treatment of Cancer Quality of Life G, Breast Cancer G, Headquarters E. Health-related quality of life in locally advanced and metastatic breast cancer: methodological and clinical issues in randomised controlled trials. Lancet Oncology 2016;17(7): e294-e304.
-
49. Witt CM, Balneaves LG, Cardoso MJ, Cohen L, Greenlee H, Johnstone P, Kucuk O, Mailman J, Mao JJ. A Comprehensive Definition for Integrative Oncology. Journal of the National Cancer Institute Monographs 2017;2017(52).
-
50. Hübner J, Freuding M, Kutschan S, Dörfler S, Prott FJ, Beckmann M, Wörmann B, Horneber M, Witt C, Langhorst J, Neufeld T, Pfuhlmann K, Rist M, Dobos G, Cramer H, Klose P, Haller HKuR. Konsultationsfassung S3-Leitlinie Komplementärmedizin in der Behandlung onkologischer PatientInnen. 2020.
-
51. van Wyk BE, Wink C, Wink M. Handbuch der Arzneipflanzen. Ein Bildatlas. Stuttgart 2015.
-
52. Brockhaus. Stichwort „Mistel’ www.zeno.org/nid/2000084568X (19.06.2016).
-
53. Kooperation Phytopharmaka. Mistel 2020 www.arzneipflanzenlexikon.info/mistel.php (04.03.2020).
-
54. www.BioLib.de. Flora von Deutschland in Abbildungen nach der Natur, 2. Auflage. 4. Band (1905) 2007 biolib.mpipz.mpg.de/sturm/flora04/high/IMG_9008.html (18.06.2016).
-
55. Wikipedia. Weißbeerige Mistel 2020 de.wikipedia.org/wiki/Wei%C3%9Fbeerige_Mistel (22.01.2020).
-
56. Beer AM, Adler M. Klassische Naturheilverfahren: Grundsätzliches und Standortbestimmung. In: Beer A, Adler M (Hrsg.). Leitfaden Naturheilverfahren für die ärztliche Praxis 2011: 13–24.
-
57. Kienle GS, Kiene H. Complementary cancer therapy: a systematic review of prospective clinical trials on anthroposophic mistletoe extracts. European Journal of Medical Research 2007;12(3): 103–119.
-
58. Kienle GS, Glockmann A, Schink M, Kiene H. Viscum album L. extracts in breast and gynaecological cancers: a systematic review of clinical and preclinical research. Journal of Experimental & Clinical Cancer Research 2009;28: 79.
-
59. Kommission nach § 25 Abs. 6, 7 und 7a Satz 8 AMG für den humanmedizinischen Bereich, anthroposophische Therapierichtung (Kommission C) beim Bundesgesundheitsamt Monographie Viscum album, Bundesanzeiger Nr. 99a, 38. 1986.
-
60. E‑Kommission (Phytotherapie). Aufbereitungsmonographie Visci albi herba / Mistelkraut. Bundesanzeiger vom 5.12.1984; 1984.
-
61. Stebner FA. Die Rechtsaufsicht des Bundesministeriums für Gesundheit und die Gestaltungsfreiheit des Gemeinsamen Bundesausschusses. Arzneimittel & Recht 2011;06/11.
-
62. Fremd C, Hack CC, Schneeweiss A, Rauch G, Wallwiener D, Brucker SY, Taran FA, Hartkopf A, Overkamp F, Tesch H, Fehm T, Hadji P, Janni W, Luftner D, Lux MP, Muller V, Ettl J, Belleville E, Sohn C, Schuetz F, Beckmann MM, Fasching PA, Wallwiener M. Use of complementary and integrative medicine among German breast cancer patients: predictors and implications for patient care within the PRAEGNANT study network. Arch Gynecol Obstet 2017;295(5): 1239–1245.
-
63. Hack CC, Fasching PA, Fehm T, de Waal J, Rezai M, Baier B, Baake G, Kolberg HC, Guggenberger M, Warm M, Harbeck N, Wuerstlein R, Deuker JU, Dall P, Richter B, Wachsmann G, Brucker C, Siebers JW, Fersis N, Kuhn T, Wolf C, Vollert HW, Breitbach GP, Janni W, Landthaler R, Kohls A, Rezek D, Noesslet T, Fischer G, Henschen S, Praetz T, Heyl V, Kuhn T, Krauss T, Thomssen C, Hohn A, Tesch H, Mundhenke C, Hein A, Rauh C, Bayer CM, Jacob A, Schmidt K, Belleville E, Hadji P, Brucker SY, Wallwiener D, Kummel S, Beckmann MW, Paepke D. Interest in Integrative Medicine Among Postmenopausal Hormone Receptor-Positive Breast Cancer Patients in the EvAluate-TM Study. Integrative Cancer Therapies 2017;16(2): 165–175.
-
64. Keene MR, Heslop IM, Sabesan SS, Glass BD. Complementary and alternative medicine use in cancer: A systematic review. Complementary Therapies in Clinical Practice 2019;35: 33–47.
-
65. Kalder M, von Georgi R, Kullmer U, Entezami A, Hadji P, Munstedt K. Opinions of gynecologists on unconventional and complementary cancer therapy (UCT). Geburtshilfe und Frauenheilkunde 2001;61(1): 26–30.
-
66. Theobald S, Theobald A, Nagel G. Beratungsbedarf und Beratungsqualität aus der Sicht von Patienten mit Krebs – eine Umfrage bei der 1. Offenen Krebskonferenz 2005 in Berlin. Deutsche Zeitschrift für Onkologie 2005;37(3): 124–128.
-
67. Molassiotis A, Scott JA, Kearney N, Pud D, Magri M, Selvekerova S, Bruyns I, Fernadez-Ortega P, Panteli V, Margulies A, Gudmundsdottir G, Milovics L, Ozden G, Platin N, Patiraki E. Complementary and alternative medicine use in breast cancer patients in Europe. Supportive Care in Cancer 2006;14(3): 260–267.
-
68. McLay JS, Stewart D, George J, Rore C, Heys SD. Complementary and alternative medicines use by Scottish women with breast cancer. What, why and the potential for drug interactions? European Journal of Clinical Pharmacology 2012;68(5): 811–819.
-
69. Can G, Demir M, Aydiner A. Complementary and alternative therapies used by Turkish breast cancer patients undergoing chemotherapy. Breast Care 2012;7(6): 471–475.
-
70. Ludwig WD, Schwabe U. Mistelpräparate. In: Schwabe U, Pfaffrath D (Hrsg.). Arzneiverordnungs-Report 2016, Berlin Heidelberg 2017: 598.
-
71. EUnetHTA. HTA Core Model Version 3.0 for the full assessment of Diagnostic Technologies, Medical and Surgical Interventions, Pharmaceuticals and Screening Technologies. 2016.
-
72. Düwell M, Steigleder K. Bioethik – Zu Geschichte, Bedeutung und Aufgaben. In: Düwell M, Steigleder, K. (Hrsg.). Bioethik. Eine Einführung. Frankfurt a.M. 2003: 12–35.
-
73. Borry P, Schotsmans P, Dierickx K. The birth of the empirical turn in bioethics. Bioethics 2005;19(1):49–71.
-
74. Mertz M. Ethik im Gesundheitswesen. In: Haring R (Hrsg.). Gesundheitswissenschaften. Springer Reference Pflege – Therapie – Gesundheit. 1 2018.
-
75. Teichfischer P, Münstedt K. Zur Definition der Komplementär- und Alternativmedizin (CAM). Forum 2011;26: 12–20.
-
76. Kiene H, Heimpel H, Brinkhaus B, Fscher GC, Girke M, Hahn EG, Hoppe JD, Jütte R, Klitzsch W, Kraft K, Matthiessen PF, Meister P, Michalsen A, Teut M, Willich SN. Ärztliche Professionalität und Komplementärmedizin: Was ist seriöses Therapieren? Deutsches Ärzteblatt 2010;107(12): A548-A550.
-
77. Strech D, Mertz M. Forschungsethische Grundprinzipien. In: Raspe H HA, Strech D, Taupitz J (Hrsg.). Empfehlungen zur Begutachtung klinischer Studien durch Ethik-Kommissionen, Köln 2012: 1–8.
-
78. Beauchamp TL, Childress JF. Principles of Biomedical Ethics. Oxford/New York 2009.
-
79. Emanuel EJ, Wendler D, Grady C. An Ethical Framework for Biomedical Research. In: Emanuel EJ GC, Crouch RA, Lie RK, Miller FG, Wendler D (Hrsg.). The Oxford Textbook of Clinical Research Ethics, Oxford/New York 2008: 123–135.
-
80. Strech D, Marckmann G. Normative Versorgungsforschung. Eine orientierende Einführung in Themen, Methoden und Status quo in Deutschland. Gesundheits- und Sozialpolitik. Zeitschrift für das gesamte Gesundheitswesen 2012;02: 8–15.
-
81. Mertz M, Strech D, Kahrass H. Ethische Aspekte der Prävention von Übergewicht und Adipositas im Kindes- und Jugendalter: Ausgewählte Ergebnisse einer systematischen qualitativen Übersichtsarbeit. In: Dadaczynski K, Quilling E, Walter U (Hrsg.). Übergewichtsprävention im Kindes- und Jugendalter. Grundlagen, Strategien und Interventionskonzepte in Lebenswelten, Bern 2018: 245–256.
-
82. Horneber M, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe Therapy in Oncology. Cochrane Database of Systematic Reviews 2008(2).
-
83. Higgins JPT, Green SH. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. 2011.
-
84. York CfradUo. Systematic Reviews. CRD’s guidance for undertaking reviews in health care. 2009.
-
85. Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L, Consortium. ftANS. AGREE II: Advancing guideline development, reporting and evaluation in healthcare. Canadian Medical Association Journal 2010(182): E839-842.
-
86. Heumann C, Schomaker M, Shalabh. Introduction to Statistics and Data Analysis – With Exercises, Solutions and Applications in R. Heidelberg 2016.
-
87. Husereau D, Drummond M, Petrou S, Carswell C, Moher D, Greenberg D, Augustovski F, Briggs AH, Mauskopf J, Loder E. Consolidated Health Economic Evaluation Reporting Standards (CHEERS)–explanation and elaboration: a report of the ISPOR Health Economic Evaluation Publication Guidelines Good Reporting Practices Task Force. Value in Health 2013;16(2): 231–250.
-
88. Siebert U. When should decision-analytic modeling be used in the economic evaluation of health care? The European Journal of Health Economics 2003;4: 143–150.
-
89. Caro JJ, Briggs AH, Siebert U, Kuntz KM, Force I‑SMGRPT. Modeling good research practices-overview: a report of the ISPOR-SMDM Modeling Good Research Practices Task Force–1. Value in Health 2012;15(6): 796–803.
-
90. Briggs A, Weinstein MC, Fenwick EA, Karnon J, Sculpher MJ, Paltiel AD, Force oBotI-SMGRPT. Model Parameter Estimation and Uncertainty: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force‑6. Medical Decision Making 2012;32: 722–732.
-
91. Eddy D, Hollingworth W, Caro J, Tsevat J, McDonald KM, Wong J, on Behalf of the ISPOR-SMDM Modeling Good Research Practices Task Force. Model Transparency and Validation: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force‑7. Value in Health 2012;15: 843–850.
-
92. Karnon J, Stahl J, Brennan A, Caro JJ, Javier M, Moeller J, Force oBotI-SMGRPT. Modeling using Discrete Event Simulation: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force‑4. Value in Health 2012;15: 821–827.
-
93. Pitman R, Fisman D, Zaric GS, Postma M, Kretzschmar M, Edmunds J, Brisson M, on Behalf of the ISPOR-SMDM Modeling Good Research Practices Task Force. Dynamic Transmission Modeling: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force‑5. Value in Health 2012;15: 828–834.
-
94. Roberts M, Russell LB, Paltiel AD, Chambers M, McEwan P, Krahn M, on Behalf of the ISPOR-SMDM Modeling Good Research Practices Task Force. Conceptualizing a Model: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force ‑2. Value in Health 2012;15: 804–811.
-
95. Siebert U, Alagoz O, Bayoumi AM, Jahn B, Owens DK, Cohen DJ, Kuntz KM. State-Transition Modeling: A Report of the ISPOR-SMDM Modeling Good Research Practices Task Force‑3. Value in Health 2012;15: 812–820.
-
96. Siebert U, Behrend C, Mühlberger N, Wasem J, Greiner W, v.d.Schulenburg J, Welte R, Leidl R. Entwicklung eines Kriterienkataloges zur Beschreibung und Bewertung ökonomischer Evaluationsstudien in Deutschland. 1999.
-
97. Lewin S, Booth A, Glenton C, Munthe-Kaas H, Rashidian A, Wainwright M, Bohren MA, Tuncalp O, Colvin CJ, Garside R, Carlsen B, Langlois EV, Noyes J. Applying GRADE-CERQual to qualitative evidence synthesis findings: introduction to the series. Implementation Science 2018;13(Suppl 1): 2.
-
98. Noyes J, Booth A, Cargo M, Flemming K, Harden A, Harris J, Garside R, Hannes K, Pantoja T, Thomas J. Chapter 21: Qualitative research and Cochrane reviews. Draft version (1 October) for inclusion in: Higgins J, Thomas J, Chandler J, Cumpston M, Li T, Page M, Welch V (Hrsg.). Cochrane Handbook for Systematic Reviews of Interventions, London 2018.
-
99. Noyes J, Booth A, Cargo M, Flemming K, Garside R, Hannes K, Harden A, Harris J, Lewin S, Pantoja T, Thomas J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 1: introduction. Journal of Clinical Epidemiology 2018;97: 35–38.
-
100. Thomas J, Harden A. Methods for the thematic synthesis of qualitative research in systematic reviews. BMC Med Res Methodol 2008;8: 45.
-
101. CADTH. Grey Matters: a practical tool for searching health-related grey literature. CADTH Information Services 2015.
-
102. MAXQDA. Software for qualitative data analysis. VERBI Software – Consult – Sozialforschung GmbH, Berlin, Germany 1989–2018.
-
103. Programme CAS. CASP Qualitative Checklist 2018 casp-uk.net/images/checklist/documents/CASP-Qualitative-Studies-Checklist/CASP-Qualitative-Checklist-2018_fillable_form.pdf (25.02.2019).
-
104. Programme CAS. CASP Cohort Study Checklist 2018 casp-uk.net/images/checklist/documents/CASP-Qualitative-Studies-Checklist/CASP-Qualitative-Checklist-2018_fillable_form.pdf (25.02.2019).
-
105. Noyes J, Booth A, Flemming K, Garside R, Harden A, Lewin S, Pantoja T, Hannes K, Cargo M, Thomas J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 3: methods for assessing methodological limitations, data extraction and synthesis, and confidence in synthesized qualitative findings. Journal of Clinical Epidemiology 2018;97: 49–58.
-
106. Cargo M, Harris J, Pantoja T, Booth A, Harden A, Hannes K, Thomas J, Flemming K, Garside R, Noyes J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 4: methods for assessing evidence on intervention implementation. Journal of Clinical Epidemiology 2018;97: 59–69.
-
107. Harris JL, Booth A, Cargo M, Hannes K, Harden A, Flemming K, Garside R, Pantoja T, Thomas J, Noyes J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 2: methods for question formulation, searching, and protocol development for qualitative evidence synthesis. Journal of Clinical Epidemiology 2018;97: 39–48.
-
108. Harden A, Thomas J, Cargo M, Harris J, Pantoja T, Flemming K, Booth A, Garside R, Hannes K, Noyes J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 5: methods for integrating qualitative and implementation evidence within intervention effectiveness reviews. Journal of Clinical Epidemiology 2018;97: 70–78.
-
109. Flemming K, Booth A, Hannes K, Cargo M, Noyes J. Cochrane Qualitative and Implementation Methods Group guidance series-paper 6: reporting guidelines for qualitative, implementation, and process evaluation evidence syntheses. Journal of Clinical Epidemiology 2018;97: 79–85.
-
110. Barnett-Page E, Thomas J. Methods for the synthesis of qualitative research: a critical review. BMC Med Res Methodol 2009;9: 59.
-
111. Mayring P. Qualitative Inhaltsanalyse: Grundlagen und Techniken. Weinheim und Basel 2010.
-
112. Mayring P. Qualitative Inhaltsanalyse: Grundlagen und Techniken. 2015.
-
113. Strech D, Mertz M, Knüppel H, Neitzke G, Schmidhuber M. The full spectrum of ethical issues in dementia care: systematic qualitative review. The British Journal of Psychiatry 2013;202: 400406.
-
114. Kahrass H, Strech D, Mertz M. The Full Spectrum of Clinical Ethical Issues in Kidney Failure. Findings of a Systematic Qualitative Review. PLoS One 2016;11(3): e0149357.
-
115. Seitzer F, Kahrass H, Neitzke G, Strech D. The full spectrum of ethical issues in the care of patients with ALS: a systematic qualitative review. Journal of Neurology 2016;263(2): 201–209.
-
116. Hanf V, Schutz F, Liedtke C, Thill M. AGO Recommendations for the Diagnosis and Treatment of Patients with Early Breast Cancer: Update 2015 on behalf of the AGO Breast Committee. Breast Care 2015;10(3): 189–197.
-
117. IQWiG. Systematic guideline search and appraisal, as well as extraction of new and relevant recommendations for the DMP Breast cancer. 2008.
-
118. Thomssen C. AGO recommendations for the diagnosis and therapy of breast cancer. Breast Care 2007;2(4): 244–250.
-
119. Arbeitsgemeinschaft Gynäkologische Onkologie, Kommission Mamma in der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. Diagnostik und Therapie von Patientinnen mit primärem und metastasiertem Brustkrebs. 2018.
-
120. Stangl S, Follmann M, Wöckel A. Leitlinienreport zur S3-Leitlinie Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. 2019.
-
121. Greenlee H, Balneaves LG, Carlson LE, Cohen M, Deng G, Hershman D, Mumber M, Perlmutter J, Seely D, Sen A, Zick SM, Tripathy D, Society for Integrative O. Clinical practice guidelines on the use of integrative therapies as supportive care in patients treated for breast cancer. Journal of the National Cancer Institute Monographs 2014;2014(50): 346–358.
-
122. Kalder M, Muller T, Fischer D, Muller A, Bader W, Beckmann MW, Brucker C, Hack CC, Hanf V, Hasenburg A, Hein A, Jud S, Kiechle M, Klein E, Paepke D, Rotmann A, Schutz F, Dobos G, Voiss P, Kummel S. A Review of Integrative Medicine in Gynaecological Oncology. Geburtshilfe Und Frauenheilkunde 2016;76(2): 150–155.
-
123. Kienle GS, Mussler M, Fuchs D, Kiene H. Intravenous Mistletoe Treatment in Integrative Cancer Care: A Qualitative Study Exploring the Procedures, Concepts, and Observations of Expert Doctors. Evidence-based Complementary and Alternative Medicine 2016;2016: 4628287.
-
124. Kienle G, Kiene H. Verträglichkeit, Nebenwirkungen, Überempfindlichkeit, Toxizität. Die Mistel in der Onkologie. Fakten und konzeptionelle Grundlagen, Stuttgart, New York 2003: 591-ff.
-
125. Auerbach L, Dostal V, Vaclavik-Fleck I, Kubista E, Rosenberger A, Rieger S. Signifikant höherer Anteil aktivierter NK-Zellen durch additive Misteltherapie bei chemotherapierten Mamma-Ca-Patientinnen in einer prospektiven randomisierten doppelblinden Studie. In: Scheer R, Bauer R, Becker H, Fintelmann V, Kemper F, Schilcher H (Hrsg.). Fortschritte in der Misteltherapie, Essen 2005: 543–554.
-
126. Heiny BM, Beuth J. Mistletoe extract standardized for the galactoside-specific lectin (ML‑1) induces beta-endorphin release and immunopotentiation in breast cancer patients. Anticancer research 1994;14(3B): 1339–1342.
-
127. Hutt N, Kopferschmitt-Kubler M, Cabalion J, et al. Anaphylactic reactions after therapeutic injection of mistletoe (Viscum album L.). Allergologia Et Immunopathologia 2001;29(5): 201–203.
-
128. Beuth J, Schneider B, Schierholz JM. Impact of complementary treatment of breast cancer patients with standardized mistletoe extract during aftercare: a controlled multicenter comparative epidemiological cohort study. Anticancer research 2008;28(1B): 523–527.
-
129. Schumacher K, Schneider B, Reich G, Stiefel T, Stoll G, Bock PR, Hanisch J, Beuth J. Postoperative komplementäre Therapie des primären Mammakarzinoms mit lektinnormiertem Mistelextrakt – eine epidemiologische, kontrollierte, multizentrische retrolektive Kohortenstudie. Deutsche Zeitschrift für Onkologie 2002;34(3): 106–114.
-
130. Klose C, Jensen K, Herzig M, Mansmann U. Multicentric, randomized, open, prospective clinical trial for the investigation of efficacy and tolerance and adverse drug reactions of HELIXOR® A in comparison to Lentinan in patients with non small cell lung cancer, breast cancer or ovarian cancer. Forschungsbericht der Abteilung Medizinische Biometrie 2003;45: 1–121.
-
131. von Hagens C, Loewe-Mesch A, Kuehn JJ, Abel U, Gerhard I. Prospektive kontrollierte nicht randomisierte Machbarkeits-Studie zu einer postoperativen simultanen Mistel-/Chemotherapie bei Patientinnen mit Mammakarzinom – Ergebnisse zu Rekrutierbarkeit, Immunparametern, Lebensqualität und Verträglichkeit. In: Scheer R, Bauer R, Becker H, Fintelmann V, Kemper F, Schilcher H (Hrsg.). Fortschritte in der Misteltherapie, Essen 2005: 567–578.
-
132. Ernst E, Schmidt K, Steuer-Vogt MK. Mistletoe for cancer? International Journal of Cancer 2003;107(2): 262–267.
-
133. Kienle G, Glockmann A, Schink M, Kiene H. Viscum album L. extracts in breast and gynaecological cancers: a systematic review of clinical and preclinical research (Structured abstract). Journal of Experimental & Clinical Cancer Research 2009;28:79(2).
-
134. Kienle GS, Berrino F, Büssing A, Portalupi E, Rosenzweig S, Kiene H. Mistletoe in cancer: a systematic review on controlled clinical trials (Structured abstract). European Journal of Medical Research 2003;8(3): 109–119.
-
135. Ostermann T, Raak C, Büssing A. Survival of cancer patients treated with mistletoe extract (Iscador): a systematic literature review. BMC Cancer 2009;9: 451.
-
136. Shneerson C, Taskila T, Gale N, Greenfield S, Chen Y‑F. The effect of complementary and alternative medicine on the quality of life of cancer survivors: A systematic review and meta-analyses. Complementary Therapies in Medicine 2013;21(4): 417–429.
-
137. Sood A, Barton DL, Bauer BA, Loprinzi CL. A critical review of complementary therapies for cancer-related fatigue. Integr Cancer Ther 2007;6(1): 8–13.
-
138. Kienle GS, Kiene H. Influence of Viscum album L (European Mistletoe) Extracts on Quality of Life in Cancer Patients: A Systematic Review of Controlled Clinical Studies. Integrative Cancer Therapies 2010;9(2): 142–157.
-
139. Semiglazov VF, Stepula VV, Dudov A, Lehmacher W, Mengs U. The standardised mistletoe extract PS76A2 improves QoL in patients with breast cancer receiving adjuvant CMF chemotherapy: a randomised, placebo-controlled, double-blind, multicentre clinical trial. Anticancer Research 2004;24(2c): 1293–1302.
-
140. Semiglazov VF, Stepula VV, Dudov A, Schnitker J, Mengs U. Quality of life is improved in breast cancer patients by Standardised Mistletoe Extract PS76A2 during chemotherapy and follow-up: a randomised, placebo-controlled, double-blind, multicentre clinical trial. Anticancer Research 2006;26(2b): 1519–1529.
-
141. Tröger W, Jezdic S, Zdrale Z, Tisma N, Hamre H, Matijasevic M. Quality of life and neutropenia in patients with early stage breast cancer: A randomized pilot study comparing additional treatment with mistletoe extract to chemotherapy alone. Breast Cancer: Basic and Clinical Research 2009;3(1): 35–45.
-
142. Tröger W, Zdrale Z, Stankovic N, Matijasevic M. Five-year follow-up of patients with early stage breast cancer after a randomized study comparing additional treatment with Viscum album (L.) extract to chemotherapy alone. Breast Cancer: Basic and Clinical Research 2012;6(1): 173–180.
-
143. Tröger W, Zdrale Z, Tisma N, Matijasevic M. Additional therapy with a mistletoe product during adjuvant chemotherapy of breast cancer patients improves quality of life: An open randomized clinical pilot trial. Evidence-based Complementary and Alternative Medicine 2014.
-
144. Tröger W, Zdrale Z, Stankovic N. Fünf-Jahres-Nachbeobachtung von Patientinnen mit Brustkrebs nach einer randomisierten Studie mit Viscum album (L.) Extrakt. Deutsche Zeitschrift für Onkologie 2016;48(3): 105–110.
-
145. Bock PR, Friedel WE, Hanisch J, Karasmann M, Schneider B. Wirksamkeit und Sicherheit der komplementären Langzeitbehandlung mit einem standardisierten Extrakt aus Europäischer Mistel (Viscum album L.) zusätzlich zur konventionellen adjuvanten onkologischen Therapie bei primärem, nicht metastasiertem Mammakarzinom. Arzneimittel-Forschung/Drug Research 2004;54(8): 456–466.
-
146. Bock PR, Friedel WE, Hanisch J, Karasmann M, Schneider B. Retrolective, comparative, epidemiological cohort study with parallel groups design for evaluation of efficacy and safety of drugs with ‘well-established use’: Experience with the long-term treatment using the European mistletoe extract (Viscum album L.) in addition to conventional oncological therapy in primary, non-metastatic breast carcinoma. Forschende Komplementärmedizin und Klassische Naturheilkunde 2004;11(SUPPL. 1): 23–29.
-
147. Eisenbraun J, Scheer R, Kröz M, Schad F, Huber R. Quality of life in breast cancer patients during chemotherapy and concurrent therapy with a mistletoe extract. Phytomedicine 2011;18(2/3): 151–157.
-
148. Loewe-Mesch A, Kuehn JJ, Borho K, Abel U, Bauer C, Gerhard I, Schneeweiss A, Sohn C, Strowitzki T, C VH. Adjuvante simultane Mistel-/Chemotherapie bei Mammakarzinom – Einfluss auf Immunparameter, Lebensqualität und Verträglichkeit. Forschende Komplementärmedizin 2008;15(1): 22–30.
-
149. Schumacher K, Schneider B, Reich G, Stiefel T, Stoll G, Bock PR, Hanisch J, Beuth J. Influence of postoperative complementary treatment with lectin-standardized mistletoe extract on breast cancer patients. A controlled epidemiological multicentric retrolective cohort study. Anticancer Research 2003;23(6D): 5081–5087.
-
150. Steele ML, Axtner J, Happe A, Kröz M, Matthes H, Schad F. Adverse Drug Reactions and Expected Effects to Therapy with Subcutaneous Mistletoe Extracts (Viscum album L.) in Cancer Patients. Evidence-based Complementary and Alternative Medicine 2014;2014: 724258.
-
151. Mansky PJ, Wallerstedt DB, Sannes TS, Stagl J, Johnson LL, Blackman MR, Grem JL, Swain SM, Monahan BP. Nccam/nci phase 1 study of mistletoe extract and gemcitabine in patients with advanced solid tumors. Evidence-based Complementary and Alternative Medicine 2013;2013 (no pagination)(964592).
-
152. Schöffski O, Emmert M. Vergleichende Kostenanalyse der Nachsorge beim Mammakarzinom unter besonderer Berücksichtigung von Mistelpräparaten. Deutsche Zeitschrift für Onkologie 2009;41(3): 119–125.
-
153. Standish LJ, Dowd F, Sweet E, Dale L, Weaver M, Osborne B, Andersen MR. Breast Cancer Integrative Oncology Care and Its Costs. Integrative Cancer Therapies 2017;16(1): 85–95.
-
154. Stauder G, Bock PR. Fermented mistletoe (Viscum album L.) extracts as supportive treatment in cancer patients-Results of four controlled pharmaco-epidemiological cohort study. European Journal of Integrative Medicine 2010;2(4): 180.
-
155. Kienle GS, Albonico HU, Baars E, Hamre HJ, Zimmermann P, Kiene H. Anthroposophic medicine: an integrative medical system originating in europe. Global Advances in Health and Medicine 2013;2(6): 20–31.
-
156. Anonymous. Preparations from mistletoe extracts, vitamins and trace elements are very popular among women with breast cancer. [German]. Ärztezeitschrift für Naturheilverfahren und Regulationsmedizin 2004;45(3): 134.
-
157. Arman M, Rehnsfeldt A, Lindholm L, Hamrin E, Eriksson K. Suffering related to health care: a study of breast cancer patients’ experiences. International Journal of Nursing Practice 2004;10(6): 248–256.
-
158. Arslan D, Tural D, Akar E. Herbal Administration and Interaction of Cancer Treatment. Journal of Palliative Medicine 2013;16(11): 1466–1476.
-
159. Ben-Arye E, Schiff E, Steiner M, Keshet Y, Lavie O. Attitudes of patients with gynecological and breast cancer toward integration of complementary medicine in cancer care. International Journal of Gynecological Cancer 2012;22(1): 146–153.
-
160. Bishop FL, Yardley L. Constructing agency in treatment decisions: negotiating responsibility in cancer. Health (London) 2004;8(4): 465–482.
-
161. Broom A. ‘I’d forgotten about me in all of this’: Discourses of self-healing, positivity and vulnerability in cancer patients’ experiences of complementary and alternative medicine. Journal of Sociology 2009;45(1): 71–87.
-
162. Cohen L, Cohen MH, Kirkwood C, Russell NC. Discussing complementary therapies in an oncology setting. Journal of the Society for Integrative Oncology 2007;5(1): 18–24.
-
163. Conrad AC, Muenstedt K, Micke O, Prott FJ, Muecke R, Huebner J. Attitudes of members of the German Society for Palliative Medicine toward complementary and alternative medicine for cancer patients. Journal of Cancer Research and Clinical Oncology 2014;140(7): 1229–1237.
-
164. Dahlhaus A, Siebenhofer A, Guethlin C. Complementary Medicine for Cancer Patients in General Practice: Qualitative Interviews with German General Practitioners. Complementary Medicine Research 2015;22(1): 36–41.
-
165. Davis EL, Oh B, Butow PN, Mullan BA, Clarke S. Cancer patient disclosure and patient-doctor communication of complementary and alternative medicine use: a systematic review. Oncologist 2012;17(11): 1475–1481.
-
166. Domnick M, Domnick M, Wiebelitz KR, Beer AM. Evaluation of the Effectiveness of a Multimodal Complementary Medicine Program for Improving the Quality of Life of Cancer Patients during Adjuvant Radiotherapy and/or Chemotherapy or Outpatient Aftercare. Oncology 2017;93(2): 83–91.
-
167. Ebel MD, Rudolph I, Keinki C, Hoppe A, Muecke R, Micke O, Muenstedt K, Huebner J. Perception of cancer patients of their disease, self-efficacy and locus of control and usage of complementary and alternative medicine. Journal of Cancer Research and Clinical Oncology 2015;141(8): 1449–1455.
-
168. Ehmann M, Harter M, Rambach R, Winkler E. Onkologische Therapien – was sind patientenrelevante Endpunkte? Onkologie 2013;36 Suppl 6: 5–8.
-
169. Eliott JA, Kealey CP, Olver IN. (Using) complementary and alternative medicine: the perceptions of palliative patients with cancer. Journal of Palliative Medicine 2008;11(1): 58–67.
-
170. Filshie J, Rubens CNJ. Complementary and alternative medicine. Anesthesiology Clinics of North America 2006;24(1): 81–111.
-
171. Garnett M. Sustaining the cocoon: the emotional inoculation produced by complementary therapies in palliative care. European Journal of Cancer Care 2003;12(2): 129–136.
-
172. Ge J, Fishman J, Vapiwala N, Li SQ, Desai K, Xie SX, Mao JJ. Patient-physician communication about complementary and alternative medicine in a radiation oncology setting. International Journal of Radiation Oncology, Biology, Physics 2013;85(1): e1‑6.
-
173. Gillett J, Ientile C, Hiscock J, Plank A, Martin JM. Complementary and alternative medicine use in radiotherapy: what are patients using? Journal of Alternative and Complementary Medicine 2012;18(11): 1014–1020.
-
174. Heimpel H, Drings P, Gaedicke G, Girke M, Ludwig WD, Bamberg M. Cancer treatment 2008: scientifically-based procedures and methods with controversial effectiveness. Onkologe 2009;15(1): 85–94.
-
175. Henf A, Wesselmann S, Huthmann D, Muenstedt K, Huebner J, J. ObotWGPaIOotGCS. Complementary and Alternative Medicine in German Cancer Centers. Oncology Research and Treatment 2014;37: 390–394.
-
176. Hinkka H, Kosunen E, Lammi UK, Metsanoja R, Kellokumpu-Lehtinen P. Attitudes to terminal patients’ unorthodox therapy: Finnish doctors’ responses to a case scenario. Supportive Care in Cancer 2004;12(2): 132–136.
-
177. Hübner J, Hanf V. Commonly used methods of complementary medicine in the treatment of breast cancer. Breast Care 2013;8(5): 341–347.
-
178. Hübner J, Muenstedt K, Mücke R, Micke O, Stoll C, Kleeberg UR, Büntzel J, Dennert G, Prott FJ, Prio, Akte. Counseling cancer patients on complementary and alternative medicine. Background, theory, and implementation of nationwide counseling facilities. Strahlentherapie und Onkologie 2013;189(8): 613–617.
-
179. Hübner J, Ebel M, Münstedt K, Micke O, Prott FJ, Mücke R, Hoppe A. A lecture program on complementary and alternative medicine for cancer patients–evaluation of the pilot phase. Journal of Cancer Education 2015;30(2): 340–343.
-
180. Hübner J, Micke O, Mücke R, Büntzel J, Prott FJ, Kleeberg U, Senf B, Münstedt K. User rate of complementary and alternative medicine (CAM) of patients visiting a counseling facility for CAM of a German comprehensive cancer center. Anticancer Research 2014;34(2): 943–948.
-
181. Hübner J, Senf B, Micke O, Mücke R, Stoll C, Prott FJ, Münstedt K, Dennert G, working group P, Integrative Oncology of the German Cancer S. Online information on complementary and alternative medicine for cancer patients: evidence-based recommendations. Onkologie 2013;36(5): 273–278.
-
182. Klocker JG, Klocker-Kaiser U, Schwaninger M. Truth in the relationship between cancer patient and physician. Annals of the New York Academy of Sciences 1997;809: 56–65.
-
183. Koehl B, Muenstedt K, Micke O, Muecke R, Buentzel J, Stoll C, Prott FJ, Dennert G, Senf B, Huebner J. Survey of German non-medical practitioners regarding complementary and alternative medicine in oncology. Oncology Research and Treatment 2014;37(1–2): 49–53.
-
184. Mackenzie G, Parkinson M, Lakhani A, Pannekoek H. Issues that influence patient/physician discussion of complementary therapies. Patient Education and Counseling 1999;38(2): 155159.
-
185. Molassiotis A, Browall M, Milovics L, Panteli V, Patiraki E, Fernandez-Ortega P. Complementary and alternative medicine use in patients with gynecological cancers in Europe. International Journal of Gynecological Cancer 2006;16 Suppl 1: 219–224.
-
186. Molassiotis A, Fernadez-Ortega P, Pud D, Ozden G, Scott JA, Panteli V, Margulies A, Browall M, Magri M, Selvekerova S, Madsen E, Milovics L, Bruyns I, Gudmundsdottir G, Hummerston S, Ahmad AM, Platin N, Kearney N, Patiraki E. Use of complementary and alternative medicine in cancer patients: a European survey. Annals of Oncology 2005;16(4): 655–663.
-
187. Munstedt K, Vogt T, Rabanus ME, Hubner J. Wishes and beliefs of cancer patients regarding counseling on integrative medicine. Breast Care 2014;9(6): 416–420.
-
188. Navo MA, Phan J, Vaughan C, Palmer JL, Michaud L, Jones KL, Bodurka DC, Basen-Engquist K, Hortobagyi GN, Kavanagh JJ, Smith JA. An assessment of the utilization of complementary and alternative medication in women with gynecologic or breast malignancies. Journal of Clinical Oncology 2004;22(4): 671–677.
-
189. Ohlen J, Balneaves LG, Bottorff JL, Brazier AS. The influence of significant others in complementary and alternative medicine decisions by cancer patients. Social Science & Medicine 2006;63(6): 1625–1636.
-
190. Oneschuk D, Hanson J, Bruera E. Complementary therapy use: a survey of community- and hospital-based patients with advanced cancer. Palliative Medicine 2000;14(5): 432–434.
-
191. Ott IM, Muenstedt K, Micke O, Muecke R, Prott FJ, Senf B, Paradies K, Aerts E, Huebner J. Attitude of oncology / haematology nurses from German speaking countries towards complementary and alternative medicine. Trace Elements and Electrolytes 2015;32(2): 74–80.
-
192. Pederson SN, Emmers-Sommer TM. “I’m not trying to be cured, so there’s not much he can do for me”: hospice patients’ constructions of hospice’s holistic care approach in a biomedical culture. Death Studies 2012;36(5): 419–446.
-
193. Raszeja VM, Jordens CF, Kerridge IH. Survey of practices and policies relating to the use of complementary and alternative medicines and therapies in New South Wales cancer services. Internal Medicine Journal 2013;43(1): 84–88.
-
194. Rausch SM, Winegardner F, Kruk KM, Phatak V, Wahner-Roedler DL, Bauer B, Vincent A. Complementary and alternative medicine: use and disclosure in radiation oncology community practice. Supportive Care in Cancer 2011;19(4): 521–529.
-
195. Richardson MA, Sanders T, Palmer JL, Greisinger A, Singletary SE. Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology. Journal of Clinical Oncology 2000;18(13): 2505–2514.
-
196. Ritvo P, Irvine J, Katz J, Matthew A, Sacamano J, Shaw BF. The patient’s motivation in seeking complementary therapies. Patient Education and Counseling 1999;38(2): 161–165.
-
197. Rogers M, Todd C. Information exchange in oncology outpatient clinics: source, valence and uncertainty. Psycho-Oncology 2002;11(4): 336–345.
-
198. Salamonsen A. Doctor-patient communication and cancer patients’ choice of alternative therapies as supplement or alternative to conventional care. Scandinavian Journal of Caring Sciences 2013;27(1): 70–76.
-
199. Sanderson CR, Koczwara B, Currow DC. The “therapeutic footprint” of medical, complementary and alternative therapies and a doctor’s duty of care. The Medical Journal of Australia 2006;185(7): 373–376.
-
200. Savas P, Robertson A, Beatty L, Hookings E, McGee M, Marker J, McCaleb B, Bowen J, Richards A, Koczwara B. Patient preferences on the integration of complementary therapy with conventional cancer care. Asia-Pacific Journal of Clinical Oncology 2016;12(2): e311-318.
-
201. Saxe GA, Madlensky L, Kealey S, Wu DP, Freeman KL, Pierce JP. Disclosure to physicians of CAM use by breast cancer patients: findings from the Women’s Healthy Eating and Living Study. Integrative Cancer Therapies 2008;7(3): 122–129.
-
202. Smithson J, Britten N, Paterson C, Lewith G, Evans M. The experience of using complementary therapies after a diagnosis of cancer: A qualitative synthesis. Health: 2012;16(1): 19–39.
-
203. Strait L, Furnham A. The Effects of Modern Health Worries and Psychological Distress on Complementary Medicine Use by Breast Cancer Patients. Journal of Clinical Research and Bioethics 2012;3(1).
-
204. Trimborn A, Senf B, Muenstedt K, Buentzel J, Micke O, Muecke R, Prott FJ, Wicker S, Huebner J, Working Group P, Integrative Oncology of the German Cancer S. Attitude of employees of a university clinic to complementary and alternative medicine in oncology. Annals of Oncology 2013;24(10): 2641–2645.
-
205. Truant T, Bottorff JL. Decision making related to complementary therapies: a process of regaining control. Patient Education and Counseling 1999;38(2): 131–142.
-
206. Verhoef MJ, Boon HS, Page SA. Talking to cancer patients about complementary therapies: is it the physician’s responsibility? Current Oncology 2008;15 Suppl 2: 88–93.
-
207. Witt C. Wünsche und Überzeugungen von Krebspatienten im Hinblick auf Beratung zu ganzheitlicher Medizin. Karger Kompass Onkologie 2015;2(1): 36–37.
-
208. Arman M, Backman M. A longitudinal study on women’s experiences of life with breast cancer in anthroposophical (complementary) and conventional care. European Journal of Cancer Care 2007;16(5): 444–450.
-
209. Morais S, Costa AR, Lopes-Conceicao L, Brandao M, Borges M, Araujo N, Dias T, Fontes F, Pereira S, Lunet N. Treatment and Other Healthcare Use of Breast Cancer Patients With a Previous Cancer Diagnosis. Anticancer Research 2020;40(2): 1041–1048.
-
210. Pampallona S, Von Rohr E, Van Wegberg B, Bernhard J, Helwig S, Heusser P, Huerny C, Schaad R, Cerny T. Socio-demographic and medical characteristics of advanced cancer patients using conventional or complementary medicine. Onkologie 2002;25(2): 165–170.
-
211. Von Rohr E, Pampallona S, van Wegberg B, Cerny T, Hürny C, Bernhard J, Helwig S, Heusser P. Attitudes and beliefs towards disease and treatment in patients with advanced cancer using anthroposophical medicine. Onkologie 2000;23: 558–563.
-
212. Bruns F, Glatzel M, Schonekaes K, Riesenbeck D, Mucke R, Buntzel J, Micke P, Schafer U, Kisters K, Micke O. Complementary and alternative medicine experience in radiation oncology patients: First results of a multi-center approach. Trace Elements and Electrolytes 2006;23(4): 318–325.
-
213. Buntzel J, Mucke R, Bruns F, Micke O. Complementary and alternative medicine in cancer patients. European Journal of Oncology Pharmacy 2008;2(2): 12–13.
-
214. Kienle GS, Mussler M, Fuchs D, Kiene H. Individualized Integrative Cancer Care in Anthroposophic Medicine: A Qualitative Study of the Concepts and Procedures of Expert Doctors. Integrative Cancer Therapies 2016;15(4): 478–494.
-
215. Konig J, Geschwill K, Lang A, Tauchert FK, Hofheinz RD, Kripp M. Use of Complementary and Alternative Medicine in Cancer Patients: A Prospective Questionnaire-Based Study in an Oncological Outpatient Clinic. Oncology Research and Treatment 2016;39(5): 260–265.
-
216. Micke O, Bruns F, Glatzel M, Schonekaes K, Micke P, Mucke R, Buntzel J. Predictive factors for the use of complementary and alternative medicine (CAM) in radiation oncology. European Journal of Integrative Medicine 2009;1(1): 22–30.
-
217. Nicolaisen-Murmann K, Thiel F, Mohrmann S, Grunewald E, Ackermann S, Bender HG, Beckmann MW, Fasching PA. Komplementäre und alternative Methoden (CAM) bei Frauen mit Genital- oder Mammakarzinom: Multizentrische Studie zur Prävalenz und Motivation.
Geburtshilfe und Frauenheilkunde 2005;65(2): 178–185.
-
218. van der Weg F, Streuli RA. Use of alternative medicine by patients with cancer in a rural area of Switzerland. Swiss Medical Weekly 2003;133(15–16): 233–240.
-
219. Carlsson M, Arman M, Backman M, Flatters U, Hatschek T, Hamrin E. A Five-year Follow-up of Quality of Life in Women with Breast Cancer in Anthroposophic and Conventional Care. Evidence-based Complementary and Alternative Medicine 2006;3(4): 523–531.
-
220. Heusser P, Braun SB, Bertschy M, Burkhard R, Ziegler R, Helwig S, van Wegberg B, Cerny T. Palliative in-patient cancer treatment in an anthroposophic hospital: II. Quality of life during and after stationary treatment, and subjective treatment benefits. Forschende Komplementärmedizin 2006;13(3): 156–166.
-
221. Heusser P, Braun SB, Ziegler R, Bertschy M, Helwig S, van Wegberg B, Cerny T. Palliative inpatient cancer treatment in an anthroposophic hospital: I. Treatment patterns and compliance with anthroposophic medicine. Forschende Komplementärmedizin 2006;13(2): 94–100.
-
222. Witt C. Onkologen sollten über die Misteltherapie informiert sein. Karger Kompass Onkologie 2017;4: 20–21
-
223. Walach H, Heusser P. Effektiv oder nicht? Entscheiden Sie selbst! – Die PEK-HTA-Berichte. Forschende Komplementärmedizin 2006;13 Supplement 2: 2–3.
-
224. Paepke D, Paepke S, Bronger H, Ludwig L, Grose Lackmann K, Ettl J, Schmalfeldt B, Kiechle M. Use of complementary naturopathic therapies in breast cancer patient care-single-center experiences from the interdisciplinary breast center of the technical university Munich, Germany. European Journal of Cancer 2012;48: 155.
-
225. Hok J, Falkenberg T, Tishelman C. Lay perspectives on the use of biologically based therapies in the context of cancer: A qualitative study from Sweden. Journal of Clinical Pharmacy and Therapeutics 2011;36(3): 367–375.
-
226. Theodoropoulos I, Manolopoulos K, Von Georgi R, Bohlmann M, Munstedt K. Physicians and complementary and alternative medicine cancer therapies in Greece: a survey. Journal of Alternative and Complementary Medicine 2005;11(4): 703–708.
-
227. Engdal S, Steinsbekk A, Klepp O, Nilsen OG. Herbal use among cancer patients during palliative or curative chemotherapy treatment in Norway. Supportive Care in Cancer 2008;16(7): 763–769.
-
228. Brandenberger M, Simoes-Wust AP, Rostock M, Rist L, Saller R. An exploratory study on the quality of life and individual coping of cancer patients during mistletoe therapy. Integrative Cancer Therapies 2012;11(2): 90–100.
-
229. Evans M, Bryant S, Huntley AL, Feder G. Cancer Patients’ Experiences of Using Mistletoe (Viscum album): A Qualitative Systematic Review and Synthesis. Journal of Alternative and Complementary Medicine 2016;22(2): 134–144.
-
230. Brandenberger M, Simoes-Wüst AP, Rostock M, Rist L, Saller R. Lebensqualität von Brustkrebspatientinnen während der Misteltherapie: Eine qualitative Studie. Schweizerische Zeitschrift für GanzheitsMedizin 2012;24: 95–100.
-
231. Drozdoff L, Klein E, Kiechle M, Paepke D. Use of biologically-based complementary medicine in breast and gynecological cancer patients during systemic therapy. BMC Complementary Medicine and Therapies 2018;18(1): 259.
-
232. Fasching P, Thiel F, Nicolaisen-Murmann K, Rauh C, Engel J, Lux M, Beckmann M, Bani M. Association of complementary methods with quality of life and life satisfaction in patients with gynecologic and breast malignancies. Supportive Care in Cancer 2007;15(11): 1277–1284.
-
233. Gschwendtner KM, Holmberg C, Weis J. Beweggründe von Krebspatienten für und gegen die Inanspruchnahme der Misteltherapie. Forschende Komplementärmedizin 2016;23(4): 215–222.
-
234. Hübner J, Münstedt K, Prott FJ, Stoll C, Micke O, Büntzel J, Mücke R, Senf B, Prevention PWG. Online Survey of Patients with Breast Cancer on Complementary and Alternative Medicine. Breast Care 2014;9(1): 60–63.
-
235. Klein E, Beckmann MW, Bader W, Brucker C, Dobos G, Fischer D, Hanf V, Hasenburg A, Jud SM, Kalder M, Kiechle M, Kummel S, Muller A, Muller MT, Paepke D, Rotmann AR, Schutz F, Scharl A, Voiss P, Wallwiener M, Witt C, Hack CC. Gynecologic oncologists’ attitudes and practices relating to integrative medicine: results of a nationwide AGO survey. Arch Gynecol Obstet 2017;296(2): 295–301.
-
236. Konitzer M, Doering T, Fischer GC. Metaphorische Aspekte der Misteltherapie im Patientenerleben – eine qualitative Studie. Forschende Komplementärmedizin und Klassische Naturheilkunde 2001;8(2): 68–79.
-
237. Moschen R, Kemmler G, Schweigkofler H, Holzner B, Dunser M, Richter R, Fleischhacker WW, Sperner-Unterweger B. Use of alternative/complementary therapy in breast cancer patients – a psychological perspective. Supportive Care in Cancer 2001;9(4): 267–274.
-
238. Muenstedt K, Entezami A, Kullmer U. Oncologic mistletoe therapy – physicians use and estimated efficiency. Deutsche Medizinische Wochenschrift 2000;125(41): 1222–1226.
-
239. Schad F, Thronicke A, Merkle A, Steele ML, Kröz M, Herbstreit C, Matthes H. Implementation of an Integrative Oncological Concept in the Daily Care of a German Certified Breast Cancer Center. Complementary Medicine Research 2018;25(2): 85–91.
-
240. Schönekaes K, Micke O, Mucke R, Buntzel J, Glatzel M, Bruns F, Kisters K. Anwendung komplementärer/alternativer Therapiemassnahmen bei Patientinnen mit Brustkrebs. Forschende Komplementärmedizin und Klassische Naturheilkunde 2003;10(6): 304–308.
-
241. Tautz E, Momm F, Hasenburg A, Guethlin C. Use of complementary and alternative medicine in breast cancer patients and their experiences: a cross-sectional study. European Journal of Cancer 2012;48(17): 3133–3139.
-
242. Templeton AJ, Thürlimann B, Baumann M, Mark M, Stoll S, Schwizer M, Dietrich D, Ruhstaller T. Cross-sectional study of self-reported physical activity, eating habits and use of complementary medicine in breast cancer survivors. BMC Cancer 2013;13(1): 1–8.
-
243. Ärztegesellschaften IVA. Guidelines for Good Professional Practice in Anthroposophic Medicine 2016 www.ivaa.info/anthroposophic-medicine/quality-control-in-am/guidelines-for-good-professional-practice-in-anthroposophic-medicine/ (11.02.2019).
-
244. NASH. NASH Code of Ethics & Rules of Practice 2016 www.homeopathy.org/about/code-of-ethics/ (11.02.2019).
-
245. GAÄD. Informationen zur Misteltherapie bei Krebs 2016 www.mistel-therapie.de (26.05.2006).
-
246. CAM-Cancer. Mistletoe (Viscum album) 2015 www.cam-cancer.org/The-Summaries/Herbal-products/Mistletoe-Viscum-album (28.05.2016).
-
247. Health NIo. Mistletoe Extracts (PDQ®)-Health Professional Version 2016 https://www.cancerview.ca/cv/portal/Homewww.cancer.gov/about-cancer/treatment/cam/hp/mistletoe-pdq (20.02.2019).
-
248. Shaw D. Homeopathy Is where the harm Is: five unethical effects of funding unscientific remedies. Journal of Medical Ethics 2010;36(3): 130–131.
-
249. Adams KE, Cohen MH, Eisenberg D, Jonsen AR. Ethical considerations of complementary and alternative medical therapies in conventional medical settings. Annals of Internal Medicines 2002;137(8): 660–664.
-
250. Ben-Arye E, Schiff E, Golan O. Ethical issues in integrative oncology. Hematology/Oncology Clinics of North America 2008;22(4): 737–753, x.
-
251. Braun L, Harris J, Katris P, Cain M, Dhillon H, Koczwara B, Olver I, Robotin M. Clinical Oncology Society of Australia position statement on the use of complementary and alternative medicine by cancer patients. Asia-Pacific Journal of Clinical Oncology 2014;10(4): 289–296.
-
252. Cohen MH. Legal and ethical issues relating to use of complementary therapies in pediatric hematology/oncology. Journal of Pediatric Hematology/Oncology 2006;28(3): 190–193.
-
253. Ernst E. The ethics of complementary medicine. Journal of Medical Ethics 1996;22(4): 197–198.
-
254. Fletcher DM. Unconventional cancer treatments: professional, legal, and ethical issues. Oncol Nurs Forum 1992;19(9): 1351–1354.
-
255. Gruner J. Complementary medicine, evidence based medicine and informed consent. Monash Bioethics Review 2000;19(3): 13–27.
-
256. Lynoe N. Ethical and professional aspects of the practice of alternative medicine. Scandinavian Journal of Social Medicine 1992;20(4): 217–225.
-
257. Mertz M. Complementary and alternative medicine: The challenges of ethical justification. Medicine, Health Care and Philosophy 2007;10(3): 329–345.
-
258. Sade RM. Complementary and Alternative Medicine: Foundations, Ethics, and Law. Journal of Law, Medicine & Ethics 2003;31(2): 183–190.
-
259. Shahvisi A. No Understanding, No Consent: The Case Against Alternative Medicine. Bioethics 2016;30(2): 69–76.
-
260. Smith K. Against homeopathy – a utilitarian perspective. Bioethics 2012;26(8): 398–409.
-
261. Sugarman J. Informed Consent, Shared Decision-Making, and Complementary and Alternative Medicine. Journal of Law, Medicine & Ethics 2003;31(2): 247–250.
-
262. Tilburt JC, Miller FG. Responding to medical pluralism in practice: a principled ethical approach. The Journal of the American Board of Family Medicine 2007;20(5): 489–494.
-
263. Torcello L. What’s the Harm? Why the Mainstreaming of Complementary and Alternative Medicine is an Ethical Problem. Ethics in Biology, Engineering and Medicine 2013;4(4): 333344.
-
264. Tyreman S. Values in complementary and alternative medicine. Medicine, Health Care and Philosophy 2011;14(2): 209–217.
-
265. Society for Integrative Oncology. Clinical Practice Guidelines on the Evidence-Based Use of Integrative Therapies During and After Breast Cancer Treatment. 2017.
-
266. The Centre for Evidene-Based Medicine. Oxford Centre for Evidence-based Medicine – Levels of Evidence (March 2009) 2009 www.cebm.net/2009/06/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/ (28.11.2019).
-
267. U.S. Preventive Services Task Force. Grade Definitions 2018 www.uspreventiveservicestaskforce.org/Page/Name/grade-definitions. (10.12.2019).
-
268. Greenlee H, DuPont-Reyes MJ, Balneaves LG, Carlson LE, Cohen MR, Deng G, Johnson JA, Mumber M, Seely D, Zick SM, Boyce LM, Tripathy D. Clinical practice guidelines on the evidence-based use of integrative therapies during and after breast cancer treatment. CA – A Cancer Journal for Clinicians 2017;67(3): 194–232.
-
269. Schoffski P, Riggert S, Fumoleau P, Campone M, Bolte O, Marreaud S, Lacombe D, Baron B, Herold M, Zwierzina H, Wilhelm-Ogunbiyi K, Lentzen H, Twelves C. Phase I trial of intravenous aviscumine (rViscumin) in patients with solid tumors: A study of the European Organization for research and treatment of cancer new drug development group. Annals of Oncology 2004;15(12): 1816–1824.
-
270. Raman S, Ding K, Chow E, Meyer RM, van der Linden YM, Roos D, Hartsell WF, Hoskin P, Wu JSY, Nabid A, Haas R, Wiggenraad R, Babington S, Demas WF, Wilson CF, Wong RKS, Zhu L, Brundage M. Minimal clinically important differences in the EORTC QLQ-C30 and brief pain inventory in patients undergoing re-irradiation for painful bone metastases. Quality of Life Research 2018;27(4): 1089–1098.
-
271. Scott N, Fayers P, Aaronson N, Bottomley A, de Graeff A, Groenvold M, Gundy C, Koller M, Petersen M, Sprangers M, Group obotEQoL. EORTC QLQ-C30 Reference Values. 2008.
-
272. King MT. The interpretation of scores from the EORTC quality of life questionnaire QLQ-C30. Quality of Life Research 1996;5(6): 555–567.
-
273. Osoba D, Rodrigues G, Myles J, Zee B, Pater J. Interpreting the significance of changes in health-related quality-of-life scores. Journal of Clinical Oncology 1998;16(1): 139–144.
-
274. King MT, Cella D, Osoba D, Stockler M, Eton D, Thompson J, Eisenstein A. Meta-analysis provides evidence-based interpretation guidelines for the clinical significance of mean differences for the FACT‑G, a cancer-specific quality of life questionnaire. Patient Related Outcome Measures 2010;1: 119–126.
-
275. Webster K, Cella D, Yost K. The Functional Assessment of Chronic Illness Therapy (FACIT) Measurement System: properties, applications, and interpretation. Health and Quality of Life Outcomes 2003;1: 79.
-
276. Yost KJ, Eton DT. Combining distribution- and anchor-based approaches to determine minimally important differences: the FACIT experience. Evaluation & the Health Professions 2005;28(2): 172–191.
-
277. Butow P, Coates A, Dunn S, Bernhard J, Hiirny C. On the receiving end IV: Validation of quality of life indicators. Annals of Oncology 1991;2: 597–603.
-
278. Coates A, Dillenbeck CF, McNeil DR, Kaye SB, Sims K, Fox RM, Woods RL, Milton GW, Solomon J, Tattersall MH. On the receiving end–II. Linear analogue self-assessment (LASA) in evaluation of aspects of the quality of life of cancer patients receiving therapy. European Journal of Cancer and Clinical Oncology 1983;19(11): 1633–1637.
-
279. Coates A, Gebski V, Signorini D, Murray P, McNeil D, Byrne M, Forbes JF. Prognostic value of quality-of-life scores during chemotherapy for advanced breast cancer. Australian New Zealand Breast Cancer Trials Group. Journal of Clinical Oncology 1992;10(12): 1833–1838.
-
280. Radiation Therapy Oncology Group (RTOG) Foundation Inc. Title of measure: Spitzer Quality of Life Index 2010 https://web.archive.org/web/20150316155306/http://www.rtog.org/LinkClick.aspx?fileticket=GEJNxEAm7VA%3D&tabid=118 (08.01.2020).
-
281. Tröger W. Zusammenhang von Lebensqualität und Neutropenie bei Brustkrebspatientinnen, die alleine mit Chemotherapie oder zusätzlich mit Misteltherapie behandelt wurden. Deutsche Zeitschrift für Onkologie 2011;43(2): 58–67.
-
282. Osoba D, Bezjak A, Brundage M, Zee B, Tu D, Pater J, Quality of Life Committee of the NC. Analysis and interpretation of health-related quality-of-life data from clinical trials: basic approach of The National Cancer Institute of Canada Clinical Trials Group. European Journal of Cancer 2005;41(2): 280–287.
-
283. Deutsches Krebsforschungszentrum Heidelberg . Allgemeine Terminologie und Merkmale unerwünschter Ereignisse. Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0. 2016.
-
284. Rote Liste® Service GmbH. ROTE LISTE® 2005: Arzneimittelverzeichnis für Deutschland (einschliesslich EU-Zulassungen und bestimmter Medizinprodukte). 2005.
-
285. Hamre HJ, Witt CM, Glockmann A, Ziegler R, Willich SN, Kiene H. Health costs in anthroposophic therapy users: a two-year prospective cohort study. BMC Health Services Research 2006;6: 65.
-
286. Luckett T, King MT, Butow PN, Oguchi M, Rankin N, Price MA, Hackl NA, Heading G. Choosing between the EORTC QLQ-C30 and FACT‑G for measuring health-related quality of life in cancer clinical research: issues, evidence and recommendations. Annals of Oncology 2011;22(10): 2179–2190.
-
287. Melzer J, Iten F, Hostanska K, Saller R. Efficacy and safety of mistletoe preparations (Viscum album) for patients with cancer diseases. A systematic review. Forschende Komplementärmedizin 2009;16(4): 217–226.
-
288. Büssing A, Raak C, Ostermann T. Quality of life and related dimensions in cancer patients treated with mistletoe extract (iscador): a meta-analysis. Evidence-based Complementary and Alternative Medicine 2012;2013: 219402.
-
289. Freuding M, Keinki C, Micke O, Buentzel J, Huebner J. Mistletoe in oncological treatment: a systematic review : Part 1: survival and safety. Journal of Cancer Research and Clinical Oncology 2019;145(3): 695–707.
-
290. Freuding M, Keinki C, Kutschan S, Micke O, Buentzel J, Huebner J. Mistletoe in oncological treatment: a systematic review : Part 2: quality of life and toxicity of cancer treatment. Journal of Cancer Research and Clinical Oncology 2019;145(4): 927–939.
-
291. Ostermann T, Appelbaum S, Poier D, Böhm K, Raak C, Büssing A. A Systematic Review and Meta-Analysis on the Survival of Cancer Patients Treated with a Fermented Viscum album L. Extract (Iscador): An Update of Findings. Complementary Medicine Research 2020;27(4): 260271.
-
292. Heiny BM. Additive Therapie mit standardisiertem Mistelextrakt reduziert die Leukopenie und verbessert die Lebensqualität von Patientinnen mit fortgeschrittenem Mammakarzinom unter palliativer Chemotherapie (VEC-Schema). Krebsmedizin 1991;12: 1–14.
-
293. Borrelli E. Evaluation of the quality of life in breast cancer patients undergoing lectin standardized mistletoe therapy. Minerva Medica 2001;92((Suppl. 1)): 105–107.
-
294. Grossarth-Maticek R, Kiene H, Baumgartner SM, Ziegler R. Use of Iscador, an extract of European mistletoe (Viscum album), in cancer treatment: prospective nonrandomized and randomized matched-pair studies nested within a cohort study. Alternative Therapies in Health and Medicine 2001;7(3): 57–66, 68–72, 74–56 passim.
-
295. Grossarth-Maticek R, Kiene H, Baumgartner SM, Ziegler R. Verlängerung der Überlebenszeit von Krebspatienten unter Misteltherapie (Iscador). Schweizerische Zeitschrift für GanzheitsMedizin 2001;13(4): 217–225.
-
296. Grossarth-Maticek R, Ziegler R. Prospective controlled cohort studies on long-term therapy of breast cancer patients with a mistletoe preparation (Iscador). Forschende Komplementärmedizin 2006;13(5): 285–292.
-
297. Grossarth-Maticek R, Ziegler R. Randomised and non-randomised prospective controlled cohort studies in matched-pair design for the long-term therapy of breast cancer patients with a mistletoe preparation (Iscador): a re-analysis. European Journal of Medical Research 2006;11(11): 485–495.
-
298. Edler L. Mistel in der Krebstherapie: Fragwürdige Ergebnisse neuerer klinischer Studien. Deutsches Ärzteblatt 2004;101: A 44–49.
-
299. Matthes H, Thronicke A, Hofheinz RD, Baars E, Martin D, Huber R, Breitkreuz T, Bar-Sela G, Galun D, Schad F. Statement to an Insufficient Systematic Review on Viscum album L. Therapy. Evidence-based Complementary and Alternative Medicine 2020;2020: 7091039.
-
300. Hübner J, Freuding M, Kutschan S, Dörfler S. Konsultationsfassung Leitlinienreport S3-Leitlinie Komplementärmedizin in der Behandlung onkologischer PatientInnen. 2020.
-
301. Greenlee H, Balneaves LG, Carlson LE, Cohen M, Deng G, Hershman D, Mumber M, Perlmutter J, Seely D, Sen A, Zick SM, Tripathy D. Clinical practice guidelines on the use of integrative therapies as supportive care in patients treated for breast cancer. Journal of the National Cancer Institute Monographs 2014;2014(50): 346–358.
-
302. Moustgaard H, Clayton GL, Jones HE, Boutron I, Jorgensen L, Laursen DRT, Olsen MF, Paludan-Muller A, Ravaud P, Savovic J, Sterne JAC, Higgins JPT, Hrobjartsson A. Impact of blinding on estimated treatment effects in randomised clinical trials: meta-epidemiological study. BMJ 2020;368: l6802.
-
303. Savovic J, Jones H, Altman D, Harris R, Juni P, Pildal J, Als-Nielsen B, Balk E, Gluud C, Gluud L, Ioannidis J, Schulz K, Beynon R, Welton N, Wood L, Moher D, Deeks J, Sterne J. Influence of reported study design characteristics on intervention effect estimates from randomised controlled trials: combined analysis of meta-epidemiological studies. Health Technology Assessment 2012;16(35): 1–82.
-
304. European Medicines Agency Pre-Authorisation Evaluation of Medicines for Human Use. CHMP/EWP/18504/2006 Guideline on the Clinical Development of Products for Specific Immunotherapy for the Treatment of Allergic Disease. 2008.
-
305. European Medicines Agency Pre-Authorisation Evaluation of Medicines for Human Use. EMA/CHMP/292464/2014 Appendix 2 to the guideline on the evaluation of anticancer medicinal products in man. The use of patient-reported outcome (PRO) measures in oncology studies. 2016.
-
306. Calvert M, Blazeby J, Altman DG, Revicki DA, Moher D, Brundage MD, CONSORT PRO Group. Reporting of patient-reported outcomes in randomized trials: the CONSORT PRO extension. JAMA 2013;309(8): 814–822.
-
307. Kienle GS, Kiene H, Albonico HU. Anthroposophische Medizin in der klinischen Forschung: Wirksamkeit, Nutzen, Wirtschaftlichkeit, Sicherheit. 2006.
-
308. Kienle GS, Kiene H, Albonico HU. Health Technology Assessment Bericht Anthroposophische Medizin. Forschende Komplementärmedizin 2005; Programm Evaluation Komplementärmedizin (PEK) des Schweizer Bundesamtes für Sozialversicherung: 1–202.
-
309. Kienle GS, Glockmann A, Grugel R, Hamre HJ, Kiene H. Klinische Forschung zur Anthroposophischen Medizin – Update eines «Health Technology Assessment»-Berichts und Status Quo. Forschende Komplementärmedizin 2011;18(5): 269–282.
-
310. Kompetenznetz Komplementärmedizin in der Onkologie KOKON 2019 www.kompetenznetz-kokon.de/kompetenznetz (13.12.2019).
-
311. Medizin Transparent. Misteltherapie bei Krebs fragwürdig 2020 www.medizin-transparent.at/misteln-in-der-krebstherapie/ (18.11.2020).
-
312. Onko-Internetportal. Komplementäre Medizin bei Krebs – Möglichkeiten und Grenzen. 2020.
-
313. Onko-Internetportal. Die Misteltherapie: Wie wirksam ist sie? 2020
-
314. Bundeszentrale für gesundheitliche Aufklärung. Suche zur “Mistel” 2020 www.bzga.de/suche/?tx_solr%5Bq%5D=Mistel (26.03.2020).
-
315. Gesundheitsportal“ BfGBRN. Brustkrebs 2020 www.gesund.bund.de/brustkrebs (18.11.2020).
-
316. Pannenbecker A. §38“. In: Kügel W, Müller RG, Hofmann HP (Hrsg) Arzneimittelgesetz – Kommentar. 2. Aufl. München: C.H. Beck; S. 681–689
9 Anhang
9.1 Literaturrecherche
Tabelle 84: Übersicht der Treffer aus der domänenübergreifenden Datenbanksuche
|
# |
Datenbank |
Anzahl der Treffer |
|
1 |
MEDLINE via PubMed |
100 |
|
2 |
EMBASE via Ovid |
289 |
|
3 |
CRD Database |
39 |
|
4 |
The Cochrane Library |
2 |
|
5 |
CINAHL |
8 |
Tabelle 84 fasst die Anzahl der Treffer je Datenbank zusammen, um die Nachvollziehbarkeit zu vereinfachen. In Tabelle 85 ist die Suche ausführlicher dokumentiert mit den jeweils verwendeten Suchbegriffen und wie die einzelnen Suchanfragen miteinander verknüpft wurden.
|
Tabelle 85: Suchbegriffe der domänenübergreifenden Suche |
||
|
MEDLINE via PubMed |
19.09.2017 |
|
|
Suche |
Suchbegriffe |
Anzahl Treffer |
|
#1 |
abnoba viscum [Title/Abstract] |
8 |
|
#2 |
Helixor [Title/Abstract] |
20 |
|
#3 |
Iscador [Title/Abstract] |
154 |
|
#4 |
Iscucin [Title/Abstract] |
7 |
|
#5 |
Lektinol [Title/Abstract] |
6 |
|
#6 |
mistletoe [Title/Abstract] |
1108 |
|
#7 |
viscum album [Title/Abstract] |
595 |
|
#8 |
mistle* [Title/Abstract] |
1151 |
|
#9 |
#1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 |
1399 |
|
#10 |
Mistletoe [MeSH Terms] |
1029 |
|
#11 |
viscum album [MeSH Terms] |
222 |
|
#12 |
abnoba viscum [Supplementary Concept] |
6 |
|
#13 |
mistletoe lectin I [Supplementary Concept] |
80 |
|
#14 |
Helixor [Supplementary Concept] |
14 |
|
#15 |
#10 OR #11 OR #12 OR #13 OR #14 |
1071 |
|
#16 |
#9 OR #15 |
1620 |
|
#17 |
mamma cancer [Title/Abstract] |
9 |
|
#18 |
mamma carcinoma [Title/Abstract] |
115 |
|
#19 |
breast cancer [Title/Abstract] |
223592 |
|
#20 |
breast tumor* [Title/Abstract] |
16961 |
|
#21 |
breast neoplasm* [Title/Abstract] |
8694 |
|
#22 |
Breast Neoplasms [Mesh] |
253926 |
|
#23 |
#17 OR #18 OR #19 OR #20 OR #21 OR #22 |
313446 |
|
#24 |
#23 AND #16 |
100 |
|
EMBASE |
19.09.2017 |
|
|
Suche |
Suchbegriffe |
Anzahl Treffer |
|
#1 |
abnoba viscum.ab,ti. |
7 |
|
#2 |
Helixor.ab,ti. |
37 |
|
#3 |
Iscador.ab,ti. |
177 |
|
#4 |
Iscucin.ab,ti. |
9 |
|
#5 |
Lektinol.ab,ti. |
10 |
|
#6 |
mistletoe.ab,ti. |
1400 |
|
#7 |
viscum album.ab,ti. |
736 |
|
#8 |
mistle*ab,ti. |
1444 |
|
#9 |
1 or 2 or 3 or 4 or 5 or 6 or 7 or 8 |
1743 |
|
#10 |
viscum album.mp. or exp Viscum album/ |
2072 |
|
#11 |
exp Viscum album extract/ |
792 |
|
#12 |
mistletoe.mp. or exp mistletoe/ |
1500 |
|
#13 |
10 or 11 or 12 |
2396 |
|
#14 |
9 or 13 |
2419 |
|
#15 |
mamma cancer.ab,ti. |
12 |
|
#16 |
mamma carcinoma.ab,ti. |
132 |
|
#17 |
breast cancer.ab,ti. |
299220 |
|
#18 |
breast tumor*.ab,ti. |
22213 |
|
#19 |
breast neoplasm*.ab,ti. |
784 |
|
#20 |
breast neoplasm.mp. or exp breast tumor/ |
409625 |
|
#21 |
15 or 16 or 17 or 18 or 19 or 20 |
445300 |
|
#22 |
14 and 21 |
289 |
|
Cochrane Library |
23.03.2017 |
|
|
#1 |
MeSH descriptor: [Breast Neoplasms] explode all trees |
10104 results |
|
#2 |
breast cancer |
24518 |
|
#3 |
breast tumor* |
5404 |
|
#4 |
breast neoplasm* |
12770 |
|
#5 |
mamma carcinoma |
25 |
|
#6 |
mamma cancer |
19 |
|
#7 |
#1 or #2 or #3 or #4 or #5 or #6 |
25265 |
|
#8 |
abnoba viscum |
0 |
|
#9 |
Helixor |
5 |
|
#10 |
Iscador |
55 |
|
#11 |
Iscucin |
3 |
|
#12 |
Lektinol |
2 |
|
#13 |
Mistletoe |
108 |
|
#14 |
viscum album |
61 |
|
#15 |
mistle* |
112 |
|
#16 |
#8 or #9 or #10 or #11 or #12 or #13 or #14 or #15 |
141 |
|
#17 |
MeSH descriptor: [Mistletoe] explode all trees |
41 |
|
#18 |
MeSH descriptor: [Viscum album] explode all trees |
7 |
|
#19 |
#16 or #17 or #18 |
141 |
#20
#7 and #19
39
|
CRD Database |
23.03.2017 |
|
|
#1 |
MeSH descriptor: [Breast Neoplasms] explode all trees |
1783 |
|
#2 |
breast cancer |
1353 |
|
#3 |
breast tumor* |
12 |
|
#4 |
breast neoplasm* |
1163 |
|
#5 |
mamma carcinoma |
1 |
|
#6 |
mamma cancer |
0 |
|
#7 |
#1 or #2 or #3 or #4 or #5 or #6 |
2228 |
|
#8 |
abnoba viscum |
0 |
|
#9 |
Helixor |
2 |
|
#10 |
Iscador |
4 |
|
#11 |
Iscucin |
0 |
|
#12 |
Lektinol |
1 |
|
#13 |
Mistletoe |
8 |
|
#14 |
viscum album |
2 |
|
#15 |
mistle* |
8 |
|
#16 |
#8 or #9 or #10 or #11 or #12 or #13 or #14 or #15 |
8 |
|
#17 |
MeSH descriptor: [Mistletoe] explode all trees |
10 |
|
#18 |
MeSH descriptor: [Viscum album] explode all trees |
2 |
|
#19 |
#16 or #17 or #18 |
12 |
#20
#7 and #19
2
|
CINAHL 13.05.2017 |
||
|
#1 |
Breast Neoplasms MW Word in subject heading |
60290 |
|
#2 |
breast cancer [Abstract] |
32568 |
|
#3 |
breast tumor* [Abstract] |
2482 |
|
#4 |
breast neoplasm* [Abstract] |
124 |
|
#5 |
mamma carcinoma [Abstract] |
1 |
|
#6 |
mamma cancer [Abstract] |
2 |
|
#7 |
#1 or #2 or #3 or #4 or #5 or #6 |
70644 |
|
#8 |
abnoba viscum [Abstract] |
0 |
|
#9 |
Helixor [Abstract] |
1 |
|
#10 |
Iscador [Abstract] |
11 |
|
#11 |
Iscucin [Abstract] |
0 |
|
#12 |
Lektinol [Abstract] |
0 |
|
#13 |
mistletoe [Abstract] |
84 |
|
#14 |
viscum album [Abstract] |
47 |
|
#15 |
mistle* [Abstract] |
84 |
|
#16 |
#8 or #9 or #10 or #11 or #12 or #13 or #14 or #15 |
101 |
|
#17 |
#7 AND #16 |
8 |
Die in Tabelle 85 jeweils grau schattierten und in Fett hervorgehobenen Zeilen am unteren Ende einer Suchdokumentation, bei MEDLINE via PubMed #24, bei EMBASE #22, für die Suche in der Cochrane Library #20, in der CRD/DARE Database #20 und bei CINAHL #17, sind die jeweils gefundenen Treffer, die in Form des Titels und einer Zusammenfassung in EndNote exportiert werden. Die gefundenen Referenzen werden in EndNote gesammelt und nach Duplikaten durchsucht.
Tabelle 86: Dokumentation der Leitliniensuche
|
Datenbanken |
|||
|
Datenbank |
Suchbegriff |
Datum |
Anz. Treffer |
|
1) GIN Database breast cancer |
Breast cancer |
30.04.2017 |
101 |
|
2) PubMed guideline |
Breast cancer |
30.04.2017 |
84 |
|
3) EMBASE guideline |
Breast cancer |
30.04.2017 |
62 |
|
4) Cochrane Library |
Breast cancer |
30.04.2017 |
15 |
|
5) ESMO |
Breast cancer |
30.04.2017 |
4 |
|
6) NCCN |
Breast cancer |
30.04.2017 |
5 |
|
Websites |
|
|
AWMF |
Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms |
|
EORTC |
|
|
ESMO |
|
|
1 3rd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 3) Published in 2016 – Ann Oncol (2016) doi: 10.1093/annonc/mdw544 and The Breast 2016, doi: dx.doi.org/10.1016/j.breast.2016.10.001 – First published online: 5 December 2016. Authors: Cardoso F, Costa A, Senkus E, Aapro M, Andre F, Barrios CH, Bergh J, Bhattacharyya G, Biganzoli L, Cardoso MJ, Carey L, Corneliussen-James D, Curigliano G, Dieras V, El Saghir N, Eniu A, Fallowfield L, Fenech D, Francis P, Gelmon K, Gennari A, Harbeck N, Hudis C, Kaufman B, Krop I, Mayer M, Meijer H, Mertz S, Ohno S, Pagani O, Papadopoulos E, Peccatori F, Penault-Llorca F, Piccart MJ, Pierga JY, Rugo H, Shockney L, Sledge G, Swain S, Thomssen C, Tutt A, Vorobiof D, Xu B, Norton L, Winer E. |
|
|
2 Primary Breast Cancer: ESMO Clinical Practice Guidelines Published in 2015- Ann Oncol (2015) 26 (suppl 5): v8-v30. Authors: Senkus E, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rutgers E, Zackrisson S, Cardoso F. |
|
|
3 2nd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC2) Published in 2014 – Ann Oncol (2014) doi: 10.1093/annonc/mdu385 and The Breast 2014, doi: 10.1016/j.breast.2014.08.009 – First published online: September 18, 2014 Authors: Cardoso F, Costa A, Norton L, Senkus E, Aapro M, Andre F, Barrios CH, Bergh J, Biganzoli L, Blackwell KL, Cardoso MJ, Cufer T, El Saghir N, Fallowfield L, Fenech D, Francis P, Gelmon K, Giordano SH, Gligorov J, Goldhirsch A, Harbeck N, Houssami N, Hudis C, Kaufman B, Krop I, Kyriakides S, Lin UN, Mayer M, Merjaver SD, Nordström EB, Pagani O, Partridge A, Penault-Llorca F, Piccart MJ, Rugo H, Sledge G, Thomssen C, Van’t Veer L, Vorobiof D, Vrieling C, West N, Xu B, Winer E, European School of Oncology. |
|
|
4 BRCA in Breast Cancer: ESMO Clinical Practice Guidelines Published in 2011 – Ann Oncol 2011; 22 (Suppl 6): vi31-vi34. Authors: Balmana J, Diez O, Rubio IT, Cardoso F. |
|
|
ASCO |
1 Endocrine Therapy for Hormone Receptor-Positive Metastatic Breast Cancer (23.05.2016) |
|
2 Selection of Optimal Adjuvant Chemotherapy Regimens for Human Epidermal Growth Factor Receptor 2 (HER2) ‑Negative and Adjuvant Targeted Therapy for HER2-Positive Breast Cancers (18.04.2016) |
|
|
3 Role of Patient and Disease Factors in Adjuvant Systemic Therapy Decision-Making for Early-Stage, Operable Breast Cancer (21.03.2016) |
|
|
4 Adjuvant Endocrine Therapy for Women with Hormone Receptor-Positive Breast Cancer Update on Ovarian Suppression (16.02.2016) |
|
|
5 Use of Biomarkers to Guide Decisions on Adjuvant Systemic Therapy for Women with Early-Stage Invasive Breast Cancer (08.02.2016) |
|
|
6 ACS/ASCO Breast Cancer Survivorship Care Guideline (07.12.2015) |
|
Anz. = Anzahl. ASCO = American Society of Clinical Oncology. AWMF = Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. EORTC = European Organisation for Research and Treatment of Cancer. ESMO = European Society for Medical Oncology. HER2: Human epidermal growth factor receptor 2.
Tabelle 87: Dokumentation der Leitliniensuche mit Suchbegriffen
|
Suche |
Suchbegriff |
Anzahl Treffer |
|
|
GIN Database: |
alle 93 durchgesehen |
||
|
1 |
Breast Cancer |
93 Ergebnisse aus 6.360 Einträgen |
|
|
2 |
Mistle |
Keine Ergebnisse |
|
|
3 |
viscum album |
Keine Ergebnisse |
|
|
4 |
Mistletoe |
Keine Ergebnisse |
|
|
EMBASE via Ovid |
30.04.2017 |
||
|
1 |
(Recommendation* or Guideline).ti. |
47.718 |
|
|
2 |
breast cancer.ti. |
175.438 |
|
|
3 |
breast cancer.sh. |
281.812 |
|
|
4 |
breast cancer/ or exp breast tumor/ or exp breast carcinogenesis/ or breast carcinoma/ |
389.931 |
|
|
5 |
2 or 3 or 4 |
398.315 |
|
|
6 |
1 and 5 |
1.600 |
|
|
7 |
(alternative or integrative or complementary).af. |
840.152 |
|
|
8 |
6 and 7 |
62 |
|
|
Cochrane Library |
30.04.2017 |
||
|
#1 |
MeSH descriptor: [Guideline] explode all trees |
26 |
|
|
#2 |
MeSH descriptor: [Practice Guideline] explode all trees |
16 |
|
|
#3 |
Guideline* |
26.921 |
|
|
#4 |
recommendation* |
19.766 |
|
|
#5 |
#1 or #2 or #3 or #4 |
40.192 |
|
|
#6 |
MeSH descriptor: [Breast Neoplasms] explode all trees |
10.161 |
|
|
#7 |
breast cancer |
24.995 |
|
|
#8 |
breast carcinoma |
2.980 |
|
|
#9 |
#6 or #7 or #8 |
25.733 |
|
|
#10 |
#5 and #9 |
1.841 |
|
|
#11 |
mistletoe or viscum album |
126 |
|
|
#12 |
integrative medicine or integrative therap* |
2.723 |
|
|
#13 |
alternative medicine or alternative therap* |
28.185 |
|
|
#14 |
complementary medicine or complementary therap* |
7.438 |
|
|
#15 |
#11 or #12 or #13 or #14 |
33.446 |
|
|
#16 |
#10 and #15 |
536 |
|
|
“other reviews” |
15 |
||
|
PubMed |
30.04.2017 |
|
|
#1 |
guideline [Publication Type] |
29.041 |
|
#2 |
mamma cancer |
341.825 |
|
#3 |
mamma carcinoma |
81.383 |
|
#4 |
breast cancer |
339.733 |
|
#5 |
breast tumor* |
16.727 |
|
#6 |
breast neoplasm* |
249.756 |
|
#7 |
Breast Neoplasms [Mesh] |
249.416 |
|
#8 |
(integrative medicine) OR integrative therap* |
21.854 |
|
#9 |
(alternative medicine) OR alternative therap* |
284.751 |
|
#10 |
(complementary medicine) OR complementary therap* |
233.115 |
|
#11 |
(#2 OR #3 OR #4 OR #5 OR #6 OR #7) |
344.765 |
|
#12 |
(#8 or #9 or 10) |
4.024.816 |
|
#13 |
(((#8 or #9 or 10))) AND ((#2 OR #3 OR #4 OR #5 OR #6 OR #7)) |
64.494 |
|
#14 |
(#1 AND #13) |
84 |
|
#15 |
(#1 AND #6 AND #12) |
62 |
|
NCCN |
National Comprehensive Cancer Network |
Treffer |
|
NCCN GUIDELINES FOR TREATMENT OF CANCER BY SITE Rubrik: Breast Cancer |
5 |
Tabelle 88: Durchsuchte Studienregister
|
Studienregister |
Suchbegriff |
URL |
|
International Standard Randomised Controlled Trial Number Register (ISRCTN Registry) |
„Misti etoe“; „Viscum album“ |
|
|
EORTC Clinical Trials Database |
„Misti etoe“; „Viscum album“ |
|
|
ClinicalTrials.gov |
„Misti etoe“; „Viscum album“ |
clinicaltrials.gov |
|
EU Clinical Trials Register |
mistletoe AND breast |
|
|
Deutsches Register Klinischer Studien |
„Mistel“ |
|
|
WHO International Clinical Trials Registry Platform/Search Portal |
“breast AND mistletoe” |
apps.who.int/trialsearch |
|
PROSPERO – International prospective register of systematic reviews |
„Misti etoe“; „Viscum album“ |
|
|
National Center for Complementary and Integrative Health |
„Mistletoe“; „Viscum album“ |
nccih.nih.gov/research/clinicaltrials Verlinkt mit clinicaltrials.gov |
|
Studienregister |
Ergebnis |
Studien |
Status |
|
International Standard Randomised Controlled Trial Number Register (ISRCTN Registry) |
Keine relevanten Treffer |
- |
|
|
EORTC Clinical Trials Database |
Keine relevanten Treffer |
- |
|
|
ClinicalTrials.gov |
Zu Brustkrebs zwei Treffer, beide bereits bewertet: |
Von Hagens, 2005; NCT00176046 |
Abgeschlossen, Bereits eingeschlossen |
|
Mansky, 2007; NCT00049608 |
Abgeschlossen; Bereits ausgeschlossen |
||
|
EU Clinical Trials Register |
Drei Studien zu Brustkrebs |
Mistletoe And Breast Cancer (MAB): A pilot study for a randomized double-blind controlled trial; University of Bristol (2018); EudraCT Number: 2018–000279-34 |
Laufend, neu identifiziert |
|
Mistletoe in early Breast Cancer (MBC): A pilot study for a randomised controlled trial; University of Bristol (2011); EudraCT Number: 2011–001224-37 |
Laufend, neu identifiziert |
||
|
Multicenter, randomized, double-blind, placebo-controlled parallel group study to demonstrate the efficacy (quality of life) and safety of the standardized mistletoe extract PS76A2 during chemotherapy and follow-up in patients with breast cancer; Bulgarian Drug Agency (2011); EudraCT Number: 2007–000841-36 |
Laufend, neu identifiziert |
||
|
Deutsches Register Klinischer Studien |
Keine relevanten Treffer |
- |
|
|
WHO International Clinical Trials Registry Platform/Search Portal |
Fünf Studien zu Brustkrebs |
Duplikat zu University of Bristol (2018) |
Laufend, neu identifiziert |
|
Duplikat zu University of Bristol (2011) |
Laufend, neu identifiziert |
||
|
Duplikat zu Bulgarian Drug Agency (2007) |
Laufend, neu identifiziert |
||
|
Duplikat zu Von Hagens (2005) |
Abgeschlossen, Bereits eingeschlossen |
||
|
Duplikat zu Mansky (2007) |
Abgeschlossen; Bereits ausgeschlossen |
||
|
PROSPERO - International prospective register of systematic reviews |
Keine relevanten Treffer |
- |
Tabelle 90: Suchstrategie Internetsuche Graue Literatur
|
Datenbank/Organisation |
Kommentar |
Webseite |
Datum |
Anzahl Treffer |
|
PRiO: Prävention und integrative Onkologie, eine Arbeitsgemeinschaft der Deutschen Krebsgesellschaft |
Insgesamt hat die Arbeitsgruppe zu KAM elf Publikationen, von denen neun einen Bezug zu Krebs haben. |
www.prio- dkg.de/wissenschaftliche-informationen/komplementa ere-und-alternative-medizin |
Update 15.11.20 17 |
9 |
|
Relevante wissenschaftliche Zeitschriften |
||||
|
Karger 2008 bis 2016 mistletoe AND breast cancer mistel AND brustkrebs Journals of Publications with hits: Breast Care Complementary Medicine Research Forsch Komplementmed Karger Kompass Onkologie Oncol Res Treat Transl Res Biomed Schweiz Z Ganzheitsmed |
Restriktion: Publikationsjahr (2008 bis 2017), Zeitschrift relevant für Humanmedizin und Ausschluss von Publikationen mit Tieren im Titel. |
Update 16.01.20 18 |
42 |
|
|
CAMBase mistletoe AND breast cancer mistel AND brustkrebs |
33 15 |
|||
|
Open Access Journals Lund University Libraries. Directory of Open Access Journals (DOAJ) mistletoe and breast cancer |
doaj.org/search?source= % 7B %22query %22 %3A %7 B %22query_string %22 %3 A %7B %22query %22 %3A %22 %5C %5C(mistletoe % 20and %20breast %20canc er %22 %2C %22default_fiel d %22 %3A %22bibjson.abs tract %22 %2C %22default_ operator %22 %3A %22AN D %22 %7D %7D %2C %22 from %22 %3A0 %2C %22si ze %22 %3A10 %7D |
18.12.20 17 |
8 |
|
|
CORE-Hom Homeopathic remedy: viscum album (klinische Studien zur Homöopathie) |
https://www.hri- research.org/resources/rese arch-databases/core-hom |
04.06.20 20 |
0 |
|
|
HomBRex Database Substance: Viscum album (HomBRex beinhaltet Experimente zur homöopathischen Grundlagenforschung.) |
Restriktion: Suchzeitraum ab 2000 |
www.carstens- stiftung.de/databases/#/hom brex/result?organ=92&subst ance=631&type_of_organis m=6 |
04.06.20 20 |
0 |
Anz. = Anzahl. KAM = Komplementäre und alternative Medizin.
|
Nr. |
Suchbegriffe (Suche durchgeführt am 13. Dezember 2017) |
Anzahl Treffer |
|
#1 |
TS=(experience OR desire OR expectations OR wishes OR attitude OR Quality Life OR patient-reported outcome* OR importance OR satisfaction OR satisfied OR acceptance OR perception OR awareness OR burden OR stress OR load OR access OR maintenance OR support OR supply OR restraint OR training self-administration OR communication OR implications OR patient information OR explanation OR communication OR guidance OR social) |
10.836.216 |
|
# 2 |
TI= (experience OR desire OR expectations OR wishes OR attitude OR Quality Life OR patient-reported outcome* OR importance OR satisfaction OR satisfied OR acceptance OR perception OR awareness OR burden OR stress OR load OR access OR maintenance OR support OR supply OR restraint OR training self-administration OR communication OR implications OR patient information OR explanation OR communication OR guidance OR social) |
2.726.049 |
|
# 3 |
TS=(breast cancer OR mamma carcinoma) |
483.772 |
|
# 4 |
TI=(breast cancer OR mamma carcinoma) |
210.956 |
|
# 5 |
TS=(mistletoe OR viscum album) |
3.352 |
|
# 6 |
TI=(mistletoe OR viscum album) |
2.351 |
|
# 7 |
#2 OR #1 |
10.836.216 |
|
# 8 |
#4 OR #3 |
483.772 |
|
# 9 |
#6 OR #5 |
3.352 |
|
# 10 |
#9 AND #8 AND #7 |
137 |
|
Tabelle 92: Datenbanken integriert |
in die Suche über Ovid zu Patienten- und sozialen Aspekten |
|
|
Datenbank und Zeitraum |
Suchbegriffe/durchsuchte Felder |
Anzahl Treffer |
|
Books@Ovid; November 13, 2017 |
((“viscum album” or “mistletoe”) AND (“breast cancer” or |
57 |
|
Journals@Ovid Full Text; November 17, 2017 BIOSIS Previews; 1969 bis 2009 |
“mamma carcinoma”)).ab,at,ti. AND (experience or desire or expectations or wishes or attitude or Quality Life or patient-reported outcome* or importance or satisfaction or satisfied or acceptance or perception or awareness or burden or stress or load or access or maintenance or support or supply or restraint or training self-administration or communication or implications or patient |
|
|
EMBASE; 1988 bis 2017 Woche 47 |
||
|
Ovid MEDLINE(R); 1946 bis November Woche 2 2017 |
information or explanation or communication or guidance or social).ab,at,ti. |
|
|
Ovid MEDLINE(R) Epub Ahead of Print; November 17, 2017 |
Tabelle 93: Durchsuchte Internetseiten aus der Grey Matters Checkliste
|
Institution |
Link |
Suchbegriffe |
Datum |
Treffer |
|
The Alberta College of Family Physicians |
gomainpro.ca/tools-for-practice |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Canadian Agency for Drugs and Technologies in Health (CADTH) |
Mistletoe |
12.06.2019 |
Keine Treffer |
|
|
Canadian Institute of Health Research |
www.cihr- irsc.gc.ca/e/193.html |
Mistletoe; viscum album; helixor, lektinol, iscador |
12.07.2019 |
Keine Treffer |
|
Drug Safety and Effectiveness Network (DSEN) |
www.cihr- irsc.gc.ca/e/40269.html |
Mistletoe; viscum album |
12.07.2019 |
Keine Treffer |
|
Health Quality Ontario (HQO) |
Mistletoe; viscum album |
12.07.2019 |
Keine Treffer |
|
|
The Hospital for Sick Children (SickKids) – Technology Assesement at Sick Kids (TASK) |
ds/who-we-are/index.html |
Mistletoe; viscum album |
12.07.2019 |
Keine Treffer |
|
Institut national d’excellence en sante et en Services sociaux (INESSS) |
Mistletoe; viscum album |
27.05.2019 |
Keine Treffer |
|
|
Institute of Health Economics (IHE). Publications |
www.ihe.ca/index.php?/publications |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Manitoba Centre for Health Policy (MCHP). Deliverables |
mchp- appserv.cpe.umanitoba.ca/deliverablesList.html |
Mistletoe; viscum album; helixor, lektinol, iscador |
27.05.2019 |
Keine Treffer |
|
McGill University Health Centre (MUHC). Technology Assessment Unit Reports |
muhc.ca/tau/page/tau-reports |
Mistletoe |
12.07.2019 |
Keine Treffer |
|
NLCAHR: Newfoundland and Labrador Centre for Applied Health Research. Contextualized Health Research Synthesis Program (CHRSP) Completed CHRSP projects |
www.nlcahr.mun.ca/CHRSP/ CompletedCHRSP.php |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Ottawa Hospital Research Institute (OHRI) |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
|
Programs for Assessment of Technology in Health (Canada) ‑Reports (PATH) |
vortal.htai.org/index.php?q=n ode/149 |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Therapeutics Initiative. Therapeutics Letter |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
|
University of British Columbia. Centre for Health Services and Policy Research |
chspr.ubc.ca/publications |
Mistletoe therapy; breast cancer |
27.05.2019 |
46 |
|
INAHTA Secretariat ‑International Network of Agencies for Health Technology Assessment (INAHTA) |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
|
World Health Organization Regional Office for Europe. Health Evidence Network (WHO HEN) |
www.euro.who.int/en/data-and-evidence/evidence-informed-policy-making/publications/by-keyword |
Mistletoe |
12.07.2019 |
Keine Treffer |
|
Australian Government. Department of Health and Ageing. Australia and New Zealand Horizon Scanning Network (ANZHSN) |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
|
Joanna Briggs Institute (JBI) |
connect.jbiconnectplus.org/ Search.aspx |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Monash Health. Centre for Clinical Effectiveness (CCE). Centre for Clinical Effectiveness ‑Publications |
monashhealth.org/health-professionals/cce |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
National Prescribing Service NPS RADAR |
Mistletoe OR viscum album |
12.07.2019 |
Keine Treffer |
|
|
Queensland Government (Australia). Health Technology Reference Group. Health Technologies Evaluated Reports and Briefs (COAG Health Council) |
www.coaghealthcouncil.gov.au/AHMAC/Health-Technology-Reference-Group/Reports-and-Briefs |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Institute of Technology Assessment (ITA). Projects |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
|
Ludwig Boltzmann Institut für Health Technology Assessment (LBI). Ludwig Boltzmann Institut of Health Technology Assessment |
hta.lbg.ac.at/page/homepag e/de |
Mistletoe |
27.05.2019 |
Keine Treffer |
|
Kenniscentrum voor de Gezondheidszorg/Le Centre d’expertise des soins de sante. Belgian Health Care Knowledge Centre (KCE) |
kce.fgov.be/en/all-reports |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Sundhedsstyrelsen. Danish Health and Medicines Authority (DHMA). Publications |
sundhedsstyrelsen.dk/en/pu blications |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Haute Autorite de sante/French National Authority for Health (HAS). Haute Autorite de sante |
www.has- sante.fr/portail/jcms/c_9469 86/en/english-toutes-nos-publications-ligne- principale?portal=r_1457306 |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Deutsches Institut für Medizinische Dokumentation und Information (DIMDI). German Institute of Medical Documentation and Information |
Mistletoe |
29.05.2019 |
1 |
|
|
Health Information and Quality Authority. Health Technology Assessments |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
Health Service Executive. Irish Health Repository (Lenus) |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
De Gezondheidsraad (GR). Health Council of the Netherlands |
www.gezondheidsraad.nl/en /publications |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Zorginstituut Nederland. National Health Care Institute Netherlands |
www.zorginstituutnederland. nl/publications+in+english |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Nasjonalt kunnskapssenter for helsetjenesten. Norwegian Knowledge Centre for the Health Services. Publications |
www.kunnskapssenteret.no/ en/publications |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Agencia de Evaluacion de Tecnolog^as Sanitarias, Instituto de Salud “Carlos III”. Institute of Health Carlos III |
publicaciones.isciii.es/ |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Agencia de Qualitat i Avaluacio Sanitaries de Catalunya (AQuAS). Agency for Health Quality and Assessment of Catalonia |
aquas.gencat.cat/ca/publica cions |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Sahlgrenska Universitetssjhuset. Sahlgrenska Universtity Hospital. Regional activity-based HTA |
hitta.vgregion.se |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Swedish Council on Health Technology Assessment (SBU). |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
Health Care Improvement Scotland |
Mistletoe |
29.05.2019 |
Keine Treffer |
National Institute for Health and www.nice.org.uk Mistletoe 12.07.2019 1
Care Excellence (NICE). NHS
National Institute for Health and
Care Excellence
|
National Institute for Health and Care Excellence (NICE). Advice List. Published evidence summaries |
www.nice.org.uk/advice?type=esnmMistletoe 12.07.2019 1 |
|
NHS Purchasing and Supply Agency. Center of Evidence-based Purchasing (CEP) |
healthmanagement.org/c/it/issuearticle/the-uk-centre-for-evidence-based-purchasing-cepMistletoe 29.05.2019 Keine Treffer |
|
NIHR Evaluation, Trials and Studies Coördinating Center (NETSCC). Project Portfolio |
www.nihr.ac.uk/about-us/how-we-are-managed/coördinating-centres/nihr-evaluation-trials-and-studies-coördinating-centreMistletoe 29.05.2019 Keine Treffer |
|
UK Department of Health (NHS). International Ressource for Infection Control (iNRIC) |
https://www.england.nhs.uk/publication/national-infection-prevention-and-control.co.ukMistletoe 29.05.2019 Keine Treffer |
|
National Health Service UK (NHS). NHS England |
www.england.nhs.uk Mistletoe 29.05.2019 Keine Treffer |
|
Agency für Healthcare Research and Quality (AHRQ) |
www.ahrq.gov/research/findings/ta/index.htmlMistletoe 29.05.2019 Keine Treffer |
|
Blue Cross and Blue Shield Association. Technology Evaluation Center (TEC) |
www.bcbs.com/blueresources/tec/topic.htmlMistletoe 29.05.2019 Keine Treffer |
|
Centers of Medicare & Medicaid Services (CMS) Technology Assesment |
www.cms.gov/medicare-coverage-database/indexes/technolog y‑assessments-index.aspx?TAId=85&bc=AAAQAAAAAAAA&Mistletoe 29.05.2019 Keine Treffer |
|
Institute of Clinical Economic Review (ICER) |
icer-review.org Mistletoe 29.05.2019 Keine Treffer |
|
Washington Health Care Authority (HCA) Health Technology Assessment Findings |
www.hca.wa.gov/about-hca/health-technology-assessmentMistletoe 29.05.2019 Keine Treffer |
|
University of Aberdeen. Health Economics Research Unit (HERU) |
www.abdn.ac.uk/heruMistletoe 29.05.2019 Keine Treffer |
|
British Columbia Ministry of Health. BC Guidelines |
www2.gov.bc.ca/gov/content/health/practitioner-professional-resources/bc-guidelines>Mistletoe 29.05.2019 1 |
|
Canadian Standard Association (CSA) Occupational Health and Safety |
www.cancerview.ca/cv/portal/Home Mistletoe 29.05.2019 Keine Treffer |
|
National Guideline Clearinghouse (NGC) |
www.guideline.gov Mistletoe 29.05.2019 Keine Treffer |
|
National Institute for Health and Care Excellence (NICE). NICE Guidelines |
www.nice.org.uk/guidance Mistletoe 29.05.2019 1 |
|
European Medicines Agency (EMA). European Public Assessments Reports (EPAP) |
www.ema.europa.eu/en/glossary/european-public-assessment-report Mistletoe 29.05.2019 28 relevant only: www.ema.europa.eu/en/documents/herbal-report/final-assessment-report-viscum-album-l-herba_en.pdf |
|
National Institute of Medical Statistics, Indian Council of Medical Research. Clinical Trials Registry – India (CTRI) |
ctri.nic.in/Clinicaltrials/advan Mistletoe 29.05.2019 Keine Treffer cesearchmain.php |
|
Canadian Partnership Against Cancer Corporation. Canadian Cancer Trials |
www.canadiancancertrials.c Mistletoe 29.05.2019 Keine Treffer a/ |
|
US National Institutes of Health. ClinicalTrials.gov |
clinicaltrials.gov/ct/screen/A Mistletoe 29.05.2019 18 dvancedSearch |
|
World Health Organization. International Clinical Trials Registry Platform search portal (ICTRP) |
apps.who.int/trialsearch/ Mistletoe 29.05.2019 39 |
|
Bandolier. Bandolier Knowledge |
www.medicine.ox.ac.uk/ban Mistletoe 29.05.2019 Keine Treffer dolier/knowledge.html |
|
McMaster University, McMaster Health Forum. Health Systems Evidence |
www.healthsystemsevidenc Mistletoe 29.05.2019 Keine Treffer e.org |
|
TRIP Database (TRIP). Trip Database – Clinical Search Engine |
www.tripdatabase.com Mistletoe 29.05.2019 66 |
|
Centre for Reviews and Dissemination. HTA Database |
www.crd.york.ac.uk/crdweb/ Mistletoe 29.05.2019 14 SearchPage.asp |
|
University of York. PROSPERO. International prospective register of systematic reviews |
www.crd.york.ac.uk/prosper Mistletoe 29.05.2019 4 o |
|
US National Library of Medicine (NLM). Pubmed |
www.ncbi.nlm.nih.gov/pubmedMistletoe 29.05.2019 106 Treffer |
|
US National Library of Medicine & National Institutes of Health (NIH). PubMed Central |
www.ncbi.nlm.nih.gov/pmc Mistletoe 29.05.2019 824 |
|
Wiley InterScience. Cochrane Library |
www.cochranelibrary.com/advanced-search?cookiesEnabledMistletoe 29.05.2019 113 |
|
PMJ Publishing Group. Clinical Evidence |
www.bmj.com/specialties/clinical-evidenceMistletoe 29.05.2019 Keine Treffer |
|
Canadian Institute for Health Information (CIHI). Quick Stats |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
IMS/Brogan. IMS Health |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
Institute for Clinical Evaluative Sciences (ICES). Publications |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
New Brunswick Ministry of Health, Office of the Chief Medical Officer of Health. Epidemiology and Surveillance |
www2.gnb.ca/content/gnb/e n/departments/ocmoh/epide miology_surveillance.html |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Public Health Agency of Canada (PHAC). Chronic Disease Infobase |
infobase.phac- aspc.gc.ca/index-en.html |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
National Cancer Institute, Surveillance, Epidemiology and End Results Program (SEER) |
seer.cancer.gov/ |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
World Health Organization (WHO). Global Health Observatory (GHO) |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
|
ADA. Center for Evidence-Based Dentistry |
ebusiness.ada.org/educatio n/default.aspx |
Mistletoe |
29.05.2019 |
Keine Treffer |
|
Alternative Medicine Foundation. HerbMed |
Mistletoe |
29.05.2019 |
Keine Treffer |
Tabelle 94: In die Suche über EBSCO integrierte Datenbanken zu Patienten- und sozialen Aspekten
|
Datenbank und Zeitraum |
Suchbegriffe/durchsuchte Felder |
Anzahl Treffer |
|
PsycINFO; 1800 bis 2017 Woche 47 |
((“viscum album” or “mistletoe”) AND (“breast cancer” or “mamma carcinoma”)).ab,at,ti. |
17 |
|
PsycARTICLES; 1894 bis 2017 Woche 47 |
AND (experience or desire or expectations or wishes or attitude or Quality Life or patient-reported outcome* or importance or |
|
|
CINAHL Complete; bis 2017 Woche 47 Academic Search Élite; 1985 bis 2017 Woche 47 |
satisfaction or satisfied or acceptance or perception or awareness or burden or stress or load or access or maintenance or support or _ supply or restraint or training self-administration or communication or implications or patient information or explanation or communication or guidance or social).ab,at,ti. |
Tabelle 95: Zusätzliche Datenbanksuche nach Reviews
Datenbank und Zeitraum Suchbegriffe/durchsuchte Felder
Anzahl Treffer
AMED 1981 bis 2020
Woche 35
Alt HealthWatch 1986 bis 2020 Woche 35
( carcinoma OR neoplasm OR tumor OR cancer OR *krebs OR 48 Brustkrebs OR malignom* ) AND ( breast OR mamma OR Brust* OR Brustkrebs ) AND ( mistletoe OR viscum album OR mistel OR abnobaVISCUM OR Helixor OR Iscador OR Iscucin OR Isorel OR
Eurixor OR Cefalexin OR Lektinol )
|
Expanders - Apply equivalent subjects Note: Exact duplicates removed from the results. |
|
|
AMED 1981 bis 2020 Woche 35 |
Mistletoe AND cancer AND qualitative 4 |
Alt HealthWatch 1986 bis
2020 Woche 35
Suche zu ethischen Aspekten der Misteltherapie
Es wurden insgesamt elf Suchläufe in PubMed durchgeführt (siehe Tabelle 96). Am Ende wurden die Suchläufe 8, 2 und 11 verwendet. Suchlauf 8 wurde dabei als Hauptsuche verwendet, da diese Suchstrategie als breit genug für die Zwecke des HTA-Berichts, aber noch bewältigbar in Hinblick auf die Trefferzahlen eingeschätzt wurde, da beim explorativen Screening deutlich wurde, dass voraussichtlich viele Treffer bereits auf Titelebene ausgeschlossen werden können. Suchlauf 8 hat neben Komplementär- und Integrativmedizin im entsprechenden Suchblock auch Alternativmedizin mitaufgenommen, auch wenn es in diesem HTA-Bericht nicht um alternativmedizinischen Einsatz von Misteltherapie geht. Der Grund hierfür liegt darin, dass diese Begrifflichkeiten (Komplementär‑, Integrativ‑, Alternativmedizin) im Allgemeinen unterschiedlich von Autorinnen und Autoren aufgefasst werden können (vgl. Abschnitt 1.5), daher nicht zwingend davon ausgegangen werden kann, dass Literatur, die „Alternativmedizin“ zum Gegenstand hat, nicht damit (auch) das abdeckt, was in diesem HTA-Bericht als „Komplementärmedizin“ oder „integrative Medizin“ definiert wird. Zudem wurden nur wenige zusätzliche Treffer durch die Aufnahme in den Suchblock erzeugt. Daher wurde entschieden, dass erst auf der Ebene der Selektion bestimmt werden soll, ob der Inhalt der jeweiligen Literatur relevant ist oder nicht, nicht aber bereits auf der Ebene der verwendeten Suchbegriffe.
Suchlauf 2 wurde als ergänzende Suche verwendet, um generelle Probleme oder Themen bei der Verwendung von Misteltherapie zu erfassen, die möglicherweise von den anderen Suchläufen nicht erfasst werden konnten. Suchlauf 11 wurde ebenfalls als ergänzende Suche verwendet, um generellere Probleme oder Themen mit Komplementär- und Integrativmedizin in palliativen Kontexten zu erfassen.
Tabelle 96: Suche Literatur zu ethischen Aspekten: PubMed (15. Juni 2017)
|
Suchblöcke |
Suchbegriffe |
|
Mistel |
(Mistle* OR Mistel OR Mistletoe [MeSH] OR “Viscum album” OR Iscador OR viscum album [MeSH] OR abnoba viscum OR Helixor OR Iscucin OR Lektinol) |
|
CM |
(Mistle* OR Mistel OR Mistletoe [MeSH] OR “Viscum album” OR Iscador OR viscum album [MeSH] OR abnoba viscum OR Helixor OR Iscucin OR Lektinol OR “complementary medicine” OR Komplementärmedizin OR “integrative medicine” OR “integrative medizin” OR CAM OR Complementary Therapies [MeSH]) |
|
CAM |
(Mistle* OR Mistel OR Mistletoe [MeSH] OR “Viscum album” OR Iscador OR viscum album [MeSH] OR abnoba viscum OR Helixor OR Iscucin OR Lektinol OR “alternative medicine” OR Alternativmedizin OR “complementary medicine” OR Komplementärmedizin OR “integrative medicine” OR “integrative medizin” OR CAM OR Complementary Therapies [MeSH]) |
|
Brustkrebs |
(“breast cancer” OR brustkrebs OR “breast carcinoma” OR mammakarzinom) |
|
Krebs |
(cancer OR krebs OR carcinoma OR karzinom) |
|
Palliativ |
(palliativ*) |
|
Ethik |
(consent OR Einwilligung OR “informed consent” OR “informierte Einwilligung” OR informing OR Aufklärung OR Autonomy OR Autonomie OR self-determination OR Selbstbestimmung OR justice OR Gerechtigkeit OR fairness OR beneficence OR Fürsorge OR maleficence OR non-maleficence OR ethics [MeSH] OR ethic* OR moral* OR ethos OR bioethics [sb]) |
|
Suchbegriffe/Kombinationen Suchblöcke |
Treffer (01/01/1987- 02/06/2017) |
Davon in die EndNote exportiert für das TiAb Screening |
|
1) Mistel + Brustkrebs + Palliativ + Ethik |
0 |
Suche nicht verwendet |
|
2) Mistel + Ethik |
16 |
exportiert: 16 |
|
3) CM + Brustkrebs + Palliativ + Ethik |
3 |
Suche nicht verwendet |
|
4) CM + Brustkrebs + Ethik |
50 |
Suche nicht verwendet |
|
5) CM + Krebs + Ethik |
434 |
Suche nicht verwendet |
|
6) CM + Krebs + Palliativ + Ethik |
54 |
Suche nicht verwendet |
|
7) CAM + Krebs + Palliativ + Ethik |
56 |
Suche nicht verwendet |
|
8) CAM + Krebs + Ethik |
444 |
exportiert: 444 |
|
9) CM + Ethik |
5009 |
Suche nicht verwendet |
|
10) CM + Palliativ + Ethik |
143 |
Suche nicht verwendet |
|
11) CAM + Palliativ + Ethik |
147 |
exportiert: 147 |
CAM = Komplementäre und alternative Medizin, engl.: complementary and alternative medicine. CM = Komplementäre Medizin, engl.: complementary medicine. TiAb = Titel und Abstract.
PhilPapers
Die Suchmaske von PhilPapers erlaubt technisch keine komplexen beziehungsweise langen Suchstrings, weshalb vergleichsweise einfache beziehungsweise kurze Suchstrings in drei Suchläufen verwendet wurden (vgl. Tabelle 97). Testsuchläufe haben aber auch gezeigt, dass komplexere Suchstrings, die noch technisch umsetzbar sind (zum Beispiel die Kombination eines Suchblocks „CAM“ mit einem Suchblock „Ethik“ wie beispielsweise bei PubMed) unergiebig sind. Da insgesamt ohnehin bei Anwendung des Suchblocks „CAM“ nur 166 beziehungsweise (nach Entfernung von Duplikaten) 160 Treffer erzielt wurden und sich diese Treffermenge noch im bewältigbaren Rahmen für die Prüfung auf ethisch relevante Literatur befand, wurde auf komplexere Suchläufe verzichtet.
|
Suchblöcke |
Suchbegriffe |
|
Mistel |
mistletoe |
|
CM |
“complementary medicine” | “integrative medicine” |
|
CAM |
“complementary medicine” | “integrative medicine” | “alternative medicine” |
|
Suchbegriffe |
Treffer (ohne Restriktion) Davon in die EndNote exportiert für das TiAb Screening |
|
1) Mistel |
0 Suche nicht verwendet |
|
2) CM |
45 Suche nicht verwendet |
|
3) CAM |
166 exportiert: 166 |
CAM = Komplementäre und alternative Medizin (engl. complementary and alternative medicine). CM = Komplementäre Medizin (engl. complementary medicine). TiAb = Titel und Abstract.
Sowiport
Die Suchmaske von Sowiport erlaubt komplexere Suchläufe, weshalb sechs Suchläufe durchgeführt wurden. Wie bei der PubMed-Suche wurden nicht alle Suchläufe verwendet; am Ende wurden Suchlauf 4 und 6 einbezogen (vgl. Tabelle 98). Suchlauf 4 deckte die Verwendung von Komplementär- und Integrativmedizin bei Krebs im palliativen Setting ab (ohne spezifischen „Ethik“-Suchblock), Suchlauf 6 dagegen die Ethik der Verwendung von Komplementär- und Integrativmedizin bei Krebserkrankungen. Insgesamt wurden aus Suchlauf 4 und 6 eine Gesamtzahl von 53 Treffern erzielt und in die EndnoteDatei übernommen, wobei nach Entfernung der Duplikate noch 43 Treffer verblieben.
Tabelle 98: Suche Literatur zu ethischen Aspekten: Sowiport (13. Juni 2017)
Suchblöcke Suchbegriffe
Mistel (mistel OR mistletoe)
CAM (mistel OR mistletoe OR (alternative AND medicine) OR (integrative AND medicine) OR
(complementary AND medicine) OR Alternativmedizin OR Komplementärmedizin OR (integrative AND medizin))
Krebs (cancer OR Krebs OR carcinome OR karzinom)
Palliativ (palliative OR palliativ)
Ethik consent OR Einwilligung OR (informed AND consent) OR (informierte AND Einwilligung) OR informing OR Aufklärung OR Autonomy OR Autonomie OR self-determination OR Selbstbestimmung OR justice OR Gerechtigkeit OR fairness OR beneficence OR Fürsorge OR maleficence OR non-maleficence OR ethic* OR moral* OR ethos)
|
Suchbegriffe |
Treffer (1987–2017, nur dtJengl, nur „Literatur“) |
Davon in die EndNote exportiert für das TiAb Screening |
|
1) Mistel |
8 |
Suche nicht verwendet |
|
2) CAM |
8212 |
Suche nicht verwendet |
|
3) CAM + Krebs |
381 |
Suche nicht verwendet |
|
4) CAM + Krebs + Palliativ |
30 |
exportiert: 30 |
|
5) CAM + Krebs + Palliativ + Ethik |
2 Treffer |
Suche nicht verwendet |
|
6) CAM + Krebs + Ethik |
23 |
exportiert: 23 |
CAM = Komplementäre und alternative Medizin (engl. complementary and alternative medicine). CM = Komplementäre Medizin (engl. complementary medicine). TiAb = Titel und Abstract.
Ethicsweb
Die Suchmaske von Ethicsweb schränkt wie PhilPapers technisch die Durchführung komplexer Suchläufe ein. Auch ist es nicht möglich, die Ergebnisse automatisch in Endnote zu importieren, was einen erhöhten Arbeitsaufwand durch manuelle Übertragung der Literatur in Endnote mit sich bringt. Dennoch wurden sechs Suchläufe durchgeführt (vgl. Tabelle 99). Beim explorativen Screening der vielversprechendsten beiden Suchläufe (5 und 6) ist jedoch deutlich geworden, dass die damit erzielten Treffer keine Relevanz haben: Die meisten Treffer beschäftigten sich mit allgemeinen (ethischen) Fragen in der Palliativmedizin und waren daher zu unspezifisch für das Thema des HTA-Berichts. Es wurde daher entschieden, die Ethicsweb-Suchläufe nicht zu verwenden.
Tabelle 99: Suche Literatur zu ethischen Aspekten: Ethicsweb (13. Juni 2017)
Suchblöcke Suchstring
Mistel mistletoe OR mistel
CAM (Mistletoe OR Mistel OR ““Viscum album“”) OR (Iscador OR ““complementary
medicine”” OR Komplementärmedizin) OR (““integrative medicine”” OR ““integrative medizin””) OR (““Alternative Medicine”” OR Alternativmedizin)
CAM2 (““integrative medicine”” OR ““complementary medicine”” OR ““Alternative Medicine“”)
(ohne Mistel, verkürzt)
Krebs (cancer OR Krebs)
Palliativ (palliative OR palliativ)
Ethik (ethic* OR Ethik OR moral*)
|
Suchbegriffe |
Treffer (ohne Restriktion) |
Davon in die EndNote exportiert für das TiAb Screening |
|
1) Mistel |
3 |
Suche nicht verwendet |
|
2) CAM |
5000 |
Suche nicht verwendet |
|
3) CAM + Krebs |
1730 |
Suche nicht verwendet |
|
4) CAM + Krebs + Palliativ |
276 |
Suche nicht verwendet |
|
5) CAM + Krebs + Palliativ + Ethik |
71 |
Suche nicht verwendet |
|
6) CAM2 + Krebs + Palliativ + Ethik |
74 |
Suche nicht verwendet |
CAM = Komplementäre und alternative Medizin (engl. complementary and alternative medicine). CM = Komplementäre Medizin (engl. complementary medicine). TiAb = Titel und Abstract.
Die in den folgenden Tabellen in der zweiten Spalte angegebenen Ausschlussgründe orientieren sich an den Ein- und Ausschlusskriterien der Fragestellung der jeweiligen Domäne. Sie sind in Tabelle 10 bis Tabelle 13, sowie Tabelle 16, Tabelle 17 und Tabelle 21 spezifiziert. Genannt ist das Einschlusskriterium, das nicht erfüllt ist. Falls mehrere Einschlusskriterien nicht erfüllt waren, wurde nur eines genannt. Die Bezeichnung des Ausschlussgrunds mit Buchstabe und Zahl entspricht der Darstellung des Ausschlussgrunds im jeweiligen PRISMA-Flussdiagramm Abbildung 2 bis Abbildung 6. Bei der Bewertung der Wirksamkeit und Sicherheit der begleitenden Misteltherapie unterscheiden sich zum Teil die Ein- und Ausschlussgründe für die Studien, was darin resultieren kann, dass eine Studie für die eine Dimension ein‑, aber für die andere ausgeschlossen werden kann, was im PRISMAFlussdiagramm nicht ausreichend abgebildet werden kann, deshalb erfolgt eine getrennte Darstellung der Ausschlussgründe für die Volltexte (
Tabelle 102 und Tabelle 103). Sieben der Publikationen, die für die Bewertung der Sicherheit eingeschlossen wurden, sind in
Tabelle 102 enthalten mit dem Ausschlussgrund „A4*) Zielgröße“. Die zwei Publikationen, die nur in die Bewertung der Wirksamkeit eingeschlossen und bei der Bewertung der Sicherheit ausgeschlossen wurden, haben in Tabelle 103 ebenfalls den Ausschlussgrund „A4*) Zielgröße“.
Tabelle 100: Ausgeschlossene Leitlinien
|
Studie |
Ausschlussgrund |
|
ACOG. Management of gynecologic issues in women with breast cancer. American College of Obstetricians and Gynecologists 2012. |
A3) Methodik |
|
Adib SM, El Saghir NS, Ammar W. Guidelines for breast cancer screening in Lebanon Public Health Communication. Le Journal medical libanais The Lebanese Medical Journal 2009; 57(2): 72–74. |
A1) Thema |
|
AHQR. ACR Appropriateness Criteria® breast cancer screening. American College of Radiology 2012. |
A1) Thema |
|
AHRQ. Recommendations from the EGAPP Working Group: can tumor gene expression profiling improve outcomes in patients with breast cancer Evaluation of Genomic Applications in Practice and Prevention 2009. |
A1) Thema |
|
AHRQ. Comparative Effectiveness of Medications to Reduce Risk of Primary Breast Cancer in Women (AHRQ Research Review) 2009. |
A1) Thema |
|
AHRQ. Adjuvant ovarian ablation in the treatment of premenopausal women with early stage invasive breast cancer. Program in Evidence-based Care. NGC 2010. |
A1) Thema |
|
AHRQ. Breast cancer screening. American College of Obstetricians and Gynecologists 2011. |
A1) Thema |
|
AHRQ. ACR Appropriateness Criteria® non-spine bone metastases. American College of Radiology 2011. |
A1) Thema |
|
AHRQ. ACR Appropriateness Criteria® ductal carcinoma in situ. American College of Radiology 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
AHRQ. ACR Appropriateness Criteria® conservative surgery and radiationstage I and II breast carcinoma. American College of Radiology 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
AHRQ. Cancer screening. University of Michigan Health System 2012. |
A1) Thema |
|
AHRQ. American Cancer Society guidelines on nutrition and physical activity for cancer prevention 2012. |
A1) Thema |
|
AHRQ. ACR Appropriateness Criteria® postmastectomy radiotherapy. American College of Radiology 2012. |
A1) Thema |
|
AHRQ. ACR Appropriateness Criteria® palpable breast masses. American College of Radiology 2012. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
AHRQ. ACR Appropriateness Criteria® nonpalpable mammographic findings (excluding calcifications). American College of Radiology 2012. |
A1) Thema |
|
AHRQ. ACR Appropriateness Criteria® local regional recurrence (LRR) and salvage surgery–breast cancer. American College of Radiology 2013. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
AHS. Staging investigations for asymptomatic and newly diagnosed breast cancer 2012. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
AHS. Adjuvant Radiotherapy for Invasive Breast Cancer 2013. |
A1) Thema |
|
Arpino G, Marme F, Cortes J, Ricevuto E, Leonard R, Llombart-Cussac A. Tailoring the dosing schedule of nab-paclitaxel in metastatic breast cancer according to patient and disease characteristics: Recommendations from a panel of experts. Critical Reviews in Oncology/Hematology 2016; 99:81–90. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. American Society of Clinical Oncology 2007 Update of Recommendations for the Use of Tumor Markers in Breast Cancer 2007. |
A1) Thema |
|
ASCO. ASCO Endorsement of the CCO Practice Guideline on Adjuvant Ovarian Ablation in the Treatment of Premenopausal Women with Early Stage Invasive Breast Cancer 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. Breast Cancer Follow-Up and Management After Primary Treatment: American Society of Clinical Oncology Clinical Practice Guideline Update. 2013. |
A1) Thema |
|
ASCO. Chemo- and Targeted Therapy for Women with HER2 Negative (or unknown) Advanced Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. ASCO Endorsement of the SSO/ASTRO Consensus Guideline on Margins for Breast-Conserving Surgery with Whole-Breast Irradiation in Stage I and II Invasive Breast Cancer 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. Endocrine Therapy for Hormone Receptor-Positive Metastatic Breast Cancer: American Society of Clinical Oncology Guideline 2016. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. Adjuvant Endocrine Therapy for Women with Hormone Receptor-Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update on Ovarian Suppression 2016. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. ASCO-CAP Guideline Recommendations for Immunohistochemical Testing of Estrogen and Progesterone Receptors in Breast Cancer 2017. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASCO. ASCO Clinical Practice Guideline Update on the Role of Bone-Modifying Agents in Metastatic Breast Cancer 2017. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASTRO. Accelerated partial breast irradiation consensus statement from the American Society for Radiation Oncology (ASTRO) 2009. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
ASTRO. Fractionation for whole breast irradiation: An American Society for Radiation Oncology (ASTRO) evidence-based guideline 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Baber RJ, Panay N, Fenton A. 2016 IMS Recommendations on womens midlife health and menopause hormone therapy. Climacteric 2016; 19(2):109–50. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Balmana J, Diez O, Rubio IT, Cardoso F, Group EGW. BRCA in breast cancer: ESMO Clinical Practice Guidelines. Annals of oncology: official journal of the European Society for Medical Oncology 2011; 22 (Suppl 6): vi31-34. |
A1) Thema |
|
Bamber J, Cosgrove D, Dietrich CF, Fromageau J, Bojunga J, Calliada F, EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: Basic principles and technology. Ultraschall in der Medizin 2013; 34(2): 169–184. |
A1) Thema |
|
Belkacemi Y, Fourquet A, Cutuli B, Bourgier C, Hery M, Ganem G, Radiotherapy for invasive breast cancer: guidelines for clinical practice from the French expert review board of Nice/Saint-Paul de Vence. Critical Reviews in Oncology Hematology 2011; 79(2): 91–102. |
A1) Thema |
|
Ben-Aharon I, Gafter-Gvili A, Leibovici L, Stemmer S. Pharmacological interventions for fertility preservation during chemotherapy: a systematic review and meta-analysis (Structured abstract). Breast Cancer Research and Treatment [Internet] 2010; 122(3): 803–811. |
A1) Thema |
|
Berliner JC. NSGC practice guideline: risk assessment and genetic counseling for hereditary breast and ovarian cancer. National Society of Genetic Counselors 2013. |
A1) Thema |
|
Bese NS, Munshi A, Budrukkar A, Elzawawy A, Perez CA. Breast radiation therapy guideline implementation in low- and middle-income countries. Cancer 2008; 113(8 Suppl.): 2305–2314. |
A1) Thema |
|
Bevers TB, Anderson BO, Bonaccio E, Buys S, Daly MB, Dempsey PJ, NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis. Journal of the National Comprehensive Cancer Network: JNCCN 2009; 7(10): 1060–1096. |
A1) Thema |
|
Bevers TB, Armstrong DK, Arun B, Carlson RW, Cowan KH, Daly MB, Breast cancer risk reduction. Journal of the National Comprehensive Cancer Network: JNCCN 2010; 8(10): 1112–1146. |
A1) Thema |
|
Borneman T, Piper BF, Sun VC, Koczywas M, Uman G, Ferrell B. Implementing the Fatigue Guidelines at one NCCN member institution: process and outcomes. Journal of the National Comprehensive Cancer Network: JNCCN 2007; 5(10): 1092–1101. |
A1) Thema |
|
Boyle P. Triple-negative breast cancer: Epidemiological considerations and recommendations. Annals of Oncology. 2012. 23(SUPPL. 6):vi7-vi12. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
BQS. BQS Quality Indicators Mastectomy 2009. |
A1) Thema |
|
Burstein HJ, Temin S, Anderson H, Buchholz TA, Davidson NE, Gelmon KE, Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update. Journal of Clinical Oncology 2014; 32(21): 22552269. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of Trastuzumab (Herceptin®) for the treatment of HER2-positive breast cancer 2007. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of endocrine therapy for the treatment of hormone receptor-positive advanced breast cancer 2008. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of Taxane-containing chemotherapy regimens for the treatment of early (operable) breast cancer 2008. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of Sentinel node biopsy in early (operable) breast cancer 2008. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of chemotherapy for the treatment of advanced breast cancer 2010. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for follow-up of women with early breast cancer 2010. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of hypofractionated radiotherapy in early (operable) breast cancer 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of bisphosphonates in early breast cancer 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for use of bisphosphonates for advanced breast cancer 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for staging and managing the axilla in early (operable) breast cancer 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for the management of early breast cancer in women with an identified BRCA1 or BRCA2 gene mutation or at high risk of a gene mutation 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
CA. Recommendations for the management of central nervous system (CNS) metastases in women with secondary breast cancer 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Cardoso F, Costa A, Norton L, Senkus E, Aapro M, Andre F. ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2) dagger. Annals of oncology: official journal of the European Society for Medical Oncology 2014; 25(10): 1871–1888. |
A1) Thema |
|
Cardoso F, Costa A, Senkus E, Aapro M, Andre F, Barrios CH. 3rd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 3). Annals of oncology: official journal of the European Society for Medical Oncology 2017. |
A1) Thema |
|
Canadian Task Force on Preventive Health Care. Recommendations on screening for breast cancer in average-risk women aged 4^74 years. Canadian Task Force on Preventive Health Care 2011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Carlson RW, Allred DC, Anderson BO, Burstein HJ, Carter WB, Edge SB. Breast cancer: noninvasive and special situations. Journal of the National Comprehensive Cancer Network: JNCCN 2010; 8(10): 1182–1207. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Carlson RW, Allred DC, Anderson BO, Burstein HJ, Edge SB, Farrar WB. Metastatic breast cancer, version 1.2012: featured updates to the NCCN guidelines. Journal of the National Comprehensive Cancer Network: JNCCN 2012; 10(7): 821–829. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Chynoweth J, Norris S, Anderson K, Zorbas H. Updated recommendations for the use of hypofractionated radiotherapy for early (operable) breast cancer. Asia-Pacific Journal of Clinical Oncology 2015; 11: 71. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Dayes I. The role of IMRT in breast cancer. Program in Evidence-based Care 2010. |
A1) Thema |
|
Deffieux X, Rochambeau B, Chene G, Gauthier T, Huet S, Lamblin G. Hysterectomy for benign disease: clinical practice guidelines from the French College of Obstetrics and Gynecology. European journal of obstetrics, gynecology, and reproductive biology 2016; (202): 83–91. |
A1) Thema |
|
Denduluri N, Somerfield MR, Eisen A, Holloway JN, Hurria A, King TA. Selection of optimal adjuvant chemotherapy regimens for human epidermal growth factor receptor 2 (HER2) ‑negative and adjuvant targeted therapy for HER2-positive breast cancers: An American Society of Clinical Oncology Guideline Adaptation of the Cancer Care Ontario Clinical Practice Guideline. Journal of Clinical Oncology 2016; 34(20): 2416–2427. |
A1) Thema |
|
Dent S, Messersmith H, Trudeau M. Gemcitabine in the management of metastatic breast cancer: a systematic review (Structured abstract). Breast Cancer Research and Treatment 2008; 108(3): 319–331. |
A1) Thema |
|
Dhesy-Thind S, Fletcher GG, Blanchette PS, Clemons MJ, Dillmon MS, Frank ES. Use of Adjuvant Bisphosphonates and Other Bone-Modifying Agents in Breast Cancer: A Cancer Care Ontario and American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology 2017. |
A1) Thema |
|
Eisen A, Trudeau M, Shelley W, Messersmith H, Pritchard KI. Aromatase inhibitors in adjuvant therapy for hormone receptor positive breast cancer: a systematic review (Structured abstract). Cancer Treatment Reviews [Internet]. 2008. 34(2):157–74. |
A1) Thema |
|
Flemming J, Madarnas Y, Franek J. Fulvestrant for systemic therapy of locally advanced or metastatic breast cancer in postmenopausal women: guideline recommendations (Structured abstract). Database of Abstracts of Reviews of Effects [Internet] 2008. 2008(2). |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Freeman L, Cohen L, Stewart M, White R, Link J, Palmer JL, The experience of imagery as a post-treatment intervention in patients with breast cancer: Program, process, and patient recommendations. Oncology Nursing Forum. 2008. 35(6): E116-E21. |
A1) Thema |
|
Giordano SH. Systemic Therapy for Patients with Advanced Human Epidermal Growth Factor Receptor 2‑Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline. 2014. |
A1) Thema |
|
Golubnitschaja O, Costigliola V. General Report & Recommendations in Predictive, Preventive and Personalised Medicine 2012: White Paper of the European Association for Predictive, Preventive and Personalised Medicine. EPMA Journal 2012; 3 (1): 14. |
A1) Thema |
|
Gradishar WJ, Anderson BO, Balassanian R, Blair SL, Burstein HJ, Cyr A, NCCN Guidelines Insights: Breast Cancer, Version 1.2017. Journal of the National Comprehensive Cancer Network: JNCCN 2017; 15(4): 433–451. |
A1) Thema |
|
Griggs JJ, Somerfield MR, Anderson H, Henry NL, Hudis CA, Khatcheressian JL, American Society of Clinical Oncology endorsement of the cancer care Ontario practice guideline on adjuvant ovarian ablation in the treatment of premenopausal women with early-stage invasive breast cancer. Journal of Clinical Oncology 2011; 29(29): 3939–3942. |
A1) Thema |
|
Hanf V, Schutz F, Liedtke C, Thill M. AGO Recommendations for the Diagnosis and Treatment of Patients with Early Breast Cancer: Update 2015 on behalf of the AGO Breast Committee. Breast Care 2015; 10(3): 189–197. |
A4) Verweis auf andere Guideline |
|
Harford J. Guideline implementation for breast healthcare in low-income and middle-income countries. Breast Health Global Initiative 2008. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Harris LN, Ismaila N, McShane LM, Andre F, Collyar DE, Gonzalez-Angulo AM, Use of Biomarkers to Guide Decisions on Adjuvant Systemic Therapy for Women with Early-Stage Invasive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology 2016. 34(10): 1134–1150. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Hattangadi JA, Taback N, Neville BA, Harris JR, Punglia RS. Accelerated partial-breast irradiation using brachytherapy (APBIb) for breast cancer (BCA): Predictors of use and guideline concordance. Journal of Clinical Oncology Conference: ASCO Annual Meeting 2011. 29(15 Suppl. 1). |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Henry NL. Role of Patient and Disease Factors in Adjuvant Systemic Therapy Decision Making for Early-Stage, Operable Breast Cancer: American Society of Clinical Oncology Endorsement of Cancer Care Ontario Guideline Recommendations 2016. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Hensley ML, Hagerty KL, Kewalramani T, Green DM, Meropol NJ, Wasserman TH. American society of clinical oncology 2008 clinical practice guideline update: Use of chemotherapy and radiation therapy protectants. Journal of Clinical Oncology 2009; 27(1): 127–145. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Holt S, Gilbey A. A survey of New Zealand General Practitioners’ understanding of CAM therapies and recommendations they make. Focus on Alternative and Complementary Therapies 2011; 16(2): 189–190. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Huebner J, Follmann M. Complementary medicine in guidelines of the German Guideline Program in Oncology: Comparison of the evidence base between complementary and conventional therapy. Journal of Cancer Research and Clinical Oncology 2013; 139(9): 1481–1488. |
A3) Methodik |
|
Husain AN, Colby T, Ordonez N, Krausz T, Attanoos R, Beasley MB. Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Archives of pathology & laboratory medicine 2012; 137(5): 647–667. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Husain AN, Colby TV, Ordonez NG, Krausz T, Borczuk A, Cagle PT. Guidelines for pathologic diagnosis of malignant mesothelioma: a consensus statement from the International Mesothelioma Interest Group. Archives of pathology & laboratory medicine 2009; 133(8): 1317–1331. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
IQWiG. Systematic guideline search and appraisal, as well as extraction of new and relevant recommendations for the DMP Breast cancer 2008. |
A4) Verweis auf andere Guideline |
|
IQWiG. Autologe Stammzelltransplantation beim Mammakarzinom 2009. |
A1) Thema |
|
IQWiG, Determination of antigen expression levels of uPA and PAI‑1 in primary breast cancer with intermediate recurrence risk after R0 primary surgery 2014. |
A1) Thema |
|
Kommission Mamma (vertreten durch: Wolfgang Janni) der Arbeitsgemeinschaft Gynäkologische Onkologie e. V. in der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe e. V., als Teil der Deutschen Krebsgesellschaft e. V. Diagnostik und Therapie von Patientinnen mit primärem und metastasiertem Brustkrebs 2018. |
A3) Methodik |
|
Kanal KM, Krupinski E, Berns EA, Geiser WR, Karellas A, Mainiero MB, Martin MC, Patel SB, Rubin DL, Shepard JD, Siegel EL, Wolfman JA, Mian TA, Mahoney MC. ACR-AAPM-SIIM practice guideline for determinants of image quality in digital mammography. Journal of Digital Imaging 2013; 26(1): 10–25. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Kienle G, Glockmann A, Schink M, Kiene H. Viscum album L. extracts in breast and gynaecological cancers: a systematic review of clinical and preclinical research (Structured abstract). Journal of Experimental and Clinical Cancer Research 2009; 2009(28): 79. |
A3) Methodik |
|
Kümmel S, Hanf V. Komplementäre Therapie „Survivorship“, in Diagnosis and Treatment of Patients with Primary and Metastatic Breast Cancer. Recommendations 2018. AGO Breast Committee (Hrsg.) 2018. |
A4) Verweis auf andere Guideline |
|
Klionsky DJ, Abdelmohsen K, Abe A, Abedin MJ, Abeliovich H; Acevedo Arozena A, Adachi H. et al.* Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy 2016. 12(1): 1222. |
A1) Thema |
|
Levy DE, Garber JE Shields AE. Guidelines for genetic risk assessment of hereditary breast and ovarian cancer: early disagreements and low utilization. Journal of General Internal Medicine 2009; 24(7): 822–828. |
A1) Thema |
|
Lin A, Rugo HS. The role of trastuzumab in early stage breast cancer: Current data and treatment recommendations. Current Treatment Options in Oncology 2007; 8(1): 47–60. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Lindsay J, Dooley M, Martin J, Fay M, Kearney A, Khatun M, and Barras M. The development and evaluation of an oncological palliative care deprescribing guideline: the ‘OncPal deprescribing guideline’. Supportive Care in Cancer 2015; 23(1): 71–78. |
A3) Methodik |
|
Lu W, Hu D, Dean-Clower E, Doherty-Gilman A, Legedza AT, Lee H, Matulonis U, Rosenthal DS. Acupuncture for chemotherapy-induced leukopenia: exploratory meta-analysis of randomized controlled trials (Structured abstract). Journal of the Society for Integrative Oncology 2007; 2007(5): 1–10. |
A1) Thema |
|
Madarnas Y. The continued use of trastuzumab beyond disease progression in patients with metastatic breast cancer. Program in Evidence-based Care 2009. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Martinez-Janez N, Chacon I, De Juan A, Cruz-Merino L, Del Barco S, Fernandez I, Garcia-Teijido P, Gomez-Bernal A, Plazaola A, Ponce J, Servitja S, Zamora P. Anti-HER2 Therapy beyond Second-Line for HER2-Positive Metastatic Breast Cancer: A Short Review and Recommendations for Several Clinical Scenarios from a Spanish Expert Panel. Breast Care 2016; 11(2): 133–138. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Mitchell AL, Gandhi A, Scott-Coombes D, Perros P. Management of thyroid cancer: United Kingdom National Multidisciplinary Guidelines. Journal of Laryngology & Otology 2016; 130(S2): 150–160. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Moran MS, on behalf of the Society of Surgical Oncology-American Society for Radiation. Oncology Consensus Guideline on Margins for Breast-Conserving Surgery with Whole-Breast Irradiation in Stages I and II Invasive Breast Cancer 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Moseley AL, Carati CJ, Piller NB. A systematic review of common conservative therapies for arm lymphoedema secondary to breast cancer treatment (Structured abstract). Annals of Oncology 2007. 18: 639–646. |
A1) Thema |
|
Moyer VA. Medications to decrease the risk for breast cancer in women: recommendations from the U.S. Preventive Services Task Force recommendation statement. Annals of Internal Medicine 2013; 159(10): 698–708. |
A1) Thema |
|
Mukai H, Aihara T, Yamamoto Y, Takahashi M, Toyama T, Sagara Y, Yamaguchi H, Akabane H, Tsurutani J, Hara F, Fujisawa T, Yamamoto N, Ohsumi S. The Japanese Breast Cancer Society Clinical Practice Guideline for systemic treatment of breast cancer. Breast Cancer 2015; 22(1): 5–15. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NCCN. Breast Cancer – Early Stage – Stages I and II – Version 1.2016; NCCN Guidelines for Patients. 2016. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NCCN. Breast Cancer Carcinoma in Situ – Stage 0 – Version 1.2016; NCCN Guidelines for Patients. 2016. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NCCN. Breast Cancer – Locally Advanced – Stage III – Version 1.2017. NCCN Guidelines for Patients. 2017. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NCCN. Breast Cancer – Metastatic – Stage IV – Version 2.2017. NCCN Guidelines for Patients. 2017. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NICE. Breast cancer (early & locally advanced) (CG80). 2009. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NICE. Familial breast cancer (CG164). 2013. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
NICE. Breast cancer (advanced) (CG81). 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Nofech-Mozes S, Vella ET, Dhesy-Thind S, Hanna WM. Cancer care Ontario guideline recommendations for hormone receptor testing in breast cancer. Clinical Oncology Journal (The Royal College of Radiologists) 2012; 24(10): 684–696. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Nomura SJO, Dash C, Rosenberg L, Yu J, Palmer JR, Adams-Campbell LL. Is adherence to the WCRF/AICR cancer prevention recommendations associated with colorectal cancer in African American women in the Black Women’s Health Study. Cancer Research. Conference: 107th Annual Meeting of the American Association for Cancer Research (AACR) 2016; 76(14) (Suppl.). |
A1) Thema |
|
Oeffinger KC, Fontham ET, Etzioni R, Herzig A, Michaelson JS, Shih YC, Walter LC, Church TR, Flowers CR, LaMonte SJ, Wolf AM, DeSantis C, Lortet-Tieulent J, Andrews K, Manassaram-Baptiste D, Saslow D, Smith RA, Brawley OW, Wender R. Breast Cancer Screening for Women at Average Risk: 2015 Guideline Update From the American Cancer Society. Jama 2015; 314(15): 1599–614. |
A1) Thema |
|
Ortmann O, Doren M, Windler E. Hormone therapy in perimenopause and postmenopause (HT): Interdisciplinary S3 guideline, Association of the Scientific Medical Societies in Germany AWMF 015/062-short version. Archives of Gynecology and Obstetrics 2011; 284(2): 343–355. |
A1) Thema |
|
Perez-Lopez FR, Ceausu I, Depypere H, Erel CT, Lambrinoudaki I, Rees M, Schenck-Gustafsson K, Tremollieres F, van der Schouw YT, Simoncini T. EMAS clinical guide: vulvar lichen sclerosus in peri and postmenopausal women. Maturitas 2013; 74(3): 279–282. |
A1) Thema |
|
Persing M, Grosse R. Current St. Gallen recommendations on primary therapy of early breast cancer. Breast Care 2007; 2(3): 137–140. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Pestalozzi BC, Tausch C, Dedes KJ, Rochlitz C, Zimmermann S, von Moos R, Winterhalder RC, Ruhstaller T, Mueller A, Buser KS, Borner MM, Novak U, Uhlmann Nussbaum C, Seifert B, Bigler M, Bize V, Berardi Vilei S, Rageth C, Aebi SP. Adjuvant treatment recommendations for ER+ early breast cancer patients by Swiss tumor boards (SAKK 26/10). European Journal of Cancer 2015; 51: S313. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Petru, E., Zeimet AG, Sevelda P, Seifert M, Singer C, Hubalek M, Angleitner-Boubenizek L, Speiser P, Benedicic C, Stummvoll W, Reinthaller A. Austrian Arbeitsgemeinschaft für Gynakologische Onkologie (AGO) guideline for prophylaxis with granulocyte colony-stimulating factors (G‑CSF) in gynecologic malignancies, including breast cancer. Wiener Klinische Wochenschrift 2012; 124(11–12): 412–418. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Rakha EA, Pinder SE, Bartlett JM, Ibrahim M, Starczynski J, Carder PJ, Provenzano E, Hanby A, Hales S, Lee AH, Ellis IO. Updated UK Recommendations for HER2 assessment in breast cancer. Journal of Clinical Pathology 2015; 68(2): 93–99. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Ramakrishna N. Recommendations on Disease Management for Patients with Advanced Human Epidermal Growth Factor Receptor 2‑Positive Breast Cancer and Brain Metastases: American Society of Clinical Oncology Clinical Practice Guideline. 2014. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Razavi AR, Gill H, Ahlfeldt H, Shahsavar N. A data mining approach to analyze non-compliance with a guideline for the treatment of breast cancer. Medinfo 2007. 12(Pt 1): 591–595. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Reid R, Abramson BL, Blake J, Desindes S, Dodin ‑S, Johnston S, Rowe T, Sodhi N, Wilks P, Wolfman W. Managing menopause. Journal of Obstetrics and Gynaecology Canada 2014. 36(9): 830–833. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Rizzoli R, Body JJ, DeCensi A, Reginster JY, Piscitelli P, Brandi ML. Guidance for the prevention of bone loss and fractures in postmenopausal women treated with aromatase inhibitors for breast cancer: an ESCEO position paper. Osteoporose International 2012; 23(11): 2567–2576. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Robays J. Oncogenetic testing and follow-up for women with familial breast/ovarian cancer, Li Fraumeni syndrome and Cowden syndrome. 2015. |
A1) Thema |
|
Rock CL. Nutrition and physical activity guidelines for cancer survivors. American Cancer Society. 2012. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Roila F, Molassiotis A, Herrstedt J, Aapro M, Gralla RJ, Bruera E, Clark-Snow RA, Dupuis LL, Einhorn LH, Feyer P, Hesketh PJ, Jordan K, Olver I, Rapoport BL, Roscoe J, Ruhlmann CH, Walsh D, Warr D, van der Wetering M, stellvertretend für die Teilnehmer der Mascc Esmo Consensus Conference Kopenhagen 2016. MASCC and ESMO guideline update for the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients. Annals of Oncology 2016; 27: v119-v133. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Runowicz CD, Leach CR, Henry NL, Henry KS, Mackey HT, Cowens-Alvarado RL, Cannady RS, Pratt-Chapman ML, Edge SB, Jacobs LA, Hurria A, Marks LB, LaMonte SJ, Warner E, Lyman GH, Ganz PA. American Cancer Society/American Society of Clinical Oncology Breast Cancer Survivorship Care Guideline. Journal of Clinical Oncology 2016; 34(6): 611–635. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
SCAN. Singapore Cancer Network (SCAN) Guidelines for Adjuvant Trastuzumab Use in Early Stage HER2 Positive Breast Cancer. Annals Academy of Medicine Singapore 2015; 44(10): 360–367. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
SCAN. Singapore Cancer Network (SCAN) Guidelines for Bisphosphonate Use in the Adjuvant Breast Cancer Setting. Annals Academy of Medicine Singapore 2015; 44(10): 368–378. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
SCAN. Singapore Cancer Network (SCAN) Guidelines for Referral for Genetic Evaluation of Common Hereditary Cancer Syndromes. Annals Academy of Medicine Singapore 2015; 44(10): 492–510. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Schenck-Gustafsson K, Brincat M, Erel CT, Gambacciani M, Lambrinoudaki I, Moen MH, Tremollieres F, Vujovic S, Rozenberg S, Rees M. EMAS position statement: Managing the menopause in the context of coronary heart disease. Maturitas 2011; 68(1): 94–97. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Sedlmayer F, Sautter-Bihl ML, Budach W, Dunst J, Fastner G, Feyer P, Fietkau R, Haase W, Harms W, Souchon R, Wenz F, Sauer R. DEGRO practical guidelines: radiotherapy of breast cancer I: radiotherapy following breast conserving therapy for invasive breast cancer. Strahlentherapie und Onkologie 2013; 189(10): 825–833. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Senkus E, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rutgers E, Zackrisson S, Cardoso F, ESMO Guidelines Committee. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2015; 26(Suppl. 5): 8–30. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Shaitelman SF, Lin H, Shen Y, Bedrosian I, Bloom ES, Babiera G. Utilization of accelerated partial-breast irradiation (APBI) and guideline concordance: Analysis of the National Cancer Database. Journal of Clinical Oncology 2013; 31(26 Suppl. 1). |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
SIGN. Treatment of primary breast cancer. 2013. |
A3) Methodik |
|
Simos D, Hutton B, Graham ID, Caudrelier JM, Arnaout A, Clemons M. Staging imaging for metastatic disease in patients with early-stage breast cancer: What do physicians think of the ASCO top‑5 recommendation? Journal of Clinical Oncology 2014; 32(15 Suppl. 1). |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Smith K, Pukall C. An evidence-based review of yoga as a complementary intervention for patients with cancer (Structured abstract). Psycho-Oncology, 2009; 18:465–475. |
A1) Thema |
|
Smith L, Cornelius V, Plummer C, Levitt G, Verrill M, Canney P, Jones A. Cardiotoxicity of anthracycline agents for the treatment of cancer: systematic review and meta-analysis of randomised controlled trials (Structured abstract). BMC Cancer 2010; 10: 337. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Souchon R, Wenz F, Sedlmayer F, Budach W, Dunst J, Feyer P, Haase W, Harms W, Sautter-Bihl ML, Sauer R. DEGRO practice guidelines for palliative radiotherapy of metastatic breast cancer: bone metastases and metastatic spinal cord compression (MSCC). Strahlentherapie und Onkologie 2009; 185(7): 417–424. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Starczynski J, Atkey N, Connelly Y, O’Grady T, Campbell FM, di Palma S, Wencyk P, Jasani B, Gandy M, Bartlett JM. HER2 gene amplification in breast cancer: a rogues’ gallery of challenging diagnostic cases: UKNEQAS interpretation guidelines and research recommendations. Americal Journal of Clinical Oncology 2012; 137(4): 595–605. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Stuenkel CA, Davis SR, Gompel A, Lumsden MA, Murad MH, Pinkerton JV, Santen RJ. Treatment of Symptoms of the Menopause: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism 2015; 100(11): 3975–4011. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Stuenkel CA, Santen RJ. An introduction to the Endocrine Society Clinical Practice Guideline on treatment of symptoms of the menopause. Post Reproductive Health 2016; 22(1): 6–8. |
A1) Thema |
|
Sturgeon CM, Duffy MJ, Stenman UH, Lilja H, Brunner N, Chan DW, Babaian R, Bast RC Jr., Dowell B, Esteva FJ, Haglund C, Harbeck N, Hayes DF, Holten-Andersen M, Klee GG, Lamerz R, Looijenga LH, Molina R, Nielsen HJ, Rittenhouse H, Semjonow A, Shih Ie M, Sibley P, Soletormos G, Stephan C, Sokoll L, Hoffman BR, Diamandis EP. National Academy of Clinical Biochemistry laboratory medicine practice guidelines for use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers. Clinical Chemistry 2008; 54(12): e11-79. |
A1) Thema |
|
Tangjitgamol S, Anderson BO, See HT, Lertbutsayanukul C, Sirisabya N, Manchana T, Ilancheran A, Lee KM, Lim SE, Chia YN, Domingo E, Kim YT, Lai CH, Dali AZ, Supakapongkul W, Wilailak S, Tay EH, Kavanagh J. Management of endometrial cancer in Asia: consensus statement from the Asian Oncology Summit 2009. Lancet Oncology 2009; 10(11): 1119–1127. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Thomssen C, AGO recommendations for the diagnosis and therapy of breast cancer. Breast Care 2007; 2(4): 244–250. |
A4) Verweis auf andere Guideline |
|
Thuerlimann B, Koeberle D, Senn HJ. Guidelines for the adjuvant treatment of postmenopausal women with endocrine-responsive breast cancer: Past, present and future recommendations. European Journal of Cancer 2007; 43(1): 46–52. |
A1) Thema |
|
Umemura S., Kurosumi M, Moriya T, Oyama T, Arihiro K, Yamashita H, Umekita Y, Komoike Y, Shimizu C, Fukushima H, Kajiwara H, Akiyama F. Recommendations for ‘adequate evaluation of hormone receptors’ a report of the task force of the Japanese Breast Cancer Society. Oncology Reports 2010; 24(2): 299–304. |
A1) Thema |
|
U.S. Preventive Services Task Force. Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement. Annals of internal medicine 2009; 151(10):716–26, w‑236. |
A1) Thema |
|
U.S. Preventive Services Task Force. Medications for risk reduction of primary breast cancer in women: U.S. Preventive Services Task Force recommendation statement. U.S. Preventive Services Task Force 2013. |
A1) Thema |
|
Van Ewijk R, Wockel A, Gundelach T, Hancke K, Janni W, Singer S, Kreienberg R, Blettner M, Schwentner L. Is guideline-adherent adjuvant treatment an equal alternative for patients aged >65 who cannot participate in adjuvant clinical breast cancer trials? A retrospective multi-center cohort study of 4,142 patients. Archives of Gynecology and Obstetrics 2015; 291(3): 631–640. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Van Poznak C, Somerfield MR, Bast RC, Cristofanilli M, Goetz MP, Gonzalez-Angulo AM, Hicks DG, Hill EG, Liu MC, Lucas W, Mayer IA, Mennel RG, Symmans WF, Hayes DF, Harris LN. Use of Biomarkers to Guide Decisions on Systemic Therapy for Women with Metastatic Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology 2015; 33(24): 2695–2704. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Vanderpool RC, Swanberg JE, Chambers MD. A narrative review of the confluence of breast cancer and low-wage employment and its impact on receipt of guideline-recommended treatment. Global Advances In Health and Medicine 2013; 2(5): 75–85. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Van Goethem M. Magnetic Resonance Imaging in Breast Cancer. European Journal of Surgical Oncology 2006; 32(9): 901–910. |
A1) Thema |
|
Visvanathan K, Chlebowski RT, Hurley P, Col NF, Ropka M, Collyar D, Morrow M, Runowicz C, Pritchard KI, Hagerty K, Arun B, Garber J, Vogel VG, Wade JL, Brown P, Cuzick J, Kramer BS, Lippman SM. American society of clinical oncology clinical practice guideline update on the use of pharmacologic interventions including tamoxifen, raloxifene, and aromatase inhibition for breast cancer risk reduction. Journal of Clinical Oncology 2009; 27(19): 3235–3258. |
A1) Thema |
|
Visvanathan K, Chlebowski RT, Hurley P, Col NF, Ropka M, Collyar D, Morrow M, Runowicz C, Pritchard KI, Hagerty K, Arun B, Garber J, Vogel VG, Wade JL, Brown P, Cuzick J, Kramer BS, Lippman SM. Use of Pharmacologic Interventions for Breast Cancer Risk Reduction: American Society of Clinical Oncology Clinical Practice Guideline. Journal of Clinical Oncology 2013; 31(23): 2942–2962. |
A1) Thema |
|
Webber L, Davies M, Anderson R, Bartlett J, Braat D, Cartwright B, Cifkova R, De Muinck Keizer-Schrama S, Hogervorst E, Janse F, Liao L, Vlaisavljevic V, Zillikens C, Vermeulen N. ESHRE Guideline: Management of women with premature ovarian insufficiency. Human Reproduction 2016; 31(5): 926–937. |
A1) Thema |
|
Weltens C. Guideline-based contouring and clinical audit systems. Radiotherapy and Oncology 2016; 119: S135-S136. |
A2) Keine integrative, komplementäre oder alternative Medizin oder Misteltherapie |
|
Whiley PJ, De La Hoya M, Thomassen M, Becker A, Brandao R, Pedersen IS, Montagna M, Menendez M, Quiles F, Gutierrez-Enriquez S, Leeneer KD, Tenes A, Montalban G, Tserpelis D, Yoshimatsu T, Tirapo C, Raponi M, Caldes T, Blanco A, Santamarina M, Guidugli L, De Garibay GR, Wong M, Tancredi M,Fachal L, Ding YC, Kruse T, Lattimore V, Kwong A, Chan TL, Colombo M, De Vecchi G, Caligo M, Baralle D, Lazaro C, Couch F, Radice P, Southey MC, Neuhausen S, Houdayer C, Fackenthal J, Van Overeem Hansen T, Vega A, Diez O, Blok R, Claes K, Wappenschmidt B, Walker L, Spurdle AB, Brown MA. Comparison of mRNA splicing assay protocols across multiple laboratories: Recommendations for best practice in standardized clinical testing. Clinical Chemistry 2014; 60(2): 341–352. |
A1) Thema |
|
Winnefeld M, Bruggemann S. Practice guideline for breast cancer rehabilitation from the perspective of the rehabilitation centres: findings of a user survey on acceptance and practicability of the pilot version. Rehabilitation (Stuttgart) 2008; 47(6): 334–342. |
A1) Thema |
|
Witt CM, Cardoso MJ. Complementary and integrative medicine for breast cancer patients – Evidence based practical recommendations. Breast 2016; 28: 37–44. |
A3) Methodik |
|
Wolff AC, Hammond MEH, Hicks DG, Dowsett M, McShane LM, Allison KH, Allred DC, Bartlett JMS, Bilous M, Fitzgibbons P, Hanna W, Jenkins RB, Mangu PB, S. Paik S, Perez EA, Press MF, Spears PA, Vance GH, Viale G, Hayes DF. Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Update. Journal of Clinical Oncology 2013; 31(31): 3997–4013. |
A1) Thema |
|
Wolff AC, Hammond MEH, Hicks DG, Dowsett M, McShane LM, Allison KH, Allred DC, Bartlett JMS, Bilous M, Fitzgibbons P, Hanna W, Jenkins RB, Mangu PB, S. Paik S, Perez EA, Press MF, Spears PA, Vance GH, Viale G, Hayes DF. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American society of clinical oncology/college of American pathologists clinical practice guideline update. Archives of Pathology and Laboratory Medicine 2014; 138(2): 241256. |
A1) Thema |
|
Wong NS, Anderson BO, Khoo KS, Ang PT, Yip CH, Lu JS, Voravud N, Shao ZM Pritchard KI. Management of HER2-positive breast cancer in Asia: consensus statement from the Asian Oncology Summit 2009. Lancet Oncology 2009; 10(11): 1077–1085. |
A1) Thema |
|
World Health Oranizaton (WHO). WHO Position Paper on Mammography Screening. Geneva 2014. |
A1) Thema |
*Die Leitlinie von Klionsky et al. hat sehr viele Autoren, deswegen war eine Nennung aller nicht möglich.
Tabelle 101: Durchgesehene systematische Reviews
|
Studie |
Ausschlussgrund |
|
Ernst E, Schmidt K, Steuer-Vogt MK. Mistletoe for cancer? A systematic review of randomised clinical trials. Int J Cancer 2003; 107(2): 262–267. |
Durchsicht erfolgt |
|
Horneber M, Bueschel G, Huber R, Linde K, Rostock M. Mistletoe therapy in oncology. Cochrane Database of Systematic Reviews 2008. 2008(2). |
Durchsicht erfolgt |
|
Kienle G, Glockmann A, Schink M, Kiene H. Viscum album L. extracts in breast and gynaecological cancers: a systematic review of clinical and preclinical research. Journal of Experimental and Clinical Cancer Research 2009; 28(1): 79. |
Durchsicht erfolgt |
|
Kienle GS, Berrino F, Büssing A, Portalupi E, Rosenzweig S, Kiene H. Mistletoe in cancer: a systematic review on controlled clinical trials. European Journal of Medical Research 2003; 8(3): 109–119. |
Durchsicht erfolgt |
|
Kienle GS, Kiene H. Complementary cancer therapy: a systematic review of prospective clinical trials on anthroposophic mistletoe extracts. European Journal of Medical Research 2007; 12(3): 103–119. |
Durchsicht erfolgt |
|
Kienle GS, Kiene H. Influence of Viscum album L (European Mistletoe) Extracts on Quality of Life in Cancer Patients: A Systematic Review of Controlled Clinical Studies. Integrative Cancer Therapies 2010. 9(2): 142–157. |
Durchsicht erfolgt |
|
Ostermann T, Raak C, Büssing A. Survival of cancer patients treated with mistletoe extract (Iscador): A systematic literature review. BMC Cancer 2009; 9(451). |
Durchsicht erfolgt |
|
Shneerson C, Taskila T, Gale N, Greenfield S, Chen Y‑F. The effect of complementary and alternative medicine on the quality of life of cancer survivors: A systematic review and meta-analyses. Complementary Therapies in Medicine 2013; 21(4): 417–429. |
Durchsicht erfolgt |
|
Sood A, Barton DL, Bauer BA, Loprinzi CL. A critical review of complementary therapies for cancer-related fatigue. Integrative Cancer Therapies 2007; 6(1): 8–13. |
Durchsicht erfolgt |
|
Studie |
Ausschlussgrund |
|
Ahn JH, Kim SB, Yun MR, Lee JS, Kang YK, Kim WK. Alternative therapy and abnormal liver function during adjuvant chemotherapy in breast cancer patients. Journal of Korean Medical Science 2004; 19(3): 397–400. |
A2) Intervention |
|
Anonymous. Preparations from mistletoe extracts, vitamins and trace elements are very popular among women with breast cancer. [Deutsch]. Ärztezeitschrift für Naturheilverfahren und Regulationsmedizin 2004; 45(3): 134. |
A5) Thema der Publikation |
|
Anonymous. Neue Studie: Iscador® verbessert die Lebensqualität für Brustkrebspatientinnen während einer Chemotherapie. Schweizerische Zeitschrift für Ganzheitsmedizin 2010; 22(1): 20. |
A8) Publikationstyp |
|
Auerbach L, Dostal V, Vaclavik-Fleck I, Kubista E, Rosenberger A, Rieger Sea. Signifikant höherer Anteil aktivierter NK-Zellen durch additive Misteltherapie bei chemotherapierten Mamma-Ca-Patientinnen in einer prospektiven randomisierten doppelblinden Studie. In: Scheer R, Bauer R, Becker H, Fintelmann V, Kemper F, Schilcher H (Hrsg.). Fortschritte in der Misteltherapie. Aktueller Stand der Forschung und klinischen Anwendung 2005: 567–578. |
A9) Population sehr klein |
|
Baraya YS, Wong KK, Yaacob NS. The immunomodulatory potential of selected bioactive plant-based compounds in breast cancer: A review. Anti Cancer Agents in Medicinal Chemistry 2016; 2016(16). |
A4) Zielgröße |
|
Beuth J. Evidence-based complementary medicine in breast cancer therapy. Breast Care 2009; 4(1): 8–12. |
A6) Studientyp |
|
Beuth J, Schierholz JM. Evidence-based complementary oncology. Innovative approaches to optimize standard therapy strategies. In Vivo 2007. 21(2): 423–428. |
A6) Studientyp |
|
Beuth J, Schneider B, Schierholz JM. Impact of complementary treatment of breast cancer patients with standardized mistletoe extract during aftercare: a controlled multicenter comparative epidemiological cohort study. Anticancer research [Internet] 2008. 28(1b): 523–527. |
A6) Studientyp |
|
Bock PR, Friedel WE, Hanisch J, Karasmann M, Schneider B. Wirksamkeit und Sicherheit der komplementären Langzeitbehandlung mit einem standardisierten Extrakt aus Europäischer Mistel (Viscum album L.) zusätzlich zur konventionellen adjuvanten onkoligischen Therapie bei primärem, nicht metastasiertem Mammakarzinom. Drug Research 2004; 54(8): 456–466. |
A4*) Zielgröße |
|
Bock PR, Friedel WE, Hanisch J, Karasmann M, Schneider B. Retrolective, comparative, epidemiological cohort study with parallel groups design for evaluation of efficacy and safety of drugs with ‘well-established use’: Experience with the long-term treatment using the European mistletoe extract (Viscum album L.) in addition to conventional oncological therapy in primary, non-metastatic breast carcinoma. Forschende Komplementärmedizin und Klassische Naturheilkunde 2004; 11(Suppl. 1): 23–29. |
A4*) Zielgröße |
|
Borrelli E. Evaluation of the quality of life in breast cancer patients undergoing lectin standardized mistletoe therapy. Minerva Medica 2001; 92(Suppl. 1): 105–107. |
A7) Volltext nicht verfügbar |
|
Bruns F, Glatzel M, Schonekaes K, Riesenbeck D, Mucke R, Buntzel J, Micke P, Schafer U, Kisters K, Micke O. Complementary and alternative medicine experience in radiation oncology patients: First results of a multi-center approach. Trace Elements and Electrolytes 2006; 23(4): 318–325. |
A5) Thema der Publikation |
|
Buntzel J, Mucke R, Bruns F, Micke O. Complementary and alternative medicine in cancer patients. European Journal of Oncology Pharmacy 2008; 2(2): 12–13. |
A5) Thema der Publikation |
|
Büssing A, Raak C, Ostermann T. Quality of life and related dimensions in cancer patients treated with mistletoe extract (Iscador): A meta-analysis. Evidence-based Complementary and Alternative Medicine 2012; 2012: 219402. |
A1) Population |
|
Eisenbraun J, Scheer R, Kröz M, Schad F, Huber R. Quality of life in breast cancer patients during chemotherapy and concurrent therapy with a mistletoe extract. Phytomedicine 2011; 18(2/3): 151–157. |
A4*) Zielgröße |
|
Greenlee H, Kwan ML, Ergas IJ, Sherman KJ, Krathwohl SE, Bonnell C, Lee MM, Kushi LH. Complementary and alternative therapy use before and after breast cancer diagnosis: The Pathways Study. Breast Cancer Research and Treatment 2009; 117(3): 653–665. |
A5) Thema der Publikation |
|
Grossarth-Maticek R, Kiene H, Baumgartner S, Ziegler R. Synergy effects of self-regulation and mistletoe therapy (Iscador) on survival of cancer patients. [German]. Schweizerische Zeitschrift für GanzheitsMedizin. 2004;16: 81–9. |
A7) Volltext nicht verfügbar |
|
Grossarth-Maticek R, Kiene H, Baumgartner SM, Ziegler R. Use of Iscador, an extract of European mistletoe (Viscum album), in cancer treatment: prospective nonrandomized and randomized matched-pair studies nested within a cohort study. Alternative Therapies in Health and Medicine 2001; 7(3): 57–66, 8–72, 4–6 passim. |
A6) Studientyp |
|
Grossarth-Maticek R, Ziegler R. Prospective controlled cohort studies on long-term therapy of breast cancer patients with a mistletoe preparation (Iscador). Forschende Komplementärmedizin [Internet] 2006; 13(5): 285–292. |
A6) Studientyp |
|
Grossarth-Maticek R, Ziegler R. Randomised and non-randomised prospective controlled cohort studies in matched-pair design for the long-term therapy of breast cancer patients with a mistletoe preparation (Iscador): a re-analysis. European journal of medical research [Internet] 2006; 11(11): 485–495. |
A4) Zielgröße, Messinstrument |
|
Hack CC, Beckmann MW, Hein A, Bayer CM, Rauh C, Almstedt K, Huttner NBM, Janni W, Fehm T, Maass N, Rody A, Fersis N, Wallwiener D, Hübner J, Fasching PA. Application of integrative medicine by postmenopausal breast cancer patients in the PreFace Phase IV study‑a prospective, longitudinal trial. Oncology Research and Treatment 2014; 37: 12. |
A5) Thema der Publikation |
|
Heiny BM. Additive Therapie mit standardisiertem Mistelextrakt reduziert die Leukopenie und verbessert die Lebensqualität von Patientinnen mit fortgeschrittenem Mammakarzinom unter palliativer Chemotherapie (VEC-Schema). Krebsmedizin 1991;12: 1–14. |
A7) Volltext nicht verfügbar |
|
Heiny BM, Beuth J. Mistletoe extract standardized for the galactoside-specific lectin (ML‑1) induces beta-endorphin release and immunopotentiation in breast cancer patients. Anticancer Research 1994; 14(3B): 1339–1342. |
A4) Zielgröße |
|
Hosseini A, Ghorbani A. Cancer therapy with phytochemicals: Evidence from clinical studies. Avicenna Journal of Phytomedicine 2015; 5(2): 84–97. |
A6) Studientyp |
|
Huebner J, Muenstedt K, Muecke R, Micke O. The integration of methods from complementary and alternative medicine in reviews on supportive therapy in oncology and the resulting evidence. Trace Elements and Electrolytes 2013; 30(1): 24–28. |
A5) Thema der Publikation |
|
Hutt N, Kopferschmitt-Kubler M, Cabalion J, Purohit A, Alt M, Pauli G. Anaphylactic reactions after therapeutic injection of mistletoe (Viscum album L.). Allergologia Et Immunopathologia 2001; 29(5): 201–203. |
A6) Studientyp |
|
Kado K, Forsyth A, Patel PR, Schwartz JA. Dietary supplements and natural products in breast cancer trials. Frontiers in Bioscience – Élite 2012; 4 E(1): 546–567. |
A6) Studientyp |
|
Kalder M, Muller T, Fischer D, Muller A, Bader W, Beckmann MW, Brucker C, Hack CC, Hanf V, Hasenburg A, Hein A, Jud S, Kiechle M, Klein E, Paepke D, Rotmann A, Schutz F, Dobos G, Voiss P, Kummel S.A Review of Integrative Medicine in Gynaecological Oncology. Geburtshilfe und Frauenheilkunde 2016; 76(2): 150–155. |
A6) Studientyp |
|
Kienle GS, Mussler M, Fuchs D, Kiene H. Intravenous Mistletoe Treatment in Integrative Cancer Care: A Qualitative Study Exploring the Procedures, Concepts, and Observations of Expert Doctors. Evidence Based Complementary and Alternative Medicine 2016; 2016: 4628287. |
A6) Studientyp |
|
Klose C, Jensen K, Herzig M, Mansmann U. Multicentric, randomized, open, prospective clinical trial for the investigation of efficacy and tolerance and adverse drug reactions of HELIXOR® A in comparison to Lentinan in patients with non small cell lung cancer, breast cancer or ovarian cancer. Forschungsbericht der Abteilung Medizinische Biometrie 2003; (45):1–121. |
A3) Vergleichsintervention |
|
Kröz M, Büssing A, von Laue HB, Reif M, Feder G, Schad F, Girke M, Matthes H. Reliability and validity of a new scale on internal coherence (ICS) of cancer patients. Health and Quality of Life Outcomes 2009; 7: 59. |
A5) Thema der Publikation |
|
Kröz M, Pranga D, Zerm R, Friemel D, Reif M, Schad F, Girke M, Matthes H. Does self-regulation have an importance in the treatment of cancer patients? Deutsche Zeitschrift für Onkologie 2016; 48(2): 62–66. |
A5) Thema der Publikation |
|
Kröz M, Schad F, Reif M, Von Laue HB, Feder G, Zerm R, Validation of the state version questionnaire on autonomic regulation (State-aR) for cancer patients. European Journal of Medical Research 2011; 16(10): 457–68. |
A5) Thema der Publikation |
|
Kröz M, Zerm R, Schad F, Reif M, von Laue HB, Storch T, Feder G, Brinkhaus B, Willich NS, Girke M. State version of autonomic regulation (aR): A new scale to distinguish between autonomic constitution and loss of regulation with regards to chemo- and mistletoe sensitivity. Phytomedicine 2011; 18: S25. |
A5) Thema der Publikation |
|
Legnani W. Mistletoe in conventional oncological practice: Exemplary cases. Integrative Cancer Therapies 2008; 7(3): 162–171. |
A6) Studientyp |
|
Lewicka S, Staudt A, Glenz A, Reinhard-Hennch B, Stammer H, Kuehn JJ, Munzinger J, Schneeweiss A, Strowitzki T, Von Hagens C. Attempt to assess usefulness of the salivary cortisol determination as an objective parameter to follow effects of adjuvant and palliative therapy with viscum album (mistletoe preparation) in women with breast cancer. Endocrine Reviews Conference: 94th Annual Meeting and Expo of the Endocrine Society, ENDO 2012; 33(3) (MeetingAbstracts). |
A4) Zielgröße |
|
Liao GS, Apaya MK, Shyur LF. Herbal medicine and acupuncture for breast cancer palliative care and adjuvant therapy. Evidence-based Complementary and Alternative Medicine 2013; 2013: 437948. |
A6) Studientyp |
|
Loewe-Mesch A, Kuehn JJ, Borho K, Abel U, Bauer C, Gerhard I, Schneeweiss A, Sohn C, Strowitzki T, Von Hagens A. Adjuvant simultaneous treatment with mistletoe during chemotherapy for breast cancer – Influence on immune parameters, quality of life and tolerability. Forschende Komplementärmedizin 2008; 15(1): 22–30. |
A4*) Zielgröße |
|
Malyguine A, Umansky V, Kotlan B, Aptsiauri N, Shurin MR. Conference overview: Cancer Immunotherapy and Immunomonitoring (CITIM): Moving forward. Journal of Immunotoxicology 2012; 9(3): 231–235. |
A8) Publikationstyp |
|
Mansky PJ, Wallerstedt DB, Sannes TS, Stagl J, Johnson LL, Blackman MR, Grem JL, Swain SM, Monahan BP. Nccam/nci phase 1 study of mistletoe extract and gemcitabine in patients with advanced solid tumors. Evidence-based Complementary and Alternative Medicine 2013; 2013: 964592. |
A1) Population |
|
Marvibaigi M, Supriyanto E, Amini N, Abdul Majid FA, Jaganathan SK. Preclinical and clinical effects of mistletoe against breast cancer. Biomedical Research International 2014; 2014: 785479. |
A6) Studientyp |
|
Minton O, Richardson A, Sharpe M, Hotopf M, Stone P. Drug therapy for the management of cancer-related fatigue. Cochrane Database of Systematic Reviews 2010; 2010(7). |
A2) Intervention |
|
Münstedt K. Hrgovic I. Komplementärmedizin (KAM) in der gynäkologischen Onkologie. Deutsche Zeitschrift für Onkologie 2010; 42(2): 60–65. |
A6) Studientyp |
|
Paepke D. Mistletoe therapy: state of the art and fields of application. [Deutsch]. Gynakologe 2017; 50(1): 26–30. |
A6) Studientyp |
|
Payne C, Wiffen PJ, Martin S. Interventions for fatigue and weight loss in adults with advanced progressive illness. Cochrane Database of Systematic Reviews 2012; 2012(1). |
A8) Publikationstyp |
|
Piao B, Wang Y, Xie G, Mansmann U, Matthes H, Beuth J, Lin HS. Impact of complementary mistletoe extract treatment on quality of life in breast, ovarian and non-small cell lung cancer patients. A prospective randomized controlled clinical trial. Anticancer research 2004; 24(1): 303–309. |
A6) Studientyp |
|
Pohl RT, Mengs U. The use of mistletoe extracts in cancer patients. Zeitschrift für Phytotherapie 2013; 34(4):164–168. |
A6) Studientyp |
|
Rostock M. Herbal drugs in oncology-indications and state of evidence. Oncology Research and Treatment 2014; 37: 1. |
A7) Volltext nicht verfügbar |
|
Schad F, Axtner J, Happe A, Breitkreuz T, Paxino C, Gutsch J, Matthes B, Debus M, Kröz M, Spahn G, Riess H, Von Laue HB, Matthes H. Network Oncology (NO) – a clinical cancer register for health services research and the evaluation of integrative therapeutic interventions in anthroposophic medicine. Forschende Komplementärmedizin 2013; 20(5): 353–360. |
A5) Thema der Publikation |
|
Schierholz JM, Piao BK, Wang YX, Xie GR, Mansmann U, Matthes H, Beuth J, Lin HS. Komplementäre Tumortherapie mit standardisiertem Mistelgesamtextrakt. Deutsche Zeitschrift für Onkologie 2003; 35(4):186–194. |
A6) Studientyp |
|
Schoffski P, Riggert S, Fumoleau P, Campone M, Bolte O, Marreaud S, Lacombe D, Baron B, Herold M, Zwierzina H, Wilhelm-Ogunbiyi K, Lentzen H, Twelves C. Phase I trial of intravenous aviscumine (rViscumin) in patients with solid tumors: A study of the European Organization for research and treatment of cancer new drug development group. Annals of Oncology 2004; 15(12):1816–24. |
A2) Intervention |
|
Schumacher K, Schneider B, Reich G, Stiefel T, Stoll G, Bock PR, Hanisch J, Beuth J.Postoperative komplementäre Therapie des primären Mammakarzinoms mit lektinnormiertem Mistelextrakt- eine epidemiologische, multizentrische retrolektive Kohortenstudie. Dtsch Zschr Onkol 2002; 34:106–114. |
A4*) Zielgröße |
|
Schumacher K, Schneider B, Reich G, Stiefel T, Stoll G, Bock PR, Hanisch J, Beuth J. Influence of Postoperative Complementary Treatment with Lectin-standardized Mistletoe Extract on Breast Cancer Patients. A Controlled Epidemiological Multicentric Retrolective Cohort Study. Anticancer Research 2003; 23: 50815088. |
A4*) Zielgröße |
|
Shaw HS, Hobbs KB, Seewaldt VL, Kroll DJ. Delayed-type hypersensitivity reaction with iscador M given in combination with cytotoxic chemotherapy. Journal of Clinical Oncology 2004; 22(21): 4432–4434. |
A6) Studientyp |
|
Standish LJ, Dowd F, Sweet E, Dale L, Weaver M, Osborne B, Andersen MR. Breast Cancer Integrative Oncology Care and Its Costs. Integrative Cancer Therapies 2016. |
A4) Zielgröße |
|
Stauder G, Bock PR. Fermented mistletoe (Viscum album L.) extracts as supportive treatment in cancer patients – Results of four controlled pharmaco-epidemiological cohort studies. European Journal of Integrative Medicine 2010; 2 (4): 180. |
A5) Thema der Publikation |
|
Staudt A, Glenz A, Reinhard-Hennch B, Loewe-Mesch A, Lewick S, Stammer H, Kuehn JJ, Abel U, Munzinger J, Schneeweiss A, Sohn C, Strowitzki T, Von Hagens C. Diurnal cortisol profile in breast cancer patients before and during treatment with Viscum album(Iscador P) for 3 or 6 months. Phytomedicine 2011; 2011(18): S25-S26. |
A5) Thema der Publikation |
|
Steele ML, Axtner J, Happe A, Kröz M, Matthes H, Schad F. Adverse Drug Reactions and Expected Effects to Therapy with Subcutaneous Mistletoe Extracts (Viscum album L.) in Cancer Patients. Evidence-based Complementary and Alternative Medicine 2014; 2014: 724258. |
A1) Population |
|
Stevensen C. Complementary therapies in cancer care: an NHS approach. International Journal of Palliative Nursing 1996; 2(1): 15–18. |
A7) Volltext nicht verfügbar |
|
Sunjic SB, Gasparovic AC, Vukovic T, Weiss T, Weiss ES, Soldo I, Djakovic N, Zarkovic T, Zarkovic N. Adjuvant Cancer Biotherapy by Viscum Album Extract Isorel: Overview of Evidence Based Medicine Findings. Collegium antropologicum 2015; 39(3): 701–708. |
A6) Studientyp |
|
Tröger W. Zusammenhang von Lebensqualität und Neutropenie bei Burstkrebspatientinnen, die alleine mit Chemotherapie oder zusätzlich mit Misteltherapie behandelt wurden. Deutsche Zeitschrift für Onkologie [Internet] 2011; 43(2): 58–67. |
A10) Doppelpublikation |
|
von Hagens C, Loewe-Mesch A, Kuehn J, Abel U, Gerhard I. Prospektive kontrollierte nicht randomisierte Machbarkeits-Studie zu einer postoperativen simultanen Mistel-/Chemotherapie bei Patientinnen mit Mammakarzinom – Ergebnisse zu Rekrutierbarkeit, Immunparametern, Lebensqualität und Verträglichkeit. In: Scheer R, Bauer R, Becker H, Fintelmann V, Kemper F, Schilcher H (Hrsg.). Fortschritte in der Misteltherapie: Aktueller Stand der Forschung und klinischen Anwendung. 2005: 567–578. |
A4*) Zielgröße |
|
Wiebelitz KR, Beer AM. High dose intravenous mistletoe treatment – Clinical results, laboratory findings and adverse events in a series of 17 patients with 107 intravenous applications. Phytomedicine 2011; 18(Suppl. 1): S11. |
A6) Studientyp |
|
Witt CM, Cardoso MJ. Complementary and integrative medicine for breast cancer patients ‑Evidence based practical recommendations. Breast 2016; 28:37–44. |
A8) Publikationstyp |
|
Zeller T, Muenstedt K, Stoll C, Schweder J, Senf B, Ruckhaeberle E, Becker S, Sere H, Huebner J. Potential interactions of complementary and alternative medicine with cancer therapy in outpatients with gynecological cancer in a comprehensive cancer center. Journal of Cancer Research and Clinical Oncology 2013; 139(3): 357–365. |
A6) Studientyp |
*„A4*) Zielgröße“ bedeutet, dass diese Publikation im PRISMA-Diagramm zur medizinischen Suche (Abbildung 3) unter „Ausgeschlossene Volltextartikel“ nicht als A4 gezählt wurde, da sie für einen andere Zielgröße eingeschlossen wurde. PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Tabelle 103: Ausgeschlossene Volltexte zur Sicherheit mit Ausschlussgrund
|
Studie |
Ausschlussgrund |
|
Ahn JH, Kim SB, Yun MR, Lee JS, Kang YK, Kim WK. Alternative therapy and abnormal liver function during adjuvant chemotherapy in breast cancer patients. Journal of Korean Medical Science 2004; 19(3): 397–400. |
A2) Intervention |
|
Anonymous. Preparations from mistletoe extracts, vitamins and trace elements are very popular among women with breast cancer. [Deutsch]. Ärztezeitschrift für Naturheilverfahren und Regulationsmedizin 2004; 45(3): 134. |
A5) Thema der Publikation |
|
Anonymous. New study: Iscador improves the quality of life of breast cancer patients during chemotherapy [Deutsch]. Schweizerische Zeitschrift für Ganzheitsmedizin 2010; 22(1): 20. |
A8) Publikationstyp |
|
Auerbach L, Dostal V, Vaclavik-Fleck I, Kubista E, Rosenberger A, Rieger Sea. Signifikant höherer Anteil aktivierter NK-Zellen durch additive Misteltherapie bei chemotherapierten Mamma-Ca-Patientinnen in einer prospektiven randomisierten doppelblinden Studie. In: Scheer R, Bauer R, Becker H, Fintelmann V, Kemper F, Schilcher H (Hrsg.). Fortschritte in der Misteltherapie. Aktueller Stand der Forschung und klinischen Anwendung 2005: 567–78. |
A9) Population sehr klein |
|
Baraya YS, Wong KK, Yaacob NS. The immunomodulatory potential of selected bioactive plant-based compounds in breast cancer: A review. Anti Cancer Agents in Medicinal Chemistry 2016; 2016(16). |
A4) Zielgröße |
|
Beuth J. Evidence-based complementary medicine in breast cancer therapy. Breast Care 2009; 4(1): 8–12. |
A6) Studientyp |
|
Beuth J, Schierholz JM. Evidence-based complementary oncology. Innovative approaches to optimize standard therapy strategies. In Vivo 2007; 21(2):423–8. |
A6) Studientyp |
|
Beuth J, Schneider B, Schierholz JM. Impact of complementary treatment of breast cancer patients with standardized mistletoe extract during aftercare: a controlled multicenter comparative epidemiological cohort study. Anticancer research [Internet] 2008; 28(1b): 523–527. |
A6) Studientyp |
|
Borrelli, E. Evaluation of the quality of life in breast cancer patients undergoing lectin standardized mistletoe therapy. Minerva Medica 2001. 92((Suppl. 1)):105–7. |
A7) Volltext nicht verfügbar |
|
Bruns F, Glatzel M, Schonekaes K, Riesenbeck D, Mucke R, Buntzel J, Complementary and alternative medicine experience in radiation oncology patients: First results of a multi-center approach. Trace Elements and Electrolytes 2006; 23(4): 318–325. |
A5) Thema der Publikation |
|
Buntzel J, Mucke R, Bruns F, Micke O. Complementary and alternative medicine in cancer patients. European Journal of Oncology Pharmacy 2008. 2(2):12–3. |
A5) Thema der Publikation |
|
Büssing A, Raak C, Ostermann T. Quality of life and related dimensions in cancer patients treated with mistletoe extract (Iscador): A meta-analysis. Evidence-based Complementary and Alternative Medicine 2012; 2012: 219402. |
A1) Population |
|
Greenlee H, Kwan ML, Ergas IJ, Sherman KJ, Krathwohl SE, Bonnell C, Lee MM, Kushi LH. Complementary and alternative therapy use before and after breast cancer diagnosis: The Pathways Study. Breast Cancer Research and Treatment 2009; 117(3): 653–65. |
A5) Thema der Publikation |
|
Grossarth-Maticek R, Kiene H, Baumgartner S, Ziegler R. Wirksamkeit und Unbedenklichkeit einer Langzeitbehandlung von Melanompatienten mit einem Mistelpräparat (Iscador).Schweizerische Zeitschrift für Ganzheitsmedizin 2004; 16(2): 81–89. |
A7) Volltext nicht verfügbar |
|
Grossarth-Maticek R, Kiene H, Baumgartner SM, Ziegler R. Use of Iscador, an extract of European mistletoe (Viscum album), in cancer treatment: prospective nonrandomized and randomized matched-pair studies nested within a cohort study. Alternative Therapies In Health And Medicine 2001; 7(3):57–66, 8–72, 4–6 passim. |
**A4) Zielgröße |
|
Grossarth-Maticek R, Ziegler R. Prospective controlled cohort studies on long-term therapy of breast cancer patients with a mistletoe preparation (Iscador). Forschende Komplementärmedizin [Internet] 2006; 13(5): 285–92. |
**A4) Zielgröße |
|
Grossarth-Maticek R, Ziegler R. Randomised and non-randomised prospective controlled cohort studies in matched-pair design for the long-term therapy of breast cancer patients with a mistletoe preparation (Iscador): a re-analysis. European journal of medical research [Internet] 2006; 11(11): 485–95. |
**A4) Zielgröße, Messinstrument |
|
Hack CC, Beckmann MW, Hein A, Bayer CM, Rauh C, Almstedt K, Huttner NBM, Janni W, Fehm T, Maass N, Rody A, Fersis N, Wallwiener D, Hübner J, Fasching PA. Application of integrative medicine by postmenopausal breast cancer patients in the PreFace Phase IV study‑a prospective, longitudinal trial. Oncology Research and Treatment 2014; 37: 12. |
A5) Thema der Publikation |
|
Heiny BM. Additive Therapie mit standardisiertem Mistelextrakt reduziert die Leukopenie und verbessert die Lebensqualität von Patientinnen mit fortgeschrittenem Mammakarzinom unter palliativer Chemotherapie (VEC-Schema). Krebsmedizin 1991;12: 1–14. |
A7) Volltext nicht verfügbar |
|
Heiny BM, Beuth J. Mistletoe extract standardized for the galactoside-specific lectin (ML‑1) induces beta-endorphin release and immunopotentiation in breast cancer patients. Anticancer Res. 1994. 14(3B):1339–1342. |
A4) Zielgröße |
|
Hosseini A, Ghorbani A. Cancer therapy with phytochemicals: Evidence from clinical studies. Avicenna Journal of Phytomedicine 2015; 5(2): 84–97. |
A6) Studientyp |
|
Huebner J, Muenstedt K, Muecke R, Micke O. The integration of methods from complementary and alternative medicine in reviews on supportive therapy in oncology and the resulting evidence. Trace Elements and Electrolytes 2013; 30(1): 24–28. |
A5) Thema der Publikation |
|
Hutt N, Kopferschmitt-Kubler M, Cabalion J, Purohit A, Alt M, Pauli G. Anaphylactic reactions after therapeutic injection of mistletoe (Viscum album L.). Allergologia Et Immunopathologia 2001; 29(5): 201–203. |
A6) Studientyp |
|
Kado K, Forsyth A, Patel PR, Schwartz JA. Dietary supplements and natural products in breast cancer trials. Frontiers in Bioscience – Élite 2012; 4 E(1):546–567. |
A6) Studientyp |
|
Kalder M, Muller T, Fischer D, Muller A, Bader W, Beckmann MW, Brucker C, Hack CC, Hanf V, Hasenburg A, Hein A, Jud S, Kiechle M, Klein E, Paepke D, Rotmann A, Schutz F, Dobos G, Voiss P, Kummel S. A Review of Integrative Medicine in Gynaecological Oncology. Geburtshilfe und Frauenheilkunde 2016; 76(2):150–155. |
A6) Studientyp |
|
Kienle GS, Mussler M, Fuchs D, Kiene H. Intravenous Mistletoe Treatment in Integrative Cancer Care: A Qualitative Study Exploring the Procedures, Concepts, and Observations of Expert Doctors. Evidence-based Complementary and Alternative Medicine 2016. 2016:4628287. |
A6) Studientyp |
|
Klose C, Jensen K, Herzig M, Mansmann U. Multicentric, randomized, open, prospective clinical trial for the investigation of efficacy and tolerance and adverse drug reactions of HELIXOR® A in comparison to Lentinan in patients with non small cell lung cancer, breast cancer or ovarian cancer. Forschungsbericht der Abteilung Medizinische Biometrie 2003; 45: 1–121. |
A3) Vergleichsintervention |
|
Kröz M, Büssing A, von Laue HB, Reif M, Feder G, Schad F, Girke M, Matthes H. Reliability and validity of a new scale on internal coherence (ICS) of cancer patients. Health and Quality of Life Outcomes 2009; 7: 59. |
A5) Thema der Publikation |
|
Kröz M, Pranga D, Zerm R, Friemel D, Reif M, Schad F, Girke M, Matthes H. Does self-regulation have an importance in the treatment of cancer patients? Deutsche Zeitschrift für Onkologie 2016; 48(2): 62–66. |
A5) Thema der Publikation |
|
Kröz M, Schad F, Reif M, Von Laue HB, Feder G, Zerm R. Validation of the state version questionnaire on autonomic regulation (State-aR) for cancer patients. European Journal of Medical Research 2011. 16(10):457–68. |
A5) Thema der Publikation |
|
Kröz M, Zerm R, Schad F, Reif M, H.B VL, Storch T. State version of autonomic regulation (aR): A new scale to distinguish between autonomic constitution and loss of regulation with regards to chemo- and mistletoe sensitivity. Phytomedicine 2011. 18:25. |
A5) Thema der Publikation |
|
Legnani W. Mistletoe in conventional oncological practice: Exemplary cases. Integrative Cancer Therapies 2008. 7(3):162–71. |
A6) Studientyp |
|
Lewicka S, Staudt A, Glenz A, Reinhard-Hennch B, Stammer H, Kuehn JJ, Munzinger J, Schneeweiss A, Strowitzki T, Von Hagens C. Attempt to assess usefulness of the salivary cortisol determination as an objective parameter to follow effects of adjuvant and palliative therapy with viscum album (mistletoe preparation) in women with breast cancer. Endocrine Reviews Conference: 94th Annual Meeting and Expo of the Endocrine Society, ENDO 2012. 33(3) (Meeting Abstracts). |
A4) Zielgröße |
|
Liao GS, Apaya MK, Shyur LF. Herbal medicine and acupuncture for breast cancer palliative care and adjuvant therapy. Evidence-based Complementary and Alternative Medicine 2013. Jg 2003, Nr. 437948. |
A4*) Zielgröße |
|
Malyguine A, Umansky V, Kotlan B, Aptsiauri N, Shurin MR. Conference overview: Cancer Immunotherapy and Immunomonitoring (CITIM): Moving forward. Journal of Immunotoxicology 2012; 9(3): 231–235. |
A8) Publikationstyp |
|
Mansky PJ, Wallerstedt DB, Sannes TS, Stagl J, Johnson LL, Blackman MR, Grem JL, Swain SM, Monahan BP Nccam/nci phase 1 study of mistletoe extract and gemcitabine in patients with advanced solid tumors. Evidence-based Complementary and Alternative Medicine 2013; 2013: 964592. |
A1) Population |
|
Marvibaigi M, Supriyanto E, Amini N, Abdul Majid FA, Jaganathan SK. Preclinical and clinical effects of mistletoe against breast cancer. Biomed Research International 2014; 2014: 785479. |
A6) Studientyp |
|
Minton O, Richardson A, Sharpe M, Hotopf M, Stone P. Drug therapy for the management of cancer-related fatigue. Cochrane Database of Systematic Reviews 2010; 2010(7). |
A2) Intervention |
|
Münstedt K, Hrgovic I. Komplementärmedizin (KAM) in der gynäkologischen Onkologie. Deutsche Zeitschrift für Onkologie 2010; 42(2): 60–65. |
A6) Studientyp |
|
Paepke D. Misteltherapie: Studienlage und Einsatzgebiete. Der Gynäkologe 2017; 50(1): 26–30. |
A6) Studientyp |
|
Payne C, Wiffen PJ, Martin S. Interventions for fatigue and weight loss in adults with advanced progressive illness. Cochrane Database of Systematic Reviews 2012(1). |
A8) Publikationstyp |
|
Piao B, Wang Y, Xie G, Mansmann U, Matthes H, Beuth J, Lin HS. Impact of complementary mistletoe extract treatment on quality of life in breast, ovarian and non-small cell lung cancer patients. A prospective randomized controlled clinical trial. Anticancer research 2004; 24(1): 303–309. |
A6) Studientyp |
|
Pohl RT, Mengs U. The use of mistletoe extracts in cancer patients. Zeitschrift für Phytotherapie 2013. 34(4):164–8. |
A6) Studientyp |
|
Rostock M. Herbal drugs in oncology-indications and state of evidence. Oncology Research and Treatment 2014; 37: 1. |
A7) Volltext nicht verfügbar |
|
Schad F, Axtner J, Happe A, Breitkreuz T, Paxino C, Gutsch J, Matthes B, Debus M, Kröz M, Spahn G, Riess H, Von Laue HB, Matthes H. Network Oncology (NO)–a clinical cancer register for health services research and the evaluation of integrative therapeutic interventions in anthroposophic medicine. Forschende Komplementärmedizin 2013; 20(5): 353–360. |
A5) Thema der Publikation |
|
Schierholz JM, Piao BK, Wang YX, Xie GR, Mansmann U, Matthes H, Beuth J, Lin HS. Komplementäre Tumortherapie mit standardisiertem Mistelgesamtextrakt. Deutsche Zeitschrift für Onkologie 2003; 35(4): 186–94. |
A6) Studientyp |
|
Schoffski P, Riggert S, Fumoleau P, Campone M, Bolte O, Marreaud S, Lacombe D, Baron B, Herold M, Zwierzina H, Wilhelm-Ogunbiyi K, Lentzen H, Twelves.Phase I trial of intravenous aviscumine (rViscumin) in patients with solid tumors: A study of the European Organization for research and treatment of cancer new drug development group. Annals of Oncology 2004; 15(12): 1816–24. |
A2) Intervention |
|
Shaw HS, Hobbs KB, Seewaldt VL, Kroll DJ. Delayed-type hypersensitivity reaction with iscador M given in combination with cytotoxic chemotherapy [3]. Journal of Clinical Oncology 2004; 22(21): 4432–4434. |
A6) Studientyp |
|
Standish LJ, Dowd F, Sweet E, Dale L, Weaver M, Osborne B, Andersen MR. Breast Cancer Integrative Oncology Care and Its Costs. Integr Cancer Ther 2016. |
A4) Zielgröße |
|
Stauder G, Bock PR. Fermented mistletoe (Viscum album L.) extracts as supportive treatment in cancer patients – Results of four controlled pharmaco-epidemiological cohort studies. European Journal of Integrative Medicine 2010; 2(4): 180. |
A5) Thema der Publikation |
|
Staudt A, Glenz A, Reinhard-Hennch B, Loewe-Mesch A, Lewick S, Stammer H, Kuehn JJ, Abel U, Munzinger J, Schneeweiss A, Sohn C, Strowitzki T, Von Hagens C. Diurnal cortisol profile in breast cancer patients before and during treatment with Viscum album (Iscador P) for 3 or 6 months. Phytomedicine 2011; 18: 25-S26. |
A5) Thema der Publikation |
|
Steele ML, Axtner J, Happe A, Kröz M, Matthes H, Schad F. Adverse Drug Reactions and Expected Effects to Therapy with Subcutaneous Mistletoe Extracts (Viscum album L.) in Cancer Patients. Evidence-based Complementary and Alternative Medicine 2014; 2014: 724258. |
A1) Population |
|
Stevensen C. Complementary therapies in cancer care: an NHS approach. International Journal of Palliative Nursing 1996; 2(1): 15–18. |
A7) Volltext nicht verfügbar |
|
Sunjic SB, Gasparovic AC, Vukovic T, Weiss T, Weiss ES, Soldo I, Djakovic N, Zarkovic T, Zarkovic N. Adjuvant Cancer Biotherapy by Viscum Album Extract Isorel: Overview of Evidence Based Medicine Findings. Collegium antropologicum 2015. 39(3): 701–708. |
A6) Studientyp |
|
Tröger W. Zusammenhang von Lebensqualität und Neutropenie bei Burstkrebspatientinnen, die alleine mit Chemotherapie oder zusätzlich mit Misteltherapie behandelt wurden. Deutsche Zeitschrift für Onkologie [Internet] 2011; 43(2): 58–67. |
A10) Doppelpublikation |
|
Tröger W, Zdrale Z, Stankovic N. Fünf-Jahres-Nachbeobachtung von Patientinnen mit Brustkrebs nach einer randomisierten Studie mit Viscum album (L.). Deutsche Zeitschrift für Onkologie 2016; 48(3): 105–110. |
A4*) Zielgröße |
|
Tröger W, Zdrale Z, Stankovic N, Matijasevic M. Five-year follow-up of patients with early stage breast cancer after a randomized study comparing additional treatment with Viscum album (L.) extract to chemotherapy alone. Breast Cancer: Basic and Clinical Research 2012; 6(1): 173–180. |
A4*) Zielgröße |
|
Wiebelitz KR, Beer AM. High dose intravenous mistletoe treatment – Clinical results, laboratory findings and adverse events in a series of 17 patients with 107 intravenous applications. Phytomedicine 2011. 18: S11. |
A6) Studientyp |
|
Witt CM, Cardoso MJ. Complementary and integrative medicine for breast cancer patients – Evidence based practical recommendations. Breast 2016; 28(August): 3744. |
A8) Publikationstyp |
|
Zeller T, Muenstedt K, Stoll C, Schweder J, Senf B, Ruckhaeberle E, Becker S, Sere H, Huebner J Potential interactions of complementary and alternative medicine with cancer therapy in outpatients with gynecological cancer in a comprehensive cancer center. Journal of Cancer Research and Clinical Oncology 2013; 139(3):357–365. |
A6) Studientyp |
*„A4‘) Zielgröße“ bedeutet, dass diese Publikation im PRISMA-Diagramm zur medizinischen Suche (Abbildung 3) unter „Ausgeschlossene Volltextartikel“ nicht als A4 gezählt wurde, da sie für einen andere Zielgröße eingeschlossen wurde.
**Bei diesen Publikationen von Grossarth-Maticek unterscheiden sich die Ausschlussgründe für die Publikation zwischen der Wirksamkeit und der Sicherheit. Im PRISMA-Flussdiagramm in Abbildung 3 wurden die Ausschlussgründe aus
Tabelle 102 verwendet.
PRISMA = Preferred Reporting Items for Systematic Reviews and Meta-Analyses.
Tabelle 104: Ausgeschlossene Volltexte zur Suche zu Kosten und Kosteneffektivität mit Ausschlussgrund
|
Studie |
Ausschlussgrund |
|
Kalder M, Muller T, Fischer D, Muller A, Bader W, Beckmann MW. A Review of Integrative Medicine in Gynaecological Oncology. Geburtshilfe Frauenheilkunde 2016; 76(2): 150–155. |
A1) Thema |
|
Kienle GS, Albonico HU, Baars E, Hamre HJ, Zimmermann P, Kiene H. Anthroposophic medicine: an integrative medical system originating in Europe. Global Advances in Health and Medicine 2013; 2(6): 20–31. |
A1) Thema |
|
Standish LJ, Dowd F, Sweet E, Dale L, Weaver M, Osborne B, Breast Cancer Integrative Oncology Care and Its Costs. Integrative cancer therapies 2017; 16(1): 85–95. |
A3) Setting |
|
Stauder G, Bock PR. Fermented mistletoe (Viscum album L.) extracts as supportive treatment in cancer patients – Results of four controlled pharmaco-epidemiological cohort study. European Journal of Integrative Medicine 2010; 2 (4): 180. |
A2) Der Volltext ist nicht verfügbar |
Tabelle 105: Ausgeschlossene Volltexte der Suche zu Patienten- und sozialen Aspekten mit Ausschlussgrund
|
Studie |
Ausschlussgrund* |
|
Anonymous. Preparations from mistletoe extracts, vitamins and trace elements are very popular among women with breast cancer. [Deutsch]. Ärztezeitschrift für Naturheilverfahren und Regulationsmedizin 2004; 45(3): 134. |
A1) Thema/keine Misteltherapie |
|
Arman M, Rehnsfeldt A, Lindholm L, Hamrin E, Eriksson K. Suffering related to health care: a study of breast cancer patients’ experiences. International journal of nursing practice 2004; 10(6): 248–256. |
A1) Thema/keine Misteltherapie |
|
Arman, M., Backman, M. A longitudinal study on women’s experiences of life with breast cancer in anthroposophical (complementary) and conventional care. Eur J Cancer Care (Engl) 2007; 16(5): 444–450. |
A1) Thema/keine Misteltherapie |
|
Arslan D, Tural D, Akar E. Herbal Administration and Interaction of Cancer Treatment. Journal of Palliative Medicine 2013; 16(11): 1466–1476. |
A1) Thema/keine Misteltherapie |
|
Ben-Arye E, Schiff E, Steiner M, Keshet Y, Lavie O. Attitudes of patients with gynecological and breast cancer toward integration of complementary medicine in cancer care. International journal of gynecological cancer 2012; 22(1): 146153. |
A1) Thema/keine Misteltherapie |
|
Bishop FL, Yardley L. Constructing agency in treatment decisions: negotiating responsibility in cancer. Health 2004; 8(4): 465–482. |
A1) Thema/keine Misteltherapie |
|
Brandenberger M, Simoes-Wüst AP, Rostock M, Rist L, Saller R. An exploratory study on the quality of life and individual coping of cancer patients during mistletoe therapy. Integrative cancer therapies 2012; 11(2): 90–100. |
A6) Doppelpublikation |
|
Broom A. ‘I’d forgotten about me in all of this’: Discourses of self-healing, positivity and vulnerability in cancer patients’ experiences of complementary and alternative medicine. Journal of Sociology 2009; 45(1): 71–87. |
A1) Thema/keine Misteltherapie |
|
Bruns F, Glatzel M, Schonekaes K, Riesenbeck D, Mucke R, Buntzel J, Micke P, Schafer U, Kisters K, Micke O. Complementary and alternative medicine experience in radiation oncology patients: First results of a multi-center approach. Trace Elements and Electrolytes 2006; 23(4): 318–325. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Buntzel J, Mucke R, Bruns F, Micke O. Complementary and alternative medicine in cancer patients. European Journal of Oncology Pharmacy 2008; 2(2): 12–13. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Can G, Demir M, Aydiner A. Complementary and alternative therapies used by Turkish breast cancer patients undergoing chemotherapy. Breast Care 2012; 7(6): 471–415. |
A4) nicht deutschsprachiger Raum |
|
Carlsson, M., Arman, M., Backman, M., Flatters, U., Hatschek, T., Hamrin, E. A Five-year Follow-up of Quality of Life in Women with Breast Cancer in Anthroposophic and Conventional Care. Evid Based Complement Alternat Med 2006; 3(4): 523–531. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Cohen L, Cohen MH, Kirkwood C, Russell NC. Discussing complementary therapies in an oncology setting. Journal of the Society for Integrative Oncology 2007; 5(1): 18–24. |
A1) Thema/keine Misteltherapie |
|
Conrad AC, Muenstedt K, Micke O, Prott FJ, Muecke R, Huebner J. Attitudes of members of the German Society for Palliative Medicine toward complementary and alternative medicine for cancer patients. Journal of Cancer Research and Clinical Oncology 2014; 140(7): 1229–1237. |
A1) Thema/keine Misteltherapie |
|
Dahlhaus A, Siebenhofer A, Guethlin C. Complementary Medicine for Cancer Patients in General Practice: Qualitative Interviews with German General Practitioners. Complementary Medicine Research 2015; 22(1): 36–41. |
A1) Thema/keine Misteltherapie |
|
Davis EL, Oh B, Butow PN, Mullan BA, Clarke S. Cancer patient disclosure and patient-doctor communication of complementary and alternative medicine use: a systematic review. The oncologist 2012; 17(11): 1475–1481. |
A1) Thema/keine Misteltherapie |
|
Domnick M, Domnick M, Wiebelitz KR, Beer AM. Evaluation of the Effectiveness of a Multimodal Complementary Medicine Program for Improving the Quality of Life of Cancer Patients during Adjuvant Radiotherapy and/or Chemotherapy or Outpatient Aftercare. Oncology 2017. 93(2): 83–91. |
A1) Thema/keine Misteltherapie |
|
Ebel MD, Rudolph I, Keinki C, Hoppe A, Muecke R, Micke O, Muenstedt K und Huebner J. Perception of cancer patients of their disease, self-efficacy and locus of control and usage of complementary and alternative medicine. Journal of Cancer Research and Clinical Oncology 2015; 141(8): 1449–1455. |
A1) Thema/keine Misteltherapie |
|
Ehmann M, Harter M, Rambach R, Winkler E. Oncological therapies – what are the patient relative outcomes? Onkologie 2013; 36 (Suppl 6): 5–8. |
A1) Thema/keine Misteltherapie |
|
Eliott JA, Kealey CP, Olver IN. (Using) complementary and alternative medicine: the perceptions of palliative patients with cancer. Journal of palliative medicine 2008; 11(1): 58–67. |
A1) Thema/keine Misteltherapie |
|
Engdal, S., Steinsbekk, A., Klepp, O., Nilsen, O.G. Herbal use among cancer patients during palliative or curative chemotherapy treatment in Norway. Supportive Care in Cancer 2008; 16(7): 763–769. |
A4) nicht deutschsprachiger Raum |
|
Filshie J, Rubens CNJ. Complementary and alternative medicine. Anesthesiology Clinics of North America 2006; 24(1): 81–111. |
A1) Thema/keine Misteltherapie |
|
Garnett M. Sustaining the cocoon: the emotional inoculation produced by complementary therapies in palliative care. European Journal of Cancer Care 2003; 12(2): 129–136. |
A1) Thema/keine Misteltherapie |
|
Ge J, Fishman J, Vapiwala N, Li SQ, Desai K, Xie SX, Mao JJ. Patient-physician communication about complementary and alternative medicine in a radiation oncology setting. International journal of radiation oncology, biology, physics 2013; 85(1): e1‑6. |
A1) Thema/keine Misteltherapie |
|
Gillett J, Ientile C, Hiscock J, Plank A, Martin JM. Complementary and alternative medicine use in radiotherapy: what are patients using? Journal of alternative and complementary medicine 2012; 18(11): 1014–1020. |
A1) Thema/keine Misteltherapie |
|
Hack CC, Fasching PA, Fehm T, de Waal J, Rezai M, Baier B, Baake G, Kohlberg HC, Guggenberger M, Wam M, Harbeck N, Wuerstlein R, Deuker JU, Dall P, Richter B, Wachsmann B, Brucker C, Siebers JW, Fersis N, Kuhn T, Wolf C, Vollert HW, Breitbach GP, Janni W, Landthaler R, Kohls A, Rezek D, Noesslet T, Fischer G, Henschen S, Praetz T, Heyl V, Kuhn T, Krauss T, Thomssen C, Hohn A, Tesch H, Mundhenke C, Hein A, Rauh C, Bayer CM, Jacob A, Schmidt K, Belleville E, Hadji P, Brucker SY, Wallwiener D, Kümmel S, Beckmann MW und Paepke D.et al. Interest in Integrative Medicine Among Postmenopausal Hormone Receptor-Positive Breast Cancer Patients in the EvAluate-TM Study. Integrative cancer therapies 2017; 16(2): 165–175. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Heimpel H, Drings P, Gaedicke G, Girke M, Ludwig WD, Bamberg M. Cancer treatment 2008: scientifically-based procedures and methods with controversial effectiveness. Onkologe. 2009. 15(1):85–94. |
A1) Thema/keine Misteltherapie |
|
Henf A, Wesselmann S, Huthmann D, Muenstedt K, Huebner J, on behalf of the Working Group Prevention and Intergrative Oncology of the German Cancer Society. Complementary and Alternative Medicine in German Cancer Centers. Oncology Research and Treatment 2014; 37: 390–394. |
A1) Thema/keine Misteltherapie |
|
Heusser, P., Braun, S.B., Bertschy, M., Burkhard, R., Ziegler, R., Helwig, S., van Wegberg, B., Cerny, T. Palliative in-patient cancer treatment in an anthroposophic hospital: II. Quality of life during and after stationary treatment, and subjective treatment benefits. Forsch Komplementmed 2006; 13(3): 156166. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Heusser, P., Braun, S.B., Ziegler, R., Bertschy, M., Helwig, S., van Wegberg, B., Cerny, T. Palliative in-patient cancer treatment in an anthroposophic hospital: I. Treatment patterns and compliance with anthroposophic medicine. Forsch Komplementmed 2006; 13(2): 94–100. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Hinkka H, Kosunen E, Lammi UK, Metsanoja R, Kellokumpu-Lehtinen P. Attitudes to terminal patients’ unorthodox therapy: Finnish doctors’ responses to a case scenario. Supportive Care in Cancer 2004; 12(2): 132–136. |
A1) Thema/keine Misteltherapie |
|
Hok J, Falkenberg T, Tishelman C. Lay perspectives on the use of biologically based therapies in the context of cancer: A qualitative study from Sweden. Journal of Clinical Pharmacy and Therapeutics 2011; 36(3): 367–375. |
A4) nicht deutschsprachiger Raum |
|
Hübner J, Hanf V. Commonly used methods of complementary medicine in the treatment of breast cancer. Breast Care (Basel) 2013; 8(5): 341–347. |
A1) Thema/keine Misteltherapie |
|
Hübner J, Muenstedt K, Muecke R, Micke O, Stoll C, Kleeberg UR, Buentzel J, Dennert G, Prott FJ, PRIO (Working group Prevention and Integrative Oncology of the German Cancer Society); AKTE (Working group Trace Elements of the German Society of Radiooncology). Counseling cancer patients on complementary and alternative medicine. Background, theory, and implementation of nationwide counseling facilities. Strahlentherapie und Onkologie 2013; 189(8): 613–617. |
A1) Thema/keine Misteltherapie |
|
Huebner J, Ebel M, Muenstedt K, Micke O, Prott FJ, Muecke R und Hoppe A. A lecture program on complementary and alternative medicine for cancer patients-evaluation of the pilot phase. Journal of Cancer Education 2015; 30(2): 340–343. |
A1) Thema/keine Misteltherapie |
|
Huebner J, Micke O, Muecke R, Buentzel J, Prott FJ, Kleeberg U, Kleeberg UR, Senf B, Muenstedt K. User rate of complementary and alternative medicine (CAM) of patients visiting a counseling facility for CAM of a German comprehensive cancer center. Anticancer research 2014; 34(2): 943–948. |
A1) Thema/keine Misteltherapie |
|
Huebner J, Senf B, Micke O, Muecke R, Stoll C, Prott FJ, Muenstedt K, Dennert G, Working group Prevention and Integrative Oncology (PRIO) of the German Cancer Society. Online information on complementary and alternative medicine for cancer patients: evidence-based recommendations. Onkologie 2013; 36(5): 273–278. |
A1) Thema/keine Misteltherapie |
|
Kienle GS, Mussler M, Fuchs D, Kiene H. Intravenous Mistletoe Treatment in Integrative Cancer Care: A Qualitative Study Exploring the Procedures, Concepts, and Observations of Expert Doctors. Evidence-based Complementary and Alternative Medicine 2016; 2016: 4628287. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Kienle GS, Mussler M, Fuchs D, Kiene H. Individualized Integrative Cancer Care in Anthroposophic Medicine: A Qualitative Study of the Concepts and Procedures of Expert Doctors. Integrative cancer therapies 2016; 15(4): 478494. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Klocker JG, Klocker-Kaiser U, Schwaninger M. Truth in the relationship between cancer patient and physician. Annals of the New York Academy of Sciences 1997; 809: 56–65. |
A1) Thema/keine Misteltherapie |
|
Koehl B, Muenstedt K, Micke O, Muecke R, Buentzel J, Stoll C, Prott FJ, Dennert G, Senf B, Hübner J. Survey of German non-medical practitioners regarding complementary and alternative medicine in oncology. Oncology Research and Treatment 2014; 37(1–2): 49–53. |
A1) Thema/keine Misteltherapie |
|
Konig J, Geschwill K, Lang A, Tauchert FK, Hofheinz RD, Kripp M. Use of Complementary and Alternative Medicine in Cancer Patients: A Prospective Questionnaire-Based Study in an Oncological Outpatient Clinic. Oncology Research and Treatment 2016. 39(5): 260–265. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Mackenzie G, Parkinson M, Lakhani A, Pannekoek H. Issues that influence patient/physician discussion of complementary therapies. Patient education and counseling 1999; 38(2):155–159. |
A1) Thema/keine Misteltherapie |
|
McLay JS, Stewart D, George J, Rore C, Heys SD. Complementary and alternative medicines use by Scottish women with breast cancer. What, why and the potential for drug interactions? European Journal of Clinical Pharmacology 2012; 68(5): 811–819. |
A4) nicht deutschsprachiger Raum |
|
Micke O, Bruns F, Glatzel M, Schonekaes K, Micke P, Mucke R, Buntzel J. Predictive factors for the use of complementary and alternative medicine (CAM) in radiation oncology. European Journal of Integrative Medicine 2009; 1(1): 2230. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Molassiotis A, Browall M, Milovics L, Panteli V, Patiraki E, Fernandez-Ortega P. Complementary and alternative medicine use in patients with gynecological cancers in Europe. International journal of gynecological cancer: official journal of the International Gynecological Cancer Society 2006; 16(Suppl. 1): 219–24. |
A1) Thema/keine Misteltherapie |
|
Molassiotis A, Fernadez-Ortega P, Pud D, Ozden G, Scott JA, Panteli V, Margulies A, Browall M, Magri M, Selvekerova S, Madsen E, Milovics L, Bruyns I, Gudmundsdottir G, Hummerston S, Ahmad AM, Platin N, Kearney N, Patiraki E. Use of complementary and alternative medicine in cancer patients: a European survey. Annals of Oncology 2005; 16(4): 655–663. |
A1) Thema/keine Misteltherapie |
|
Molassiotis A, Scott JA, Kearney N, Pud D, Magri M, Selvekerova S, Bruyns I, Fernadez-Ortega P, Panteli V, Margulies A, Gudmundsdottir G, Milovics L, Ozden G, Platin N, Patiraki E. Complementary and alternative medicine use in breast cancer patients in Europe. Supportive care in cancer: official journal of the Multinational Association of Supportive Care in Cancer 2006; 14(3): 260–267. |
A1) Thema/keine Misteltherapie |
|
Morais, S., Costa, A.R., Lopes-Conceicao, L., Brandao, M., Borges, M., Araujo, N., Dias, T., Fontes, F., Pereira, S., Lunet, N. Treatment and Other Healthcare Use of Breast Cancer Patients with a Previous Cancer Diagnosis. Anticancer research 2020; 40(2): 1041–1048. |
A1) Thema/keine Misteltherapie |
|
Munstedt K, Vogt T, Rabanus ME, Hübner J. Wishes and beliefs of cancer patients regarding counseling on integrative medicine. Breast Care (Basel). 2014. 9(6): 416–420. |
A1) Thema/keine Misteltherapie |
|
Navo MA, Phan J, Vaughan C, Palmer JL, Michaud L, Jones KL, Bodurka DC, Basen-Engquist K, Hortobagyi GN, Kavanagh JJ, Smith JA. An assessment of the utilization of complementary and alternative medication in women with gynecologic or breast malignancies. Journal of Clinical Oncology 2004; 22(4): 671–677. |
A1) Thema/keine Misteltherapie |
|
Nicolaisen-Murmann K, Thiel F, Mohrmann S, Grunewald E, Ackermann S, Bender HG, Beckmann MW, Fasching PA. Komplementäre und alternative Methoden (CAM) bei Frauen mit Genital- oder Mammakarzinom: multizentrische Studie zur Prävalenz und Motivation Geburtshilfe und Frauenheilkunde 2005; 65(2): 178–185. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Ohlen J, Balneaves LG, Bottorff JL, Brazier AS. The influence of significant others in complementary and alternative medicine decisions by cancer patients. Social science & medicine 2006; 63(6): 1625–1636. |
A1) Thema/keine Misteltherapie |
|
Oneschuk D, Hanson J, Bruera E. Complementary therapy use: a survey of community- and hospital-based patients with advanced cancer. Palliative Medicine 2000; 14(5): 432–434. |
A1) Thema/keine Misteltherapie |
|
Ott IM, Muenstedt K, Micke O, Muecke R, Prott FJ, Senf B, Paradies K, Aerts E und Huebner, J. Attitude of oncology/haematology nurses from German speaking countries towards complementary and alternative medicine. Trace Elements and Electrolytes 2015. 32(2):74–80. |
A1) Thema/keine Misteltherapie |
|
Paepke D, Paepke S, Bronger H, Ludwig L, Grose Lackmann K, Ettl J, Schmalfeldt B, Kiechle M. Use of complementary naturopathic therapies in breast cancer patient care-single-center experiences from the interdisciplinary breast center of the technical university Munich, Germany. European Journal of Cancer 2012; 48: S155. |
A2) Publikationstyp |
|
Pampallona, S., Von Rohr, E., Van Wegberg, B., Bernhard, J., Helwig, S., Heusser, P., Huerny, C., Schaad, R., Cerny, T. Socio-demographic and medical characteristics of advanced cancer patients using conventional or complementary medicine. Onkologie 2002; 25(2): 165–170. |
A1) Thema/keine Misteltherapie |
|
Pederson SN, Emmers-Sommer TM. “I’m not trying to be cured, so there’s not much he can do for me”: hospice patients’ constructions of hospice’s holistic care approach in a biomedical culture. Death studies 2012; 36(5): 419–446. |
A1) Thema/keine Misteltherapie |
|
Raszeja VM, Jordens CF, Kerridge IH. Survey of practices and policies relating to the use of complementary and alternative medicines and therapies in New South Wales cancer services. Internal medicine journal 2013; 43(1): 84–88. |
A1) Thema/keine Misteltherapie |
|
Rausch SM, Winegardner F, Kruk KM, Phatak V, Wahner-Roedler DL, Bauer B und Vincent A. Complementary and alternative medicine: use and disclosure in radiation oncology community practice. Supportive Care in Cancer 2011; 19(4): 521–529. |
A1) Thema/keine Misteltherapie |
|
Richardson MA, Sanders T, Palmer JL, Greisinger A, Singletary SE. Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology. Journal of Clinical Oncology 2000; 18(13): 25052514. |
A1) Thema/keine Misteltherapie |
|
Ritvo P, Irvine J, Katz J, Matthew A, Sacamano J, Shaw BF. The patient’s motivation in seeking complementary therapies. Patient education and counseling 1999; 38(2): 161–165. |
A1) Thema/keine Misteltherapie |
|
Rogers M, Todd C. Information exchange in oncology outpatient clinics: source, valence and uncertainty. Psycho-oncology 2002; 11(4): 336–345. |
A1) Thema/keine Misteltherapie |
|
Salamonsen A. Doctor-patient communication and cancer patients’ choice of alternative therapies as supplement or alternative to conventional care. Scandinavian journal of caring sciences 2013; 27(1): 70–76. |
A1) Thema/keine Misteltherapie |
|
Sanderson CR, Koczwara B, Currow DC. The “therapeutic footprint” of medical, complementary and alternative therapies and a doctor’s duty of care. The Medical journal of Australia 2006; 185(7): 373–376. |
A1) Thema/keine Misteltherapie |
|
Savas P, Robertson A, Beatty L, Hookings E, McGee M, Marker J, McCaleb B, Bowen J, Richards A und Koczwara B. Patient preferences on the integration of complementary therapy with conventional cancer care. Asia-Pacific journal of clinical oncology 2016; 12(2): e311‑8. |
A1) Thema/keine Misteltherapie |
|
Saxe GA, Madlensky L, Kealey S, Wu DP, Freeman KL, Pierce JP. Disclosure to physicians of CAM use by breast cancer patients: findings from the Women’s Healthy Eating and Living Study. Integrative cancer therapies 2008; 7(3): 122129. |
A1) Thema/keine Misteltherapie |
|
Smithson J, Britten N, Paterson C, Lewith G, Evans M. The experience of using complementary therapies after a diagnosis of cancer: A qualitative synthesis. Health 2012; 16(1): 19–39. |
A1) Thema/keine Misteltherapie |
|
Strait L, Furnham A. The Effects of Modern Health Worries and Psychological Distress on Complementary Medicine Use by Breast Cancer Patients. Journal of Clinical Research and Bioethics 2012; 3(1). |
A1) Thema/keine Misteltherapie |
|
Theobald S, Theobald A, Nagel G. Beratungsbedarf und Beratungsqualität aus der Sicht von Patienten mit Krebs – eine Umfrage bei der 1. Offenen Krebskonferenz 2005 in Berlin. Deutsche Zeitschrift für Onkologie 2005; 37(3): 124–128. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
Theodoropoulos I, Manolopoulos K, Von Georgi R, Bohlmann M, Munstedt K. Physicians and complementary and alternative medicine cancer therapies in Greece: a survey. Journal of alternative and complementary medicine 2005; 11(4): 703–708. |
A4) nicht deutschsprachiger Raum |
|
Trimborn A, Senf B, Muenstedt K, Buentzel J, Micke O, Muecke R, Prott FJ, Wicker S und Huebner, J. working group Prevention and Integrative Oncology (PRIO) of the German Cancer Society. Attitude of employees of a university clinic to complementary and alternative medicine in oncology. Annals of Oncology 2013; 24(10): 2641–2645. |
A1) Thema/keine Misteltherapie |
|
Truant T, Bottorff JL. Decision making related to complementary therapies: a process of regaining control. Patient education and counseling 1999; 38(2): 131142. |
A1) Thema/keine Misteltherapie |
|
van der Weg F, Streuli RA. Use of alternative medicine by patients with cancer in a rural area of Switzerland. Swiss Medical Weekly 2003; 133(15–16): 233–240. |
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspat. unter 80 % |
|
von Rohr, E., Pampallona, S., van Wegberg, B., Cerny, T., Hürny, C., Bernhard, J., Helwig, S., Heusser, P.: Attitudes and beliefs towards disease and treatment in patients with advanced cancer using anthroposophical medicine. Onkologie 2000; 23: 558–563. |
A1) Thema/keine Misteltherapie |
|
Verhoef MJ, Boon HS, Page SA. Talking to cancer patients about complementary therapies: is it the physician’s responsibility? Current oncology 2008; 15(Suppl. 2): s88-93. |
A1) Thema/keine Misteltherapie |
|
Walach, H., Heusser, P.: Effektiv oder nicht? Entscheiden Sie selbst1 – Die PEK-HTA-Berichte. Forsch Komplementmed 2006; 13 Suppl 2: 2–3. |
A2) Publikationstyp |
|
Witt C. Wünsche und Überzeugungen von Krebspatienten im Hinblick auf |
A1) Thema/keine |
|
Beratung zu ganzheitlicher Medizin. Karger Kompass Onkologie 2015. 2(1): 3637. |
Misteltherapie |
|
Witt C. Onkologen sollten über die Misteltherapie informiert sein. Karger Kompass Onkologie 2017; 4:20–21. |
A2) Publikationstyp |
*Erläuterung der Ausschlussgründe:
A1) Thema/keine Misteltherapie: Das Thema der Publikation entspricht nicht den Einschlussgründen wie in Tabelle 17 beschrieben oder die Misteltherapie wird im Volltext gar nie erwähnt.
A2) Publikationstyp: die Veröffentlichung bezieht sich auf eine andere Studie, eine Übersichtsarbeit oder liegt nur als Zusammenfassung (Abstract) vor.
A3) Brustkrebs und Mistel nicht separat oder Anteil Brustkrebspatientinnen unter 80 %.
A4) bezieht sich nicht auf den deutschsprachigen Raum.
A5) Volltext nicht verfügbar.
A6) Doppelpublikation.
|
Literatur |
Ausschlussgrund |
|
Anonymous. Bristol study should be retracted. Bulletin of medical ethics 1991; 74: 3–6. |
A5) Volltext nicht verfügbar |
|
Adler SR, Fosket JR. Disclosing complementary and alternative medicine use in the medical encounter: a qualitative study in women with breast cancer. The Journal of family practice 1999; 48(6): 453–458. |
A1) nur implizit Ethik |
|
Barco I, Vidal MC, Fraile M, Vallejo E, Gimenez N, Garcia-Fernandez A. Advanced breast cancer following alternative medicine. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics 2016; 133(3): 378–379. |
A4) völlig anderes Thema |
|
Barnett AG, Clavarino A, Correa-Velez I, Eastwood H. Use of complementary and alternative medicine and quality of life: changes at the end of life. Palliative Medicine. 2003. 17(8): 695–703. |
A4) völlig anderes Thema |
|
Baverstock A, Finlay F. Faith healing in paediatrics: what do we know about its relevance to clinical practice? Child: care, health and development 2012; 38(3): 316–20. |
A3) Thema nicht übertragbar/ relevant |
|
Bayley C. Homeopathy. Journal of Medicine and Philosophy 1993; 18(2): 129145. |
A4) völlig anderes Thema |
|
Beider S. An Ethical Argument for Integrated Palliative Care. Evidence-based complementary and alternative medicine: eCAM. 2005. 2(2): 227–231. |
A3) Thema nicht übertragbar/relevant |
|
Ben-Arye E, Aharonson ML, Schiff E, Samuels N. Alleviating gastro-intestinal symptoms and concerns by integrating patient-tailored complementary medicine in supportive cancer care. Clinical nutrition 2015; 34(6): 1215–23. |
A4) völlig anderes Thema |
|
Bishop FL, Yardley L. Constructing agency in treatment decisions: negotiating responsibility in cancer. Health 2004; 8(4): 465–482. |
A5) Volltext nicht verfügbar |
|
Blumberg BS. Ethics and cancer therapy. Biomedicine & Pharmacotherapy 1993; 47(9): 393–395. |
A3) Thema nicht übertragbar/relevant |
|
Budd S, Sharma U. The Healing Bond: The Patient-Practitioner Relationship and Therapeutic Responsibility. Routledge 1994. |
A5) Volltext nicht verfügbar |
|
Clark-Grill M. Questionable gate-keeping: Scientific evidence for complementary and alternative medicines (CAM): Response to Malcolm Parker. Journal of Bioethical Inquiry 2007; 4(1): 21–28. |
A4) völlig anderes Thema |
|
Clark-Grill M. When listening to the people: Lessons from complementary and alternative medicine (cam) for bioethics. Journal of Bioethical Inquiry 2010; 7(1): 71–81. |
A3) Thema nicht übertragbar/relevant |
|
Cohen MH, Kemper KJ, Stevens L, Hashimoto D, Gilmour J. Pediatric use of complementary therapies: ethical and policy choices. Pediatrics 2005; 116(4): e568-75. |
A3) Thema nicht übertragbar/relevant |
|
Enskar K. Ethical aspects of judging the alternative treatment of children with cancer. Nursing ethics 1995; 2(1): 51–62. |
A4) völlig anderes Thema |
|
Ernst E. Complementary and Alternative Medicine: Between Evidence and Absurdity. Perspectives in Biology and Medicine 2009; 52(2): 289–303. |
A4) völlig anderes Thema |
|
Ernst E, H. CM, J. S. Ethical problems arising in evidence based complementary and alternative medicine. Journal of Medical Ethics 2004; 30(2): 156–159. |
A3) Thema nicht übertragbar/relevant |
|
Frunza M. Ethical Aspects of Spiritual Medicine. The Case of Intercessory Prayer Therapy. Journal for the Study of Religions and Ideologies 2007; 6(17): 101–115. |
A3) Thema nicht übertragbar/relevant |
|
Gilmour J, Harrison C, Asadi L, Cohen MH, Vohra S. Complementary and alternative medicine practitioners’ standard of care: responsibilities to patients and parents. Pediatrics 2011; 128(Suppl 4): S200-205. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Gilmour J, Harrison C, Asadi L, Cohen MH, Vohra S. Informed consent: advising patients and parents about complementary and alternative medicine therapies. Pediatrics 2011; 128(Suppl 4): S187-92. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Hansen K, Kappel K. The Proper Role of Evidence in Complementary/Alternative Medicine. Journal of Medicine and Philosophy 2010; 35(1): 7–18. |
A4) völlig anderes Thema |
|
Herbert M. Ethical Issues in Complementary and Alternative Medicine. Chisholm Health Ethics Bulletin 2005; 10(4): 9. |
A5) Volltext nicht verfügbar |
|
Humber JA, Almeder RF, Baume P. Book Reviews-Alternative Medicine and Ethics. Bioethics 1999; 13(2): 174–175. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Jackson J. Unproven treatment in childhood oncology – how far should paediatricians co-operate? Journal of medical ethics 1994; 20(2): 77–79. |
A4) völlig anderes Thema |
|
Kettner PDM. „Wunscherfüllende Medizin“ zwischen Kommerz und Patientendienlichkeit. Ethik in der Medizin 2006; 18(1): 81–91. |
A4) völlig anderes Thema |
|
Lewith GT, Young T. The Ethics of Complementary Medicine. Research Ethics 2008; 4(2): 52–55. |
A4) völlig anderes Thema |
|
McCullough LB. La frontera: responsibly managing borders and boundaries in clinical ethics. The Journal of medicine and philosophy 2010; 35(1):1–6. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Monaco GP, Smith G. Informed consent in complementary and alternative medicine: current status and future needs. Seminars in oncology 2002; 29(6): 601–608. |
A1) nur implizit Ethik |
|
Oguamanam C. From rivalry to rapproachement: Biomedicine, complementary alternative medicine (CAM) at ethical crossroads. HEC Forum 2006. 18(3): 245264. |
A3) Thema nicht übertragbar/relevant |
|
Parker M. Two into one won’t go: Conceptual, clinical, ethical and legal impedimenta to the convergence of Cam and orthodox medicine. Journal of Bioethical Inquiry 2007; 4(1): 7–19. |
A3) Thema nicht übertragbar/relevant |
|
Robotin MC, Penman AG. Integrating complementary therapies into mainstream cancer care: which way forward? The Medical journal of Australia 2006; 185(7): 377–379. |
A2) Thema unergiebig/oberflächlich behandelt |
|
Rosenthal DS, Dean-Clower E. Integrative medicine in hematology/oncology: benefits, ethical considerations, and controversies. Hematology American Society of Hematology Education Program 2005; 2005: 491–497. |
A2) Thema unergiebig/oberflächlich behandelt |
|
Seip R. Complementary and alternative medicine: ethics, legality, and use of the best available science 2015. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Shaw D. Homeopathy Is where the harm Is: five unethical effects of funding unscientific remedies. Journal of Medical Ethics; 2010. 36(3):130–131. |
A3) Thema nicht übertragbar/relevant |
|
Smith CJ. Humber, James M., and Robert F. Almeder, eds. Alternative Medicine and Ethics. The National Catholic Bioethics Quarterly 2001; 1(2): 275–277. |
A2) Thema unergiebig/ oberflächlich behandelt |
|
Smith K, Ernst E, Colquhoun D, Sampson W. ‘Complementary & Alternative Medicine’: Ethical and Policy Issues. Bioethics 2016; 30(2): 60–62. |
A5) Volltext nicht verfügbar |
|
Somogyi E. Drugs and medical ethics. Medicine and law 1993. 12(1–2): 29–31. |
A5) Volltext nicht verfügbar |
|
Stone J. Alternative Medicine and Ethics. Journal of Medical Ethics 1999; 25(5): 425. |
A2) Thema unergiebig/oberflächlich behandelt |
|
Truant T, McKenzie M. Discussing complementary therapies: there’s more than efficacy to consider. CMAJ: Canadian Medical Association journal = journal de l’Association medicale canadienne 1999; 160(3): 351–352. |
A1) nur implizit Ethik |
Tabelle 107: Risk of Bias Tool der Cochrane Collaboration für RCT
|
Biasdomäne |
Bewertung* |
Begründung der Bewertung |
Textseite |
|
Generierung der Randomisierungssequenz (selection bias) |
Zitat: Kommentar: |
||
|
Verdeckte Gruppenzuteilung (selection bias) |
Zitat: Kommentar: |
||
|
Verblindung von Studienpersonal/-teilnehmern (performance bias) |
Zitat: Kommentar: |
||
|
Verblindung bei der Endpunkterhebung/-bewertung (detection bias) |
Zitat: Kommentar: |
||
|
Fehlende Daten bei der Endpunkterhebung/-bewertung (attrition bias) |
Zitat: Kommentar: |
||
|
Selektives Berichten von Endpunkten (reporting bias) |
Zitat: Kommentar: |
||
|
Andere Ursachen für Bias |
Zitat: Kommentar: |
* Mögliche Ausprägungen: „Geringes RoB“, „Hohes RoB“ oder „Unklares RoB“.
RCT = Randomisierte kontrollierte Studie. RoB = Risk of bias.
Tabelle 108: Dokumentationsstruktur für die standardisierte Berichterstattung von gesundheitsökonomischen Primärstudien und Synthesen von Primärstudien (erarbeitet von der German
Scientific Working Group Technology Assessment for Health Care)96
-
1 Fragestellung und Evaluationsrahmen
-
1.1 Technologie
-
1.2 Fragestellung
-
1.3 Perspektive
-
1.4 Zeithorizont
-
1.5 Art der ökonomischen Evaluation
-
-
2 Studiendesign und Studien‑, beziehungsweise Zielpopulation
-
2.1 Studientyp
-
2.2 Datierung der zugrundeliegenden Daten
-
2.3 Studienpopulation/Zielpopulation
-
2.4 Setting
-
2.5 Spezifikation der Technologie
3 Gesundheitseffekte
-
(1) Primärstudie
-
3.1 Untersuchte Zielgrößen
-
3.2 Ein-/Ausschlusskriterien
-
3.3 Rekrutierungsmodus
-
3.4 Teilnahmerate
-
3.5 Reproduzierbarkeit der Studienergebnisse
-
3.6 Auswertung der Studie
-
3.7 Drop-Outs
-
3.8 Ergebnisse der Studie
-
3.9 Effektmaße für die ökonomische Analyse
-
3 Gesundheitseffekte
(2) Synthese von Primärstudien
-
3.1 In der Synthese untersuchte klinische Parameter
-
3.2 Annahmen
-
3.3 Berücksichtigung von Primärstudien: Studiendesigns und Ein-/Ausschlusskriterien
-
3.4 Quellen und Suchstrategie bei der Literaturrecherche
-
3.5 Validitäts- beziehungsweise Qualitätskriterien bei der Bewertung der Primärstudien
-
3.6 Methoden der Bewertung von Relevanz und Validität beziehungsweise Qualität der Primärstudien
-
3.7 Methoden der Extraktion von Daten aus den Primärstudien
-
3.8 Anzahl berücksichtigter Primärstudien
-
3.9 Methode der Synthese der gesundheitsbezogenen Parameter
-
3.10 Untersuchung der Heterogenität der gesundheitsbezogenen Parameter
-
3.11 Ergebnisse der Synthese
-
3.12 Effektmaße für die ökonomische Analyse
-
-
-
4 Kosten
-
4.1 Berücksichtigte Ressourcenveränderungen
-
4.2 Beschreibung des Mengengerüsts
-
4.3 Monetäre Bewertung des Mengengerüsts
-
4.4 Währung
-
-
5 Diskontierung
-
6 Ergebnisse
-
6.1 Ermittelte Gesundheitseffekte
-
6.2 Ermittelte Kosten
-
6.3 Synthese von Kosten und Effekten
-
-
7 Behandlung von Unsicherheiten
-
8 . Diskussion und Schlussfolgerungen der Autoren
-
8.1 Bemerkungen hinsichtlich Einschränkungen/Schwächen/Bias der Analyse
-
8.2 Bemerkungen hinsichtlich der Generalisierbarkeit der Ergebnisse (externe Validität)
-
8.3 Schlussfolgerungen
-
-
9 Kommentar
-
10 Ähnliche Publikationen/Originalpublikationen/Technische Reports (wenn vorhanden)
Checkliste methodischen Qualität
|
Autoren, Titel und Publikationsorgan: Schöffski O, Emmert M (2009): Vergleichende Kostenanalyse der Nachsorge beim Mammakarzinom unter besonderer Berücksichtigung von Mistelpräparaten Deutsche Zeitschrift für Onkologie |
1 = Kriterium erfüllt % = Kriterium teilweise erfüllt 0 = Kriterium nicht erfüllt n r = nicht relevant |
1, %, 0, nr |
Fragestellung
|
1 |
Wurde die Fragestellung präzise formuliert? |
1 |
|
2 |
Wurde der medizinische und ökonomische Problemkontext ausreichend dargestellt? |
1/2 |
Evaluationsrahmen
|
3 |
Wurden alle in die Studie einbezogenen Technologien hinreichend detailliert beschrieben? |
1/2 |
|
4 |
Wurden alle im Rahmen der Fragestellung relevanten Technologien verglichen? |
1 |
|
5 |
Wurde die Auswahl der Vergleichstechnologien schlüssig begründet? |
0 |
|
6 |
Wurde die Zielpopulation klar beschrieben? |
1/2 |
|
7 |
Wurde ein für die Fragestellung angemessener Zeithorizont für Kosten und Gesundheitseffekte gewählt und angegeben? |
1 |
|
8 |
Wurde der Typ der gesundheitsökonomischen Evaluation explizit genannt? |
1/2 |
|
9 |
Wurden sowohl Kosten als auch Gesundheitseffekte untersucht? |
0 |
|
10 |
Wurde die Perspektive der Untersuchung eindeutig gewählt und explizit genannt? |
1 |
Analysemethoden und Modellierung
|
11 |
Wurden adäquate statistische Tests/Modelle zur Analyse der Daten gewählt und hinreichend gründlich beschrieben? |
0 |
|
12 |
Wurden in entscheidungsanalytischen Modellen die Modellstruktur und alle Parameter vollständig und nachvollziehbar dokumentiert (in der Publikation beziehungsweise einem technischen Report)? |
nr |
|
13 |
Wurden die relevanten Annahmen explizit formuliert? |
nr |
|
14 |
Wurden in entscheidungsanalytischen Modellen adäquate Datenquellen für die Pfadwahrscheinlichkeiten gewählt und eindeutig genannt? |
nr |
Gesundheitseffekte
|
15 |
Wurden alle für die gewählte Perspektive und den gewählten Zeithorizont relevanten Gesundheitszustände berücksichtigt und explizit aufgeführt? |
nr |
|
16 |
Wurden adäquate Quellen für die Gesundheitseffektdaten gewählt und eindeutig genannt? |
nr |
|
17 |
Wurden das epidemiologische Studiendesign und die Auswertungsmethoden adäquat gewählt und beschrieben und wurden die Ergebnisse detailliert dargestellt? (falls auf einer einzelnen Studie basierend) |
nr |
|
18 |
Wurden angemessene Methoden zur Identifikation, Extraktion und Synthese der Effektparameter verwendet und wurden sie detailliert beschrieben? (falls auf einer Informationssynthese basierend) |
nr |
|
19 |
Wurden die verschiedenen Gesundheitszustände mit Präferenzen bewertet und dafür geeignete Methoden und Messinstrumente gewählt und angegeben? |
nr |
|
20 |
Wurden adäquate Quellen der Bewertungsdaten für die Gesundheitszustände gewählt und eindeutig genannt? |
nr |
|
21 |
Wurde die Evidenz der Gesundheitseffekte ausreichend belegt? (s. ggf. entsprechende Kontextdokumente) |
nr |
Kosten
|
22 |
Wurden die den Kosten zugrunde liegenden Mengengerüste hinreichend gründlich dargestellt? |
1/2 |
|
23 |
Wurden adäquate Quellen und Methoden zur Ermittlung der Mengengerüste gewählt und eindeutig genannt? |
1/2 |
|
24 |
Wurden die den Kosten zugrunde liegenden Preisgerüste hinreichend gründlich beschrieben? |
1/2 |
|
25 |
Wurden adäquate Quellen und Methoden zur Ermittlung der Preise gewählt und eindeutig genannt? |
1/2 |
|
26 |
Wurden die einbezogenen Kosten anhand der gewählten Perspektive und des gewählten Zeithorizontes schlüssig begründet und wurden alle relevanten Kosten berücksichtigt? |
1 |
|
27 |
Wurden Daten zu Produktivitätsausfallskosten (falls berücksichtigt) getrennt aufgeführt und methodisch korrekt in die Analyse einbezogen? |
1 |
|
28 |
Wurde die Währung genannt? |
1 |
|
29 |
Wurden Währungskonversionen adäquat durchgeführt? |
nr |
|
30 |
Wurden Preisanpassungen bei Inflation oder Deflation adäquat durchgeführt? |
0 |
Diskontierung
|
31 |
Wurden zukünftige Gesundheitseffekte und Kosten adäquat diskontiert? |
0 |
|
32 |
Wurde das Referenzjahr für die Diskontierung angegeben beziehungsweise bei fehlender Diskontierung das Referenzjahr für die Kosten? |
0 |
|
33 |
Wurden die Diskontraten angegeben? |
nr |
|
34 |
Wurde die Wahl der Diskontraten beziehungsweise der Verzicht auf eine Diskontierung plausibel begründet? |
0 |
Ergebnispräsentation
|
35 |
Wurden Maßnahmen zur Modellvalidierung ergriffen und beschrieben? |
nr |
|
36 |
Wurden absolute Gesundheitseffekte und absolute Kosten jeweils pro Kopf bestimmt und dargestellt? |
1/2 |
|
37 |
Wurden inkrementelle Gesundheitseffekte und inkrementelle Kosten jeweils pro Kopf bestimmt und dargestellt? |
nr |
|
38 |
Wurde eine für den Typ der gesundheitsökonomischen Evaluation sinnvolle Maßzahl für die Relation zwischen Kosten und Gesundheitseffekt angegeben? |
nr |
|
39 |
Wurden reine (nicht lebensqualitätsadjustierte) klinische Effekte berichtet? |
nr |
|
40 |
Wurden die relevanten Ergebnisse in disaggregierter Form dargestellt? |
1/2 |
|
41 |
Wurden populationsaggregierte Kosten und Gesundheitseffekte dargestellt? |
1/nr |
Behandlung von Unsicherheiten
|
42 |
Wurden univariate Sensitivitätsanalysen für die relevanten Parameter durchgeführt? |
nr |
|
43 |
Wurden multivariate Sensitivitätsanalysen für die relevanten Parameter durchgeführt? |
nr |
|
44 |
Wurden Sensitivitätsanalysen für die relevanten strukturellen Elemente durchgeführt? |
nr |
|
45 |
Wurden in den Sensitivitätsanalysen realistische Werte oder Wertebereiche beziehungsweise Strukturvarianten berücksichtigt und angegeben? |
nr |
|
46 |
Wurden die Ergebnisse der Sensitivitätsanalysen hinreichend dokumentiert? |
nr |
|
47 |
Wurden adäquate statistische Inferenzmethoden (statistische Tests, Konfidenzintervalle) für stochastische Daten eingesetzt und die Ergebnisse berichtet? |
0 |
Diskussion
|
48 |
Wurde die Datenqualität kritisch beurteilt? |
1/2 |
|
49 |
Wurden Richtung und Größe des Einflusses unsicherer oder verzerrter Parameterschätzung auf das Ergebnis konsistent diskutiert? |
0 |
|
50 |
Wurde Richtung und Größe des Einflusses struktureller Modellannahmen auf das Ergebnis konsistent diskutiert? |
nr |
|
51 |
Wurden die wesentlichen Einschränkungen und Schwächen der Studie diskutiert? |
1/2 |
|
52 |
Wurden plausible Angaben zur Generalisierbarkeit der Ergebnisse gemacht? |
0 |
|
53 |
Wurden wichtige ethische und Verteilungsfragen diskutiert? |
0 |
|
54 |
Wurde das Ergebnis sinnvoll im Kontext mit unabhängigen Gesundheitsprogrammen diskutiert? |
0 |
Schlussfolgerungen
|
55 |
Wurden in konsistenter Weise Schlussfolgerungen aus den berichteten Daten/Ergebnissen abgeleitet? |
1/2 |
|
56 |
Wurde eine auf Wissensstand und Studienergebnissen basierende Antwort auf die Fragestellung gegeben? |
1/2 |
Tabelle 110: CASP-Checkliste zur Qualitätsbewertung der qualitativen Studien
Kriterium Ja Nein Unklar
Section A: Are the results of the study valid?
Abschnitt A: Sind die Ergebnisse der Studie gültig?
-
1. Was there a clear statement of the aims of the research?
Gab es eine klare Aussage zu den Zielen der Forschung?
-
2. Is a qualitative methodology appropriate?
Ist eine qualitative Methodik angemessen?
-
3. Was the research design appropriate to address the aims of the research?
War das Forschungsdesign für das Ziel der Forschung angemessen?
-
4. Was the recruitment strategy appropriate to the aims of the research?
War die Rekrutierungsstrategie für die Forschungsziele angemessen?
-
5. Was the data collected in a way that addressed the research issue?
Wurden die Daten so erhoben, dass das Forschungsproblem beantwortet werden könnte?
-
6. Has the relationship between researcher and participants been adequately considered?
Wurde das Verhältnis zwischen Forschendem und Teilnehmendem angemessen bedacht?
Section B: What are the results?
Abschnitt B: Was sind die Ergebnisse?
-
7. Have ethical issues been taken into consideration?
Wurden ethische Fragen berücksichtigt?
-
8. Was the data analysis sufficiently rigorous?
War die Datenanalyse ausreichend gründlich?
-
9. Is there a clear statement of findings?
Gibt es eine klare Aussage zu den Ergebnissen?
Section C: Will the results help locally?
Abschnitt C: Sind die Ergebnisse für die Zielpopulation hilfreich?
-
10. How valuable is the research?
Welchen Nutzen hat die Forschung?
CASP = Critical Appraisal Skills Programme.
Tabelle 111: Anpassung der CASP-Checkliste zur Qualitätsbewertung der Kohortenstudien an Querschnittstudien
|
Kriterium |
Kommentar |
|
Section A: Are the results of the study valid? Abschnitt A: Sind die Ergebnisse der Studie gültig? |
Frage wird beibehalten |
|
1. Did the study address a clearly focused issue? Hat sich die Studie mit einem klar fokussierten Thema befasst? |
Frage wird beibehalten |
|
2. Was the cohort recruited in an acceptable way? Wurde die Stichprobe in akzeptabler Weise rekrutiert? |
Änderung von „Kohorte“ zu „Stichprobe“ |
|
3. Was the exposure accurately measured to minimise bias? Wurde die Belichtung genau gemessen, um eine Verzerrung zu minimieren? |
Frage wird beibehalten |
|
4. Was the outcome accurately measured to minimise bias? Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? |
Frage wird beibehalten |
|
5a Have the authors identified all important confounding factors? Haben die Autoren alle wichtigen Confounder identifiziert? |
Frage entfällt; da kein kausaler Effekt untersucht wird, trifft hier das Confounder-Konzept nicht zu. Es kann höchstens Messfehler geben. |
|
5b Have they taken account of the confounding factors in the design and/or analysis? Haben sie die Confounder bei der Konzeption und/oder Analyse berücksichtigt? |
Frage entfällt, siehe Kommentar zu 5a |
|
6a Was the follow-up of subjects complete enough? War das Follow-up der Teilnehmer vollständig genug? |
Frage entfällt, da die Querschnittstudien kein Follow-up beinhalten. |
|
6b Was the follow-up of subjects long enough? Wurden die Teilnehmer lange genug nachverfolgt? |
Frage entfällt, siehe Kommentar zu 6b |
|
Section B: What are the results? Abschnitt B: Was sind die Ergebnisse? |
Wird beibehalten. |
|
7. What are the results of this study? Was sind die Ergebnisse dieser Studie? |
Frage entfällt; Frage bezieht sich laut den Hinweisen in der CASP-Checkliste auf einen einzigen Effektschätzer. Die Querschnittstudien zu den sozialen Aspekten beschreiben aber keine Effektschätzer |
|
8. How precise are the results? Wie präzise sind die Ergebnisse? |
Die Frage ist nicht anwendbar, da sie sich auf das jeweilige Konfidenzintervall eines Effektschätzers bezieht, aber da keine Effektschätzer berichtet werden, entfällt diese Frage. |
|
9. Do you believe the results? Sind die Ergebnisse glaubwürdig? |
Die Frage wird beibehalten. |
|
Section C: Will the results help locally? Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
Anpassung der Wortwahl in der Übersetzung auf „Zielpopulation“ |
|
10. Can the results be applied to the local population? Sind die Ergebnisse auf die Zielpopulation übertragbar? |
Die Frage wird beibehalten. |
|
11. Do the results of this study fit with other available evidence? Stimmen die Ergebnisse dieser Studie mit anderen verfügbaren Daten überein? |
Frage entfällt, da sie nicht anhand der einzelnen Studie, sondern nur in der Zusammenschau der Ergebnisse beurteilt werden kann. Dies geschieht im Diskussionsteil des vorliegenden Berichts. |
|
12. What are the implications of this study for practice? Was bedeutet diese Studie für die Praxis? |
Frage entfällt, weil sie ebenso wie Frage 11 nur in der Zusammenschau der Ergebnisse beurteilt werden kann. Dies geschieht im Diskussionsteil des vorliegenden Berichts. Im Original ist hier eine Tickbox, die mit der Frage nicht übereinstimmt. |
CASP = Critical Appraisal Skills Programme.
Tabelle 112: Cochrane Risk of Bias-Tool für Semiglazov et al. (2004)
|
Biasdomäne |
Bewertung |
Begründung der Bewertung |
Textseite |
|
|
Generierung der Randomisierungssequenz (selection bias) |
Geringes RoB |
Zitat: “Patients were allocated on the basis of a computer-generated randomisation list to the treatment groups [placebo and 10, 30 or 70 ng mistletoe lectin (ML)/ml] |
S. |
1294 |
|
Verdeckte Gruppenzuteilung (selection bias) |
Unklares RoB |
Kommentar: Gruppenzuteilung nicht berichtet, nur Randomisierung beschrieben und dass nur für den Notfall versiegelte Briefumschläge mit der Gruppenzuteilung hinterlegt sind. |
||
|
Verblindung von Studienpersonal/ ‑teilnehmenden (performance bias) |
Unklares RoB |
Bei subjektiven Zielgrößen (GLQ‑8, Spitzer-Analogskala, EORTC-QLQ-C30, systemische UAW) Zitat: “The patients received 0.5 ml of the study medication PS76A2 subcutaneously twice weekly for 15 consecutive weeks. The study medications (placebo or verum) were identical in terms of appearance, smell, color and packaging“, aber unklar ob die Verblindung funktioniert hat.“ |
S. |
1294 |
|
Geringes RoB |
Bei objektiven Zielgrößen (Lokalreaktionen, Laborparameter) Kommentar: geringes RoB, weil die Studie doppelt verblindet und placebo-kontrolliert ist und auch ein Aufdecken der Verblindung wenig Einfluss hätte. |
S. |
1294 |
|
|
Verblindung bei der Endpunkterhebung/ ‑bewertung Wirksamkeit (detection bias) |
Unklares RoB |
Bei subjektiven Zielgrößen (QLQ‑8, Spitzer-Analogskala, EORTC-QLQ-C30, systemische UAW) Kommentar: Alle Messinstrumente für die Lebensqualität sind subjektive Zielgrößen. Da durch die Lokalreaktionen die Verblindung aufgehoben werden könnte, ergibt sich ein unklares Biasrisiko |
S. |
1294 |
|
Geringes RoB |
Bei objektiven Zielgrößen (Laborparameter) „Beurteilung der kausalen Beziehung zur Misteltherapie erfolgte durch die Investigatoren unter doppeltverbündeten Bedingungen“ Kommentar: Keine unabhängige Outcomeerhebung berichtet, aber Einflusswahrscheinlichkeit bei objektiven Zielgrößen erscheint gering. |
S. |
1294 |
|
|
Fehlende Daten bei der Endpunkterhebung/ ‑bewertung (attrition bias) |
Geringes RoB |
Zitat: No loss to follow-up |
S. |
1294 |
|
Selektives Berichten von Endpunkten (reporting bias) |
Unklares RoB |
Zitat: “For 4 patients (placebo: n = 2, low dose: n = 1, high dose: n = 1), an adverse event led to the premature discontinuation ofthe trial, […] The investigator and the pharmacological committee judged this serious adverse event as not related to the study medication,” Kommentar: Kein veröffentlichtes Protokoll; das nicht signifikante Ergebnis des EORTC-QLQ-C30 wurde nur kurz im Text beschrieben, aber ohne Konfidenzintervall oder p‑Wert. |
S. 1297, Tabelle 2 |
|
Andere Ursachen für Bias |
Geringes RoB |
Keine andere Ursache für Bias aufgefallen |
CASP = Critical Appraisal Skills Programme. EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. EORTC = European Organisation for Research and Treatment of Cancer. GLQ‑8 = Global Life Quality Questionnaire (Fragebogen zur Lebensqualität). RoB = Risk of Bias. RoB = Risk of Bias (Es gibt drei mögliche Kategorien für die Bewertung: Geringes RoB, Hohes RoB, unklares RoB). UAW = Unerwünschte Arzneimittelwirkung.
Tabelle 113: Cochrane Risk of Bias-Tool für Semiglazov et al. (2006)
|
Biasdomäne |
Bewertung |
Begründung der Bewertung |
Textseite |
|
|
Generierung der Randomisierungssequenz (selection bias) |
Geringes RoB |
Zitat: “Patients were allocated to the treatment groups (PS76A2 or placebo) on the basis of a computer-generated randomisation list.” |
S. |
1520 |
|
Verdeckte Gruppenzuteilung (selection bias) |
Unklares RoB |
Kommentar: Gruppenzuteilung nicht berichtet, nur Randomisierung beschrieben, dass Verum und Placebo nicht voneinander zu unterscheiden sind und dass nur für den Notfall versiegelte Briefumschläge mit der Gruppenzuteilung hinterlegt sind. |
S. |
1520 |
|
Verblindung von Studienpersonal/-teilnehmern (performance bias) |
Unklares RoB |
Bei subjektiven Zielgrößen (GLQ‑8, Spitzer-Analogskala, FACT‑G oder systemische UAW) Zitat: “The patients received 0.5 ml of the study medication PS76A2 subcutaneously twice weekly for 15 consecutive weeks. The study medications (placebo or verum) were identical in terms of appearance, smell, colorand packaging“ Kommentar: Durch Lokalreaktionen kann leicht eine Entblindung für Patientinnen geschehen |
S. |
1520 |
|
Geringes RoB |
Bei objektiven Zielgrößen (Laborparameter) Kommentar: geringes RoB, weil die Studie doppelt verblindet und placebo-kontrolliert ist und ein Aufdecken der Verblindung keinen Einfluss hätte. |
|||
|
Verblindung bei der Endpunkterhebung/-bewertung (detection bias) |
Unklares RoB |
Bei subjektiven Zielgrößen (GLQ‑8, Spitzer-Analogskala, systemische UAW) Kommentar: Alle Messinstrumente für die Lebensqualität sind subjektive Zielgrößen. Da durch die Lokalreaktionen die Verblindung aufgehoben werden könnte, ergibt sich ein unklares Biasrisiko. |
||
|
Geringes RoB |
Keine unabhängige Outcomeerhebung berichtet. Bei objektiven Zielgrößen (Laborparameter) Doppelte Verblindung, auch bei Entblindung wegen Lokalreaktionen erscheint Verzerrungspotenzial bei objektiven Zielgrößen. |
|||
|
Fehlende Daten bei der Endpunkterhebung/-bewertung (attrition bias) |
Geringes RoB |
Kommentar: kaum fehlende Werte oder loss to follow-up, Angabe von p‑Werten und Boxplots mit grafisch erkennbaren Konfidenzintervallen Tabellen 2–4, Abbildung 1 |
S. 1522 1525 |
|
|
Selektives Berichten von Endpunkten (reporting bias) |
Unklares RoB |
Kommentar: Kein veröffentlichtes Protokoll |
||
|
Andere Ursachen für Bias |
Geringes RoB |
Keine andere Ursache für Bias aufgefallen |
||
FACT‑G = Functional Assessment of Cancer Therapy – General. GLQ‑8 = Global Life Quality. RoB = Risk of Bias (Es gibt drei mögliche Kategorien für die Bewertung: Geringes RoB, hohes RoB, unklares RoB). UAW = Unerwünschte Arzneimittelwirkung.
|
Biasdomäne |
Bewertung |
Begründung der Bewertung |
Textseite |
|
|
Generierung der Randomisierungssequenz (selection bias) |
Geringes RoB |
Zitat: For randomization variable block sizes were used. […] The randomization sequence was generated by Clinical Research Dr. Tröger (CRDT), using SPSS®. |
2009 S. |
37 |
|
Verdeckte Gruppenzuteilung (selection bias) |
Geringes RoB |
Zitat: “Allocation concealment was implemented by using sealed envelopes, prepared by CRDT. […] sealed randomization envelopes were stored in the Department of Study Coördination, IORS and released consecutively for each enrolled patient.” |
2009 S. |
37 |
|
Verblindung von Studienpersonal/-teilnehmern (performance bias) |
Hohes RoB |
Bei subjektiven Zielgrößen (EORTC-QLQ-C30, systemische UAW) Kommentar: subjektive Zielgröße und keine Verblindung |
2009 S. |
37 |
|
Geringes RoB |
Bei objektiven Zielgrößen (Laborparameter), krankheitsfreies Überleben |
|||
|
Verblindung bei der Endpunkterhebung/-bewertung (detection bias) |
Hohes RoB |
Bei subjektiven Zielgrößen (EORTC-QLQ-C30, systemische UAW) Kommentar: Keine Verblindung berichtet; wenn Patientinnen wissen, in welcher Gruppe sie sind, ergibt sich ein hohes Verzerrungspotenzial. Keine vorab festgelegten Entscheidungskriterien für Lokalreaktion |
S. 37 |
|
|
Unklares RoB |
Bei objektiven Zielgrößen (Laborparameter), krankheitsfreies Überleben Kommentar: Keine Verblindung berichtet. |
2009, 2012 |
||
|
Fehlende Daten bei der Endpunkterhebung/-bewertung (attrition bias) |
Geringes RoB |
Kommentar: Fast kein loss to follow-up (Tröger 2009) 0 beziehungsweise 3 % Geringer loss to follow-up nach 5 Jahren 7 beziehungsweise 6 %. |
2009 S.39 2012 S.175 |
|
|
Selektives Berichten von Endpunkten (reporting bias) |
Unklares RoB |
Kommentar: Kein veröffentlichtes Protokoll |
S. 37 |
|
|
Andere Ursachen für Bias |
Geringes RoB |
Keine andere Ursache für Bias aufgefallen |
||
EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. RoB = Risk of Bias (Es gibt drei mögliche Kategorien für die Bewertung: Geringes RoB, Hohes RoB, unklares RoB). UAW = Unerwünschte Arzneimittelwirkungen.
|
Biasdomäne |
Bewertung |
Begründung der Bewertung |
Textseite |
|
|
Generierung der Randomisierungssequenz (selection bias) |
Geringes RoB |
Zitat: The randomization sequence was generated by Clinical Research Dr. Troger (CRDT), using SPSS (SPSS 14.0.1, SPSS Inc., Chicago, Ill, USA). |
2014 S. |
2 |
|
Verdeckte Gruppenzuteilung (selection bias) |
Geringes RoB |
Zitat: “Allocation concealment was implemented by using sealed envelopes, prepared by CRDT. Patients were enrolled by investigators at the Outpatient Clinic of the IORS, while the sealed randomization envelopes were stored in the Department of Study Coördination of the IORS and released consecutively for each enrolled patient.” |
2014 S. |
2 |
|
Verblindung von Studienpersonal/-teilnehmern (performance bias) |
Hohes RoB |
Zitat: “The study was not placebo-controlled” Kommentar: Da kein Placebo gegeben wird, gibt es keine Verblindung Bei subjektiven Zielgrößen (Lebensqualität) |
2014 S. |
2 |
|
Unklares RoB |
Bei objektiven Zielgrößen (Lokalreaktionen, Laborparameter) Kommentar: Keine Verblindung und keine Angaben zur Vorabfestlegung der Entscheidungskriterien, wenn die Entscheidungsgrundlagen für die Bewertung der UAW in einem Protokoll hinterlegt wären, dann wäre es geringes RoB, |
|||
|
Verblindung bei der Endpunkterhebung/-bewertung (detection bias) |
Hohes RoB |
Kommentar: Keine Verblindung berichtet, aber beim Endpunkt subjektive Lebensqualität (gemessen über EORTC-QLQ-C30) kann eine hohe Einflusswahrscheinlichkeit auf das Antwortverhalten der Patientinnen resultieren. Keine vorab festgelegten Entscheidungskriterien für Lokalreaktion; |
S. 2 |
|
|
Unklares RoB |
Bei objektiven Zielgrößen (Laborparameter, krankheitsfreies Überleben) Kommentar: Keine Verblindung berichtet und Neutropenie ist definiert als neutrophil count <1,000^1. |
S. 2 |
||
|
Fehlende Daten bei der Endpunkterhebung/-bewertung (attrition bias) |
18 Wochen Unklares RoB 5 Jahre Geringes RoB |
Kommentar: Akzeptabler loss to follow-up, aber unterschiedlich hoher loss to follow-up in den Gruppen (2014) circa 15 beziehungsweise 3 %. Es wird ein Ersatz von ausgefallenen Patientinnen berichtet, ohne genaue Beschreibung. Eventuell ist Intention-to-treat-Prinzip infrage gestellt. Akzeptabler Loss to-follow-up nach 5 Jahren, aber unterschiedlich zwischen Gruppen 15 bzw 3 % (Tröger 2016) |
2014 S. 2016 S. 107 |
2 |
|
Selektives Berichten von Endpunkten (reporting bias) |
Unklares RoB |
Kommentar: Kein veröffentlichtes Protokoll |
S. 3–4 |
|
|
Andere Ursachen für Bias |
Geringes RoB |
Keine andere Ursache für Bias aufgefallen |
||
EORTC-QLQ-C30 = Krebsspezifischer Fragebogen zur Lebensqualität der European Organisation for Research and Treatment of Cancer. RoB = Risk of Bias; Es gibt drei mögliche Kategorien für die Bewertung: Geringes RoB, Hohes RoB, unklares RoB.
In den folgenden Tabellen wurde die angepasste und gekürzte Fassung der CASP-Checkliste für Kohortenstudien verwendet, „CASP-Querschnittstudien-Checkliste“ genannt. Anmerkungen zu den Änderungen sind in
Tabelle 111 beschrieben. Bei der Frage QS4 wird die Zielgröße „Häufigkeit der Inanspruchnahme der Misteltherapie“ getrennt von den weiteren Zielgrößen bewertet, da das Kriterium voll erfüllt ist, sobald Angaben zur Inanspruchnahme der Misteltherapie für die Patientinnen mit Brustkrebs getrennt berichtet sind, aber andere Arten der Verzerrung möglich sind für mit der Misteltherapie assoziierte Merkmale oder die Zielgrößen Z2 bis Z9. Für QS4 sind somit zwei Bewertungen möglich. Die Bewertung „x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
Studien aus Patientinnenperspektive
Tabelle 116: CASP-Querschnittstudien-Checkliste für Drozdoff et al. (2018)
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Die systematische Erfassung von pflanzlichen KAM-Verfahren („biologically-based complementary medication“) bei Patientinnen mit Brustkrebs oder gynäkologischen Krebsarten, um bislang bestehende Wissenslücken bei der verfügbaren Evidenz zu schließen. (S. 2) |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Konsekutive Rekrutierung aller Patientinnen in zwei definierten Perioden in einer Klinik, Teilnahmerate von 62,5 %. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Krebsdiagnose musste, zusammen mit der vollständigen Krankenakte, von der behandelden Ärztin beziehungsweise vom behandelnden Arzt bestätigt werden. Auch die laufende Dokumentation zur Therapie, die Misteltherapie eingeschlossen, wurde von der behadelnden Ärztin beziehungsweise vom behandelnden Arzt dokumentiert. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Es handelt sich um eine Prävalenzstudie, in der es nicht um Nachweis kausaler Zusammenhänge geht. Die Prävalenz von pflanzlichen KAM ist nur für die Misteltherapie bei Patientinnen mit Brustkrebs und gynäkologische Krebsarten berichtet, nicht für die Misteltherapie bei Patientinnen mit Brustkrebs getrennt. Gleiches gilt für die Patientencharakteristika. Ein Erinnerungsbias bezüglich der Anwendung von KAM-Verfahren könnte vorliegen. |
x*/x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Können die Ergebnisse für die Zielpopulation angewendet werden? Kommentar: Die Studienpopulation stammt aus einer Universitätsklinik und es ist unklar, ob die Nutzung von KAM in anderen Settings z. B. onkologischen Praxen vergleichbar ist. Zudem könnten die Häufigkeit der Inanspruchnahme der Misteltherapie sowie die statistisch assoziierten Merkmale durch die 19,2 % Patientinnen mit gynäkologischen Krebsarten beeinflusst sein. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Forschungsfragen sind erst im Ergebnisteil formuliert, dort aber klar. Wird hier nur für Inanspruchnahme für für Verwendung von KAM herangezogen. |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Die Teilnehmenden wurden in verschiedenen Studienzentren rekrutiert und ihre Anzahl ist mit 1.030 Patientinnen hoch. Die Interviewenden wurden zufällig ausgewählt, aber wie die zufällige Auswahl vollzogen wurde, ist nicht beschrieben, daher ist das Verzerrungspotenzial unklar. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Exposition besteht aus der Brustkrebserkrankung und den Angaben zur Inanspruchnahme der Misteltherapie. DieBrustkrebserkrankung wird durch einen Fragebogen bei den Patientinnen erhoben, da keine Details zur Erkrankung, sondern nur die Krebserkrankung als solche relevant sind, kann die Erhebung als valide betrachtet werden. Bei der Erhebung der Anwendung der Misteltherapie könnte es zu einem Erinnerungsbias bei den Patientinnen kommen, aber das Risiko wird als gering eingestuft, da die Interviewer direkt nach der Anwendung fragen. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Studie wird nur zur Bewertung der Prävalenz von KAM beziehungsweise der Misteltherapie verwendet. Die Angaben zur Inanspruchnahme beziehen sich auf Patientinnen mit Brustkrebs mit Misteltherapie. Obwohl in der Studie auch gynäkologische Krebspatientinnen vertreten sind, wird die Häufigkeit der Inanspruchnahme für die Misteltherapie getrennt berichtet. Zusätzlich zur Prävalenz wurden einige Patientencharakteristika erhoben, wie zur Partnerschaft, dem Auftreten von Rezidiven, dem Beschäftigungsstatus und dem Bildungsstand, die auf Grundlage der Aussagen der Patientin erhoben wurden. |
x*/x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Können die Ergebnisse auf die einheimische Bevölkerung angewendet werden? Kommentar: Die Studie im klinischen Setting kann mit hoher Wahrscheinlichkeit auch auf die Zielpopulation des HTA-Berichts, Patientinnen mit Brustkrebs in Deutschland, übertragen werden, da die Studie mehrere Studienzentren im Großraum Düsseldorf beinhaltet und eine Teilmenge der Zielpopulation darstellt. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. HTA = Health Technology Assessment. KAM = Komplementäre und alternative Medizin.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Die Studie hat systematisch bei Patientinnen mit fortgeschrittenem Brustkrebs das Interesse für und die Inanspruchnahme von KAM erhoben. Ziel der Studie ist, die Häufigkeit der Inanspruchnahme von KAM zu bestimmen und vorherzusagen, welche Patientinnen eher geneigt sind, KAM anzuwenden, um die Beratung und Hilfestellung an die Bedürfnisse der Patientinnen anzupassen. |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Die Rekrutierung und die Befragung sind nicht im Detail beschrieben, nur die Einschlusskriterien sind genannt. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Eine Brustkrebsdiagnose und ein fortgeschrittener Verlauf der Erkrankung sind Einschlusskriterien für die Studienteilnahme und wurden somit mit hoher Wahrscheinlichkeit von den Studienärzten überprüft. Ob die tatsächliche Inanspruchnahme von KAM beziehungsweise der Misteltherapie validiert ist, ist nicht beschrieben. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Da die Zielgröße in dieser Studie nicht die tatsächliche Inanspruchnahme, sondern das Interesse an KAM ist, ist eine Interessensbekundung seitens der Patientin in der vorliegenden Studie per Definition bereits ein valides Ergebnis. Welchen Einfluss eine mögliche zeitliche Distanz auf die Angaben zur Inanspruchnahme hat, ist fraglich. |
x* |
x |
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Können die Ergebnisse auf die einheimische Bevölkerung angewendet werden? Kommentar: Wahrscheinlich sind die Ergebnisse nicht auf die durchschnittliche deutsche Patientenpopulation mit Brustkrebs übertragbar, weil nur schwere Fälle betrachtet werden und die Misteltherapie einen kleinen Anteil an den gesamten hat, aber da die Anwendung von Mistelpräparaten laut manchen Studien vor allem mit Zunahme des Schweregrads der Erkrankung zunimmt, erscheinen die Angaben zur Inanspruchnahme aussagekräftig. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: “The purpose of this article is to depict the attitude of breast cancer patients using the internet as a source of information and for communication with fellow sufferers regarding CAM, their usage behavior, and their experiences with CAM; population: patients using internet as source of information” (S. 61) |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Rekrutierung über krebskompass.de (mittlerweile krebs-kompass.org), der größten deutschsprachigen Online-Plattform, jedoch gibt es Hinweise verärgerter Nutzender, dass Personen, die Kommentare zu KAM-Verfahren posten, umgehend von der Plattform ausgeschlossen werden. Diese Aussagen können nicht bewiesen werden, aber das Gegenteil auch nicht. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Nicht beschrieben, aber weder die Anwendung von KAM noch die Brustkrebserkrankung können validiert sein, da die Angaben im Online-Fragebogen von nicht-nachvollziehbaren Anwendern der Online-Plattfom gegeben wurden. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Inanspruchnahme und Motivation für die Verwendung wurden erhoben, nur ist keine Prüfung der Angaben möglich, da die Teilnehmerinnen und Teilnehmer nicht bekannt sind. Die weiteren Ergebnisse, zusätzlich zur Inanspruchnahme, beziehen sich auf KAM-Verfahren im Allgemeinen. Für diese Gruppe sind die Ergebnisse genau erhoben. |
x*/x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? Kommentar: Die Ergebnisse zu den adressierten sozialen Aspekten decken sich mit anderen Studienergebnissen, vor allem aus den qualitativen Interviews, aber die Unzufriedenheit mit der Misteltherapie ist unerwartet hoch. Eine Diskussion fehlt in der Veröffentlichung. |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Können die Ergebnisse für die Zielpopulation angewendet werden? Kommentar: Für Deutschland könnten die Ergebnisse repräsentativ sein, aber nur für den Teil der Bevölkerung, der das Internet aktiv nutzt. Die Zielpopulation des HTA-Berichts ist allgemeiner und bezieht sich vor allem auch auf Patientinnen, die sich in einer schulmedizinischen Behandlung befinden und im Rahmen der institutionellen Versorgung informiert werden sollen. Die Übertragbarkeit ist daher unklar. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. CAM = KAM = Komplementäre und alternative Medizin. HTA = Health Technology Assessment.
Kriterium Ja Nein Unklar
Abschnitt A: Sind die Ergebnisse der Studie gültig?
-
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? x
Kommentar: Ja, die Studie untersucht den zusätzlichen Nutzen von KAM-Verfahren bei Patientinnen mit Brustkrebs, die eine Standardtherapie erhalten und vergleicht Anwenderinnen und Nicht-Anwenderinnen von KAM bezüglich der psychischen Bewältigungsstategie für die Krebserkrankung, die subjektive Begründung für die Krankheit und die Lebensqualität.
-
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? x
Kommentar: Patientinnen, die sich bereits in Behandlung in der Brustkrebsambulanz befinden, wurden während eines Behandlungsbesuchs auf die Studie aufmerksam gemacht. Die Rekrutierung hat nur in der Brustkrebsambulanz in Innsbruck stattgefunden. Dadurch besteht die Gefahr, einer Verzerrung durch die Behandlungspraxis der Ärzte in der entsprechenden Abteilung.
-
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? x
Kommentar: Das Vorliegen einer Brustkrebserkrankung wird als gesichert angesehen, weil die Rekrutierung nur bei Patientinnen stattfand, die sich bereits in Behandlung befinden. Die Inanspruchnahme der Misteltherapie wird aufgrund der Angaben der Patientinnen erhoben. Bei der Erhebung der Inanspruchnahme der Misteltherapie als eines der KAM-Verfahren in der Studie ist unklar, wie nach der Misteltherapie gefragt wurde, ob die Patientinnen nur danach gefragt wurden, welche KAM-Verfahren sie anwenden oder ob sie direkt gefragt wurden, ob sie die Misteltherapie anwenden.
Theoretisch wäre ein Abgleich der Angaben durch die behandelnden Ärzte möglich, doch wird davon nichts in der Publikation beschrieben. Eine Vorenthaltung von Informationen zur Inanspruchnahme von KAM wäre trotz Anonymisierung der Datenerhebung denkbar, falls die Behandlung nicht mit der/dem behandelnden Onkologin/Onkologen abgesprochen ist.
-
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? x*/x
Kommentar: Die Angaben zur Inanspruchnahme beziehen sich auf Patientinnen mit Brustkrebs und Misteltherapie. In der Erhebung wurden einige soziodemografische und klinische Variablen erhoben, wie Stadium und Dauer der Erkrankung, Standardtherapie und Verwendung sonstiger Medikamente. Die Angaben wurden über validierte Fragebögen erhoben. Die Gefahr einer Verzerrung bei den Angaben ist möglich, aber gering. Neben Patientinnencharakteristika beinhaltet die Studie auch Ergebnisse zu Gründen für die Anwendung der Misteltherapie und Erwartungen an die Misteltherapie. Diese Gründe beziehen sich zwar auf KAM-Verfahren im Allgemeinen, jedoch sind die Gründe so allgemein, dass die Misteltherapie dadurch wahrscheinlich auch abgebildet ist.
Abschnitt B: Was sind die Ergebnisse?
9. Sind die Ergebnisse glaubwürdig? x
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar?
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? x
Kommentar: Für den niedergelassenen Sektor im deutschsprachigen Bereich ist die Population grundsätzlich geeignet, aber die Rekrutierung aus einer einzigen Abteilung ist möglicherweise nicht repräsentativ für die deutsche Bevölkerung.
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Die Studie befasst sich mit Therapiedaten von Patientinnen und Patienten mit primärer Brustkrebsdiagnose (Diagnose C50/D05), bei denen integrative Behandlungen durchgeführt wurden. Es werden Qualitätsvergleiche zwischen dem zertifizierten Brustkrebszentrum dieser Studie und den landesweite Benchmarking-Kennzahlen anderer zertifizierter Brustkrebszentren in Deutschland durchgeführt. |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Brustkrebsfälle wurden nach deutschem OnkoZert ausgewählt. Die Verwendung der gesamten Krankenhausdatenbank schließt einen Selektionsbias innerhalb eines Krankenhauses aus. Zur Abklärung der externen Validität wurden die Kennzahlen des Studienzentrums mit Auswertungen des nationalen Jahresberichts zertifizierter Brustkrebszentren in Deutschland aus dem Jahr 2016 verglichen. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Verschiedene Qualitätsmessungen (2011–2015) des GKH BCC wurden verglichen mit Daten aus dem Brustkrebs-Benchmarking-Bericht 2016, der die Qualität der Maßnahmen aus den Jahren 2011 bis2014 von 275 zertifizierten landesweiten BCC in Deutschland (n = 52.965 Patienten) wiedergibt. |
x*/x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: In der retrospektiven Analyse der Patientendaten werden die vollständigen Patientenakten analysiert. Es könnten Dokumentationsfehler vorliegen, jedoch wird nicht grundsätzlich davon ausgegangen, dass unvollständig dokumentiert wurde. Bei der Anzahl der Teilnehmer (n = 741) erscheint eine Verzerrung der Ergebnisse dadurch unwahrscheinlich. |
x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? Kommentar: Die Rekrutierung in einem zertifizierten Brustkrebszentrum ist möglichweise nicht repräsentativ für die deutsche Bevölkerung, trotz Abgleich mit dem Jahresbericht. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. GKH BCC = Brustkrebszentrum am Gemeinschaftskrankenhaus Havelhöhe.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Ja, jedoch viele Fragestellungen auf einmal. |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: alle Patientinnen, die in den Zentren behandelt wurden innerhalb von zwei Monaten. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Eine Brustkrebserkrankung und die Inanspruchnahme von KAM wurde für den Einschluss in die Studie vorausgesetzt, aber nicht beschrieben, wie dies festgestellt wurde. Die Wahrscheinlichkeit ist hoch, dass die Einhaltung der Einschlusskriterien von den Studienärzten überprüft wurde, aber die Beschreibung ist unzureichend. In Bezug auf die Erhebung der Inanspruchnahme der Misteltherapie als eines der KAM-Verfahren in der Studie ist unklar, wie nach der Misteltherapie gefragt wurde, ob die Patientinnen nur danach gefragt wurden, welche KAM-Verfahren sie anwenden oder ob sie direkt gefragt wurden, ob sie die Misteltherapie anwenden. Patientinnencharakteristika sind nur für alle Patientinnen berichtet und nicht für Anwenderinnen der Misteltherapie oder vergleichbaren KIM. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Zahlen zur Inanspruchnahme sind genau gemessen. Als zusätzliches Ergebnis wurden die Berufsgruppen der Anwenderinnen und NichtAnwenderinnen verglichen. Die Aussagen der Patientinnen zu deren eigener Berufsgruppe, ob die Patientin Angestellte, Selbständige, Hausfrau oder Rentnerin ist, ist vermutlich nicht verzerrt. Die statistische Auswertung der assoziierten Merkmale ist in Ordnung. |
x*/x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? Kommentar: Die Beweggründe für die Verwendung einer Misteltherapie könnten von Patientinnen mit einer anderen Standardtherapie als der Bestrahlung unterschiedlich sein aufgrund der unterschiedlichen Nebenwirkungen. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin. KIM = Komplementäre und integrative Medizin.
Kriterium Ja Nein Unklar
Abschnitt A: Sind die Ergebnisse der Studie gültig?
-
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? x
Kommentar: Ja, die Querschnittstudie erörtert den Kommunikations- und Informationsbedarf von Patientinnen mit Brustkrebs im schulmedizinischen Setting.
-
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? x
Kommentar: Rekrutierung aus vier Studienzentren, um Patientinnen mit Brustkrebs aus jedem Stadium der Erkrankung zu bekommen, von neu diagnostizierten Patientinnen bis hin zu Patientinnen in der Rehabilitation oder Palliativversorgung und in der Nachsorge bis zu zehn Jahre nach der akuten Phase.
-
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? x
Kommentar: Die Bestätigung der Brustkrebserkrankung der Patientin erfolgte über die Krankenakte. Die Verwendung von KAM beziehungsweise der Misteltherapie basiert auf den Angaben der Patientin. Ein Erinnerungsbias zur Verwendung von KAM ist möglich, aber vermutlich nur in kleinem Ausmaß.
-
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? x*/x x
Kommentar: Die Angaben zur Inanspruchnahme beziehen sich auf Patientinnen mit Brustkrebs und Misteltherapie. Die verschiedenen angewendeten KAM-Typen beziehungsweise KAM-Interventionen werden im Text auch mit Prozentangaben getrennt berichtet. Neben der Inanspruchnahme wurden der Bildungsstand der Patientin und das Behandlungsziel (kurativ oder palliativ) über subjektive Angaben der Patientin erhoben. Die statistische Auswertung der assoziierten Merkmale ist in Ordnung.
Abschnitt B: Was sind die Ergebnisse?
9. Sind die Ergebnisse glaubwürdig? x
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar?
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? x
Kommentar: Die Rekrutierung in verschiedenen Studienzentren im deutschsprachigen Raum und der dadurch mögliche Einschluss von Patientinnen in verschiedenen Stadien des Behandlungsprozesses erhöht die Vergleichbarkeit mit der Zielpopulation und wird als wahrscheinlich gesehen.
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin.
|
Kriterium |
Ja Nein |
Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Die Studie untersucht, welche Aktivitäten Schweizer Patientinnen kurz nach der Brustkrebsdiagnose betreiben und über was sie informiert werden wollen beziehungsweise was sie unterstützend gerne aktiv betreiben würden. |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Grundsätzlich ist das Studienzentrum der richtige Ort, aber es wurde nur in einem Zentrum rekrutiert. Eine Beschreibung, wie die Rekrutierung ausgesehen hat, ist nicht vorhanden. Es wurde nur geschrieben, dass den konsekutiven Patientinnen am Brustkrebszentrum St. Gallen die Teilnahme angeboten wurde, aber nicht, von wem und wie. Unklar ist, ob die Personen angeschrieben wurden oder die Anwesenden angesprochen wurden und wenn ja, wie. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Brustkrebsdiagnose wird als gesichert angenommen, da die Patientinnen sich sonst nicht im Brustkrebszentrum in Behandlung befänden. Die Inanspruchnahme von KAM-Verfahren wurde über einen Fragebogen erhoben. Bei der Erhebung könnte es zu einem Erinnerungsbias gekommen sein, dass die Misteltherapie fälschlicherweise nicht angegeben wurde, aber die Wahrscheinlichkeit einer Verzerrung ist gering. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Angaben zur Inanspruchnahme beziehen sich auf Patientinnen mit Brustkrebs und Misteltherapie. Einige Charakteristika der Studienpopulation wurden erhoben: Zusammenleben mit einer anderen Person, Leben in einer ländlichen Gegend, private Krankenversicherung, die Ausbildungsstufe und das Geburtsland. Die Wahrscheinlichkeit, dass diese Charakteristika falsch angegeben werden ist gering. Die statistische Auswertung der assoziierten Merkmale ist in Ordnung. |
x*/x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? Kommentar: Die Population ist in der Schweiz ist vom Setting grundsätzlich übertragbar, aber da nur in einem Studienzentrum rekrutiert wurde, erscheint ein Einfluss durch das Setting auf die Therapiewahl als wahrscheinlich. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
CASP = Critical Appraisal Skills Programme. KAM = Komplementäre und alternative Medizin.
Studien aus der Perspektive des behandelnden Fachpersonals
Tabelle 125: CASP-Querschnittstudien-Checkliste für Kalder et al. (2001)
|
Kriterium |
Ja Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
|
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: Im Rahmen dieser deskriptiven Arbeit sollen die Meinungen und Präferenzen onkologisch tätiger Gynäkologinnen und Gynäkologen näher dargestellt und versucht werden, Anbietende und Nicht-Anbietende dieser Methoden näher zu charakterisieren, um neue fachspezifische Hypothesen für die Forschung zu gewinnen. |
x |
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Ausgabe der Fragebögen bei zwei großen Kongressen an 921 Gynäkologinnen und Gynäkologen. |
x |
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Exposition ist, dass die Personen Patientinnen mit Brustkrebs behandeln und sich bereits mit der Anwendung von KIM-Verfahren beschäftigt haben. Wenn die Gynäkologinnen und Gynäkologen dies mit ihrer Teilnahme bestätigen ist das Kriterium erfüllt. |
x |
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Zahlen zur Inanspruchnahme getrennt für die Misteltherapie entnehmbar. Charakteristika der Ärzte wurden über den Fragebogen erhoben. Eine Verzerrung bei den Einstellungen zur, Erwartungen an und Erfahrungen mit der Misteltherapie wird als gering eingestuft. |
x*/x |
|
Abschnitt B: Was sind die Ergebnisse? |
|
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
|
|
10. Können die Ergebnisse für die Zielpopulation angewendet werden? Kommentar: Die Tagungen scheinen repräsentativ zu sein für Ärzte im deutschsprachigen Raum und 250 Ärzte sind eine gute Stichprobengröße, jedoch unklar, ob die Ergebnisse die Einstellung der Ärzte circa 20 Jahre später adäquat abbilden. |
x |
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: “to evaluate and examine the degree of acceptance, usage, and implementation of integrative medicine among gynecological oncologists in Germany.” |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? Kommentar: Die Arbeitsgemeinschaft Gynäkologische Onkologie ist ein Verband, der genau die Zielgruppe beinhaltet; ein Abgleich der Stichprobe mit der Gesamtheit der AGO-Mitglieder wurde über demografische Charakteristika der Teilnehmer durchgeführt, mit dem Ergebnis, dass die Stichprobe in dieser Hinsicht repräsentativ ist. |
x |
|
|
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Für den Zweck der Studie ist die Exposition der Teilnehmenden vergleichbar. Die soziodemografischen Charakteristika der Teilnehmenden wurden mit den Charakteristika aller AGO-Mitglieder verglichen und ist in etwa konsistent. |
x |
|
|
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? Kommentar: Die Zahlen zur Inanspruchnahme sind extern erhoben und getrennt für die Misteltherapie erhoben. Der Fragebogen wurde von den Wissenschaftlern/innen selbst erstellt und ist nicht validiert, wodurch die die Bewertung „unklar“ zustande kommt. Allerdings wurde der Versuch unternommen, den Fragebogen durch die AG IMED extern zu validieren, um das Verständnis der Fragen zu verbessern. Die Erhebung über den Fragebogen erscheint angemessen. Ob das Antwortverhalten durch die Vorgaben im Fragebogen beeinflusst worden ist, insbesondere bei der Auswahl der komplementären Verfahren und den Gründen gegen eine Inanspruchnahme, ist unklar. |
x* |
x |
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
9. Sind die Ergebnisse glaubwürdig? Kommentar: Grundsätzlich schon, aber die Ausprägung der Zahlenwerte bei der Beratung könnte höher sein als in der Praxis, weil sich möglicherweise die Ärzte eher von der Befragung angesprochen gefühlt haben, die bereits mit KIM-Verfahren vertraut sind und selbst die eigenen Patientinnen beraten. |
x |
|
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
||
|
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? Kommentar: Die AGO ist eine große Fachgesellschaft und auch sonstige medizinische Fachkreise, die in die Behandlung von Patientinnen mit Brustkrebs involviert sind, wurden befragt. Aufgrund der niedrigen Rücklaufquote von 15,4 % und der ungewöhnlichen Verteilung der Charakteristika der Ärzte, insbesondere in Bezug auf den hohen Anteil der Personen, die in einem zertifizierten Zentrum arbeiten oder eine höhere Qualifikation wie eine Professur haben, kann ein Selektionsbias bestehen. Die Übertragbarkeit ist unklar. |
x |
|
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie.
AG IMED = Arbeitsgemeinschaft integrative Medizin. AGO = Arbeitsgemeinschaft Gynäkologische Onkologie. CASP = Critical Appraisal Skills Programme. KIM = komplementäre und integrative Medizin
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Hat sich die Studie mit einem klar fokussierten Thema befasst? Kommentar: |
x |
|
|
2. Wurde die Stichprobe in akzeptabler Weise rekrutiert? |
x |
Kommentar: Die Rekrutierung ist für den Studienzweck angemessen. Da es 2000 noch keine Online-Befragungen gab, ist die Verwendung eines Branchenbuchs für die Identifizierung der Ärzte eine gute Möglichkeit. Die Rücklaufquote lag bei 80,2% (202/250) der ausgegebenen Fragebogen, was durchaus darauf zurückzuführen sein könnte, dass die Fragebögen persönlich verteilt wurden und die potenziellen Teilnehmer eine Erläuterung erhielten.
3. Wurde die Exposition genau gemessen, um eine Verzerrung zu minimieren? x
Kommentar: Eine unklare Beschreibung, wie viele behandelte Patientinnen mit Brustkrebs es gab und ob die konventionelle Therapie bei den meisten Patientinnen tatsächlich stattgefunden hat (über 80 %). Auch die Darstellung über eine Gruppe „Misteltherapeuten“ und Therapeuten, die die Misteltherapie nur unter anderem anwenden erschwert die Beurteilung der Ergebnisse.
4. Wurde das Ergebnis genau gemessen, um eine Verzerrung zu minimieren? x* x
Kommentar: Die Zahlen zur Inanspruchnahme der Misteltherapie sind getrennt erhoben. Ein Bias durch die Auswahl der Ärzte ist möglich. Eine unklare Definition von unkonventioneller Medizin, die Unterteilung von Misteltherapeuten und UKT-Therapeuten ist kaum nachvollziehbar. Ebenso ist unklar wie genau nach der Motivation gefragt wurde und ob Freitextantworten möglich waren. Die Ableitung möglicher Prädiktoren für die Verwendung der Misteltherapie ist teilweise unklar dargestellt.
|
Abschnitt B: Was sind die Ergebnisse? |
|
|
9. Sind die Ergebnisse glaubwürdig? |
x |
|
Abschnitt C: Sind die Ergebnisse auf die Zielpopulation übertragbar? |
|
10. Sind die Ergebnisse auf die Zielpopulation übertragbar? x
Kommentar: Es ist unklar, ob die Befragung aus dem Jahr 2000 noch die Einstellung der Ärzte circa 20 Jahre später abbildet. 250 teilnehmende Ärzte ist jedoch eine verhältnismäßig große Stichprobe.
„x*“ bezieht sich ausschließlich auf die Häufigkeit der Inanspruchnahme der Misteltherapie
CASP = Critical Appraisal Skills Programme. UKT = Unkonventionelle Therapiemethoden.
9.4.2.2 Qualitative Studien
Tabelle 128: CASP-Checkliste Qualitative Studie für Brandenberger et al. (2012)
|
Kriterium |
Ja Nein Unklar |
Abschnitt A: Sind die Ergebnisse der Studie gültig?
|
1. Gab es eine klare Aussage zu den Zielen der Forschung? Kommentar: Ziel ist die Erhebung qualitativer Aspekte der Lebensqualität von Patientinnen mit Brustkrebs mit komplementärer Misteltherapie zu subjektiven Dimensionen der Lebensqualität wie der Bewältigung (S. 96). |
x |
|
2. Ist eine qualitative Methodik angemessen? Kommentar: Eine qualitative Methodik ist angemessen, weil das Ziel der Studie die Erfassung subjektiver Erfahrungen und Erlebnisse umfasst. |
x |
|
3. War das Forschungsdesign für das Ziel der Forschung angemessen? Kommentar: Qualitative halbstrukturierte Interviews mit Auswertung durch Inhaltsanalyse. |
x |
|
4. War die Rekrutierungsstrategie für die Forschungsziele angemessen? Kommentar: Patienten, die zur ambulanten Misteltherapie ins Paracelsus-Krankenhaus Richterswil kamen, wurden von der behandelnden Ärztin beziehungsweise vom behandelnden Arzt auf die Studie aufmerksam gemacht. Die Rekrutierung von vier Patientinnen mit Brustkrebs in nur einer Einrichtung könnte dazu führen, dass die Stichprobe |
x |
nicht repräsentativ ist. Dass nach vier Befragten bereits von einer theoretischen Sättigung auszugehen ist unwahrscheinlich.
-
5. Wurden die Daten so erhoben, dass das Forschungsproblem beantwortet werden könnte? x Kommentar: Die halbstrukturierten Interviews adressierten die Fragestellungen direkt, insbesondere die Bewältigungsstrategie und ließen Raum für zusätzliche Äußerungen der Patientinnen. Informationen zu den gesuchten Zielgrößen erscheinen als wahrscheinlich.
-
6. Wurde das Verhältnis zwischen Forschendem und Teilnehmendem angemessen bedacht? Kommentar: Der Interviewende ist ein/e angehende/r Ärztin beziehungsweise Arzt und Doktoratsstudent/in der Medizin und nicht der Behandelnde. Der Erfahrungsstand der/des angehenden Ärztin/Arztes zu qualitativer Datengenerierung sowie die Frage, ob eine Ärztin beziehungsweise ein Arzt der geeignete Interviewende zu komplementären Verfahren ist, ist unklar.
Abschnitt B: Was sind die Ergebnisse?
-
7. Wurden ethische Fragen berücksichtigt? x
Kommentar: Ethische Aspekte werden nicht konkret adressiert, jedoch wird die Einbeziehung ethischer Aspekte in der Studienplanung genannt. Die Studie wurde von der Ethikkommission des Kantons Zürich genehmigt und nach Angaben der Autoren entsprechend der Deklaration von Helsinki durchgeführt. (S. 96)
-
8. War die Datenanalyse ausreichend gründlich? x
Kommentar: Die geplante Datenanalyse wurde beschrieben. Die Ergebnisse der Datenextraktion sind in der Publikation228 zu allen Patienten in der Studie mit Ankerbeispielen belegt worden, jedoch nicht in der eingeschlossenen Publikation zu den vier Patientinnen mit Brustkrebs. Es fehlen zudem konkretere Ausführungen zum Kodierungsprozess und eine Methodentriangulation.
-
9. Gibt es eine klare Aussage zu den Ergebnissen? x
Kommentar: Die Ergebnisse wurden für alle Aussagen mit Zitaten belegt und können jeder der vier Brustkrebspatientinnen direkt zugeordnet werden. Allerdings werden in der Diskussion zum Teil Verbesserungen, die mit dem Studiendesign gar nicht nachgewiesen werden können, als gegeben angenommen.
Abschnitt C: Sind die Ergebnisse für die Zielpopulation hilfreich?
-
10. Welchen Nutzen hat die Forschung?
Kommentar: Die Ergebnisse leisten einen Beitrag zum besseren Verständnis des Erlebens und Bewältigens von Krankheit und Therapie. Die geringe Anzahl der Interviews, lässt jedoch vermuten, dass das Spektrum des Erlebens dieser Aspekte damit nicht ausgeschöpft werden konnte. Die Autoren ordnen die Ergebnisse nicht in den Kontext anderer Forschungsergebnisse ein und nennen auch keine Limitationen.
CASP = Critical Appraisal Skills Programme.
Kriterium Ja Nein Unklar
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
|
|
1. Gab es eine klare Aussage zu den Zielen der Forschung? Kommentar: Ziel der Forschung ist, mehr über die Beweggründe von Krebspatientinnen für und gegen die Inanspruchnahme der Misteltherapie zu erfahren und diese Themenfeldern zuzuordnen. |
x |
|
2. Ist eine qualitative Methodik angemessen? Kommentar: Zur Erhebung von Beweggründen zur Inanspruchnahme der Misteltherapie ist die qualitative Methodik angemessen, da es hierzu kaum Evidenz für den deutschsprachigen Raum gibt. |
x |
|
3. War das Forschungsdesign für das Ziel der Forschung angemessen? Kommentar: Ja, semi-strukturierte Interviews und thematische Inhaltanalyse. |
x |
|
4. War die Rekrutierungsstrategie für die Forschungsziele angemessen? Kommentar: Rekrutierung in: Rehabilitationsklinik, Palliativstation, Selbsthilfegruppe, onkologische Schwerpunktpraxis und mehrere Akutkliniken). |
x |
|
5. Wurden die Daten so erhoben, dass das Forschungsproblem beantwortet werden könnte? |
x |
Kommentar: Obwohl die Interviews nicht nur zur Misteltherapie geführt wurden, sondern zu komplementären Therapien im Allgemeinen, gab es zahlreiche Nennungen der Misteltherapie, sodass zahlreiche neue Informationen zum Forschungsproblem gefunden werden konnten. Dennoch sind die Antworten der Befragten sehr stark zusammengefasst und homogen berichtet mit einem bis maximal zwei Ankerbeispielen je Schlüsselfrage, dafür dass jede Patientin zu jeder Frage eine Meinung geäußert hat.
-
6. Wurde das Verhältnis zwischen Forschendem und Teilnehmendem angemessen x
bedacht?
Kommentar: Keine Angaben hierzu in der Publikation.
Abschnitt B: Was sind die Ergebnisse?
-
7. Wurden ethische Fragen berücksichtigt? x
Kommentar: „Das Studienvorhaben wurde der Ethikkommission der medizinischen Fakultät der Universität Freiburg zur Begutachtung vorgelegt. Die Ethikkommission äußerte keine Bedenken hinsichtlich des Studienvorhabens (280/12).“ (S. 217) Weitere ethische Prinzipien wurden nicht genannt.
-
8. War die Datenanalyse ausreichend gründlich? x
Kommentar: Das Vorgehen ist gut geschildert und erscheint für den Zweck ausreichend.
Alle Passagen der Interviews in denen Aussagen zur Misteltherapie gemacht werden, werden durchgesehen und paraphrasiert. Auch Ankerbeispiele werden im Ergebnisteil zitiert. Da die Ankerbeispiele jedoch nicht im Kontext nachverfolgt werden können und die Transkripte der Interviews nicht verfügbar sind, kann nicht beurteilt werden, ob die Datenanalyse gründlich gemacht wurde. Eine Triangulation, bei der die Ergebnisse aus einer weiteren Perspektive bewertet oder in den Kontext gesetzt werden, fehlt.
-
9. Gibt es eine klare Aussage zu den Ergebnissen? x
Kommentar: Schlussfolgerungen sind konsistent mit den Ergebnissen.
Abschnitt C: Sind die Ergebnisse für die Zielpopulation hilfreich?
-
10. Welchen Nutzen hat die Forschung?
Kommentar: Die Einordnung in den Kontext anderer Studien aus den USA, Kanada und einer Studie aus Deutschland ist gegeben, indem beschrieben wird, dass auch in diesen Studien Behandelnden häufig das Wissen zu komplementären Methoden fehlt. Auch Limitationen der Studie werden angegeben: Die Studie ist eine Teilausweitung einer anderen Studie, die Informations- und Beratungsbedürfnisse zu allen KM-Verfahren untersucht hat, deswegen wurde die Misteltherapie nicht standardisiert angesprochen. Patienten, die eine standardonkologische Behandlung ablehnen, sind nicht in der Studienpopulation.
CASP = Critical Appraisal Skills Programme.
|
Kriterium |
Ja |
Nein Unklar |
|
Abschnitt A: Sind die Ergebnisse der Studie gültig? |
||
|
1. Gab es eine klare Aussage zu den Zielen der Forschung? Kommentar: Ziel der Forschung ist die Beantwortung der Frage, ob Mistel sich für die behandelten Patienten nach „Krebs“ oder nach „Mittel gegen Krebs“ anhört, über individuelle und kulturelle Codierung der Mistel als Metapher. |
x |
|
|
2. Ist eine qualitative Methodik angemessen? Kommentar: Die qualitative Methodik ist für die metaphorische Analyse angemessen. |
x |
|
|
3. War das Forschungsdesign für das Ziel der Forschung angemessen? Kommentar: Die Analyse der Transkripte nach der gegenstandsbezogenen Theorie („grounded theory“) ist für den Forschungsgegenstand passend und angemessen. |
x |
|
|
4. War die Rekrutierungsstrategie für die Forschungsziele angemessen? Kommentar: Die Rekrutierung an sich und mögliche Ein- und Ausschlusskriterien sind nicht beschrieben. Der geschützte Rahmen einer tiefenpsychologischen Gruppensitzung eignet sich vermutlich gut, da die Teilnehmer die Gruppe bereits kennen und sich sicher fühlen, um über persönliche Dinge zu sprechen. Dennoch könnten sich die Teilnehmer gegenseitig in deren Wahrnehmung der Misteltherapie beeinflusst haben im Laufe der Zeit, in denen Sie regelmäßig zusammentreffen und als Gemeinsamkeit die Krebserkrankung und die Misteltherapie haben. |
x |
|
|
5. Wurden die Daten so erhoben, dass das Forschungsproblem beantwortet werden könnte? Kommentar: Das Malen der Bilder verbunden mit der Beschreibung durch die Teilnehmer ist eine geeignete Möglichkeit, um die Frage zu beantworten, wie die Mistel mit dem Krebs in der Wahrnehmung in Verbindung steht. Die Analyse der mit der Misteltherapie verbundenen Metaphern nach der grounded theory ermöglicht, unterbewusste Informationen der Teilnehmer zu erhalten. |
x |
|
|
6. Wurde das Verhältnis zwischen Forschendem und Teilnehmendem angemessen bedacht? Kommentar: Nein, zum Verhältnis ist nichts beschrieben. |
x |
|
|
Abschnitt B: Was sind die Ergebnisse? |
||
|
7. Wurden ethische Fragen berücksichtigt? Kommentar: Ethische Aspekte werden nicht adressiert. |
x |
|
|
8. War die Datenanalyse ausreichend gründlich? Kommentar: Die Textanalyse der Transkripte ist transparent beschrieben und für den Leser beziehungsweise die Leserin ist nachvollziehbar, wie die Forschenden zu den Kodierungen gekommen sind. Auch die zur Triangulation der Daten verwendete Literatur wird klar benannt und beschrieben, welche linguistischen und semiotischen Konstrukte untersucht werden. |
x |
|
|
9. Gibt es eine klare Aussage zu den Ergebnissen? Kommentar: Die Mistelmetaphern werden transparent hergeleitet und in einer Tabelle zusammengefasst. |
x |
|
|
Abschnitt C: Sind die Ergebnisse für die Zielpopulation hilfreich? |
||
|
10. Welchen Nutzen hat die Forschung? Kommentar: Die Forschenden untersuchen die Bedeutung der Misteltherapie für die Patientinnen und Patienten, die bereits seit mehreren Monaten, bis zu 1,5 Jahren, mit der Krebserkrankung konfrontiert sind und sich damit auseinandersetzen, indem sie an der Gruppentherapie teilnehmen. Diese un- und unterbewusste Bedeutungsebene wurde in keiner der anderen Studien betrachtet und liefert einen Mehrwert, um die Bedeutung der Mistel für Patientinnen und Patienten zu verstehen. |
||
9.5 Extraktionstabellen
9.5.1 Ergebnisse zur Sicherheit der Misteltherapie
Tabelle 131: Ergebnisse zur Sicherheit
|
Studie, Jahr |
Zielgrößen |
|
Bock (2004a), (2004b) |
Insgesamt UAW: 780 Patientinnen Systemische UAW: 6 von 710 Patienten der Studiengruppe (0,8 %) Ausprägung der systemischen UAW: Schwäche, Hyperaktivität, Zunahme eines topischen Ekzems, Müdigkeit/Erschöpfung, bakterielle Hautinfektion, Unwohlsein, gastrointestinale Symptome Schweregrad, Dauer und Behandlung: „leicht” oder „mittel” (Grad 1 bis 2); Spontanheilung innerhalb weniger Tage Lokale Reaktionen an der Injektionsstelle: 123 Patienten (17,3 %) mit mind. 1 Reaktion Ausprägung lokale Reaktion: Erythem, Verhärtung, Ödem, Juckreiz, Schmerzen, manchmal mit leichtem Fieber, 71 % der lokalen Reaktionen leicht und heilten spontan Behandlungsänderung: 7 Patientinnen Behandlungsabbruch: 4 Patientinnen (0,7 % der Patientinnen mit lokalen Reaktionen) |
|
Eisenbraun (2011) |
Insgesamt UAW: 235 Patientinnen (87 %) Systemische UAW: Abgeschlagenheit (33 %), Kopfschmerzen (24,1 %), unspezifisches Unwohlsein (18,9 %), Schwindel (1 Person) und Dermatitis (1 Person) Schweregrad, Dauer und Behandlung: “leicht” oder “mittel” (Grad 1–2), Spontanheilung innerhalb weniger Tage: nach 1 Tag bei 56,3 %, nach 2 Tagen bei 20 %, bei 19,6 % nicht spezifiziert, bei 4,1 % der Patientinnen länger als 2 Tage. Schwerwiegende Nebenwirkungen: 1 Patientin mit nekrotisierender Kolitis, aber Zusammenhang zu Misteltherapie unwahrscheinlich, eher UAW der Chemotherapie. Lokale Reaktionen an der Injektionsstelle: 235 Patienten (87 %), Ausprägung lokale Reaktion: < 5 cm Durchmesser bei 182 Patientinnen (77,4 %) Behandlungsänderung: keine Behandlungsabbruch: 17 Patientinnen (6,3 %), am häufigsten wegen Unannehmlichkeiten durch regelmäßige Injektionen Sonstiges: 47,8 % haben keine Einschränkungen, 40,4 % haben kleinere Einschränkungen und 8,5 % melden größere Einschränkung durch Misteltherapie; Die Einhaltung der Herstellervorgaben zur Häufigkeit der Injektionen und Dosissteigerung wurden bei den meisten Patientinnen eingehalten. |
|
Loewe-Mesch (2008), von Hagens (2005) |
Insgesamt UAW: n. b. Systemische UAW: in der Mistelgruppe seltener als in der Kontrollgruppe, Anzahl n. b. Ausprägung der systemischen UAW: Temperaturerhöhung, Grippegefühl, Müdigkeit, Kopfdruck, Übelkeit und allgemeine Hautreaktionen Schweregrad, Dauer und Behandlung: n. b. Schwerwiegende Nebenwirkungen: keine Lokale Reaktionen an der Injektionsstelle: vor Beginn der Chemotherapie:15 (45 %) < 5 cm, davon 6 (18 %) > 5 cm; parallel zur Chemotherapie:31 (95 %) < 5 cm, davon 24 (73 %) > 5 cm; nach der Chemotherapie: 18 (55 %) < 5 cm, davon 5 (16 %) > 5 cm Ausprägung lokale Reaktion: Juckreiz oder Rötung und Schwellung < 5 cm oder > 5 cm Behandlungsänderung: 19 Patientinnen (58 %) vorübergehende Dosisreduktion und bei 10 (30 %) kurzfristige Unterbrechung, reduzierte Zieldosis von 2,5 mg ML für gesamte Studie Behandlungsabbruch: keiner |
|
Schumacher (2002), (2003) |
Insgesamt UAW: 28 (12,8 %) Systemische UAW: 6 Fälle (2,7 % Ausprägung der systemischen UAW: 2 Fälle Juckreiz, 2 Fälle allergische Reaktion, 1 Fall Schmerzen und 1 Fall Fieber Schweregrad, Dauer und Behandlung: „leicht” oder „mittel” (Grad 1 bis 2), 3 bis 4 Tage; Abwarten und lokale Therapiemaßnahmen (Salben) und Dosisreduktion Lokale Reaktionen an der Injektionsstelle: 10 (4,6 %) Lokalreaktionen (lokale Reizungen, Infiltrate), 12 (5,5 %) Hautreaktionen (Rötung, Erythem oder Quaddel) Ausprägung lokale Reaktion: 4 von 10 Lokalreaktionen „schwer“ Behandlungsänderung: n. b. Behandlungsabbruch: 3 Patientinnen (je 1 Fall wegen Juckreiz, einer lokalen allergischen Reaktion und lokalem Schmerz) |
|
Semiglazov (2004) |
Insgesamt UAW: 127 Patientinnen (46,7 %) Systemische UAW durch die Misteltherapie: 4 Patientinnen (niedrige Dosis: n = 3, hohe Dosis: n = 1) Ausprägung der systemischen UAW:
Hautreaktion, allergische Bindehautentzündung, Kopfschmerzen,
retikuloendothelialen Systems (Placebo: 20 %, niedrige Dosis: 22,4 %, mittlere Dosis: 16,4 %, hohe Dosis: 20,6 %), Erkrankungen des Magen-Darm-Trakts (Placebo: 8,6 %, niedrige Dosis: 9,0 %, mittlere Dosis: 9,0 %, hohe Dosis: 14,7 %), Schwächung des Abwehrsystems (Placebo: 5,7 %, niedrige Dosis: 6,0 %, mittlere Dosis: 7,8 %, hohe Dosis: 8,8 %) und Anomalitäten bei den roten Blutkörperchen (Placebo: 5,7 %, niedrige Dosis: 3,0 %, mittlere Dosis: 3,0 %, hohe Dosis: 11,8 %) Schweregrad, Dauer und Behandlung: Die vier systemischen UAW waren “leicht” oder “mittel” (Grad 1–2), eine Dauer oder Behandlung ist nicht beschrieben. Das Erythem ist nach dem Absetzen der Misteltherapie wieder verschwunden, (siehe auch Hinweis unter „sonstige Anmerkungen“) Schwerwiegende Nebenwirkungen: 1 Patientin, aber kein Zusammenhang mit der Misteltherapie Lokale Reaktionen an der Injektionsstelle: geringe Dosis: 6 (9 %), mittlere Dosis: 12 (17,9 %), hohe Dosis: 21 (32,4 %), Ausprägung lokale Reaktion: n. b. Behandlungsänderung: nur bei der Patientin, die später verstorben ist, aber kein Zusammenhang zwischen Mistel und Ableben Behandlungsabbruch: 2 Patientinnen; 1 Patientin aus der Gruppe mit der geringen Dosis (keine Begründung) und eine Patientin aus der Gruppe mit der hohen Dosis (Abbruch wegen eines Erythems, das möglicherweise auf die Studienmedikation zurückzuführen ist); Kein Abbruch aufgrund der lokalen Reaktionen Sonstige Anmerkungen:
Misteltherapie abgebrochen hatte, ist das Erythem nach Absetzen der Studienmedikation vollständig verschwunden, jedoch erlitt die Patientin wenige Tage später unabhängig von der Misteltherapie eine ulceröse nekrotische Kollitis, eine febrile Neutropenie und ein toxisches Schocksyndrom aufgrund der Infektion und verstarb.
Chemotherapiezyklen eine Tendenz für weniger Leukopenie und Granulozytopenie |
|
Semiglazov (2006) |
Insgesamt UAW: 82 (28,4 %); zum Vergleich, in der Placebogruppe gab es 63 UAW Systemische UAW und deren Ausprägung: Rötungen und allergische Hautreaktionen Schweregrad, Dauer und Behandlung: „leicht” oder „mittel” (Grad 1 bis 2); keine Behandlung beschrieben, lediglich dass es keine Abbrüche aufgrund der Mistelextrakte gab, daher ist eine Spontanheilung ohne Behandlung wahrscheinlich Schwerwiegende Nebenwirkungen: keine (1 Patientin entwickelte eine akute Otitis, aber ausgelöst durch die Chemotherapie) Lokale Reaktionen an der Injektionsstelle: 31 (17,6 %) Ausprägung lokale Reaktion: Behandlungsabbruch: 1 Patientin (allergische Hautreaktion) |
|
Tröger (2009), (2014) |
Insgesamt: Iscador®: lokale Reaktionen bei 6 Injektionen, keine systemischen UAW Helixor® A: insgesamt 45 UAW bei 20 Patientinnen (59 %) Ausprägung systemische UAW Helixor® A:
Schweregrad und Behandlung: Moderat; Dauer und Behandlung unbekannt, führte zum Studienabbruch Schwerwiegende Nebenwirkungen bei Helixor® A: 27 der lokalen Reaktionen Lokale Reaktionen an der Injektionsstelle > 5cm mit:
(1,8 %) der 1.527 Injektionen schwer (Grad 3) Ausprägung lokale Reaktion: Entzündungen > 5 cm Behandlungsabbruch mit Zusammenhang zur Misteltherapie: 1 Patientin wegen Rhinokonjunktivitis (bereits vor Beginn der Studie und wurde ersetzt) Sonstiges: Neutropenie und lokale Reaktionen unter 5cm wurden nicht als UAW gewertet; Messung der Injektionen anstatt der Patientinnen mit UAW; Zwei weitere UAW ohne Zusammenhang mit der Misteltherapie (Helixor) werden nicht einbezogen. |
10 Danksagung
Wir möchten uns herzlich bei Frau Dr. med. Silke Siebert für die Durchsicht und Qualitätssicherung des Manuskripts und bei Frau Mag. Lisa-Maria Kofler für ihre Unterstützung bei der Bewertung der CASP-Checklisten für einige der Studien bedanken.
Die systematische Bewertung medizinischer Prozesse und Verfahren, Health Technology Assessment (HTA), ist mittlerweile integrierter Bestandteil der Gesundheitspolitik. HTA hat sich als wirksames Mittel zur Sicherung der Qualität und Wirtschaftlichkeit im deutschen Gesundheitswesen etabliert.
Seit Einrichtung der Deutschen Agentur für HTA des DIMDI (DAHTA@DIMDI) im Jahr 2000 gehören die Entwicklung und Bereitstellung von Informationssystemen, speziellen Datenbanken und HTA-Berichten zu den Aufgaben des DIMDI.
Das DIMDI wurde gemäß Artikel 16a des Medizinprodukte-EU-Anpassungsgesetzes am 26. Mai 2020 in das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eingegliedert.
Im Rahmen der Forschungsförderung beauftragte das DIMDI qualifizierte Wissenschaftlerinnen und Wissenschaftler mit der Erstellung von HTA-Berichten, die Aussagen machen zu Nutzen, Risiko, Kosten und Auswirkungen medizinischer Verfahren und Technologien mit Bezug zur gesundheitlichen Versorgung der Bevölkerung. Dabei fallen unter den Begriff Technologie sowohl Medikamente als auch Instrumente, Geräte, Prozeduren, Verfahren sowie
Organisationsstrukturen. Vorrang haben dabei Themen, für die gesundheitspolitischer Entscheidungsbedarf besteht.
ISSN: 1864–9645
Institute of Public Health, Medical Decision Making and Health Technology Assessment, Department of Public Health, Health Services Research and Health Technology Assessment, UMIT – University for Health Sciences, Medical Informatics and Technology, Hall i. T., Österreich
Institut für Ethik, Geschichte und Philosophie der Medizin, Medizinische Hochschule Hannover, Hannover, Deutschland
Institute for Technology Assessment and Department of Radiology, Massachusetts General Hospital, Harvard Medical School, Boston, MA, USA
Center for Health Decision Science, Department of Health Policy and Management, Harvard T.H. Chan School of Public Health, Boston, MA, USA
Wurden die den Kosten zugrundeliegenden Mengengerüste hinreichend gründlich dargestellt?
Wurden adäquate Quellen und Methoden zur Ermittlung der Mengengerüste gewählt und eindeutig genannt?
Wurden die den Kosten zugrundeliegenden Preisgerüste hinreichend gründlich beschrieben?
Wurden adäquate Quellen und Methoden zur Ermittlung der Preise gewählt und eindeutig genannt?
Wurden die einbezogenen Kosten anhand der gewählten Perspektive und des gewählten Zeithorizonts schlüssig begründet und wurden alle relevanten Kosten berücksichtigt?
Wurden Daten zu Produktivitätsausfallskosten (falls berücksichtigt) getrennt aufgeführt und methodisch korrekt in die Analyse einbezogen?
Wurde die Währung genannt?
I30 Wurden Preisanpassungen bei Inflation oder Deflation adäquat durchgeführt?
I31 Wurden zukünftige Gesundheitseffekte und Kosten adäquat diskontiert?
I32 Wurde das Referenzjahr für die Diskontierung angegeben beziehungsweise bei fehlender Diskontierung das Referenzjahr für die Kosten?
I34 Wurde die Wahl der Diskontraten beziehungsweise der Verzicht auf eine Diskontierung plausibel begründet?
Kosten
Die den Kosten zugrundeliegenden Mengengerüste wurden nicht hinreichend dargestellt. Zwar wurde für die Misteltherapie oder Tamoxifen ausführlich beschrieben, wie sich die Kosten für die Mengengerüste ergeben, aber die entscheidenden stationären Kosten wurden nur unzureichend beschrieben. Weder wurde die Anzahl der Tage noch der Pflegesatz angegeben. Die Preisgerüste wurden nur beispielhaft für Tamoxifen, Helixor® und Paclitaxel beschrieben, aber wichtige Bereiche im ambulanten und stationären Bereich fehlen. Die beiden Hauptquellen für die Preise sind genannt worden (Rote Liste und Arzneiverordnungs-Report), jedoch ist nicht transparent, woher die Pflegesätze stammen.
Auch bei der Beschreibung der Preisgerüste ist nicht nachvollziehbar, wie die verwendeten Preise tatsächlich zustande kommen. Die einzelnen Preise können keinem konkreten Jahr zugeordnet werden. Die Preise wurden nicht an eine mögliche Inflation oder Deflation angepasst.
Diskontierung
Weder ein Inflationsausgleich noch eine Diskontierung wurden durchgeführt. Da die Patientinnen spätestens ab 2001 die Nachsorge begonnen haben, bis circa 2005, wäre ein Inflationsausgleich im Jahre 2008/2009 durchzuführen gewesen (I30).
Fehler in der Publikation von Tröger et al. (2014): Die Summe der lokalen Reaktionen nach Schweregraden beträgt 42 und unterteilt nach Schweregraden 41
UAW = Unerwünschte Arzneimittelwirkung; niedrige Dosis: 10 ng(ML)/ml; mittlere Dosis: 30 ng(ML)/ml; hohe Dosis: 70 ng(ML)/ml;
n. b. =nicht beschrieben.